抗人IL-17C单克隆抗体的制备和功能鉴定
2024-01-11张光远张芳菲王依凡尹建永汪年松
刘 丽,张光远,张芳菲,王依凡,尹建永,汪年松,王 锋
(1.上海交通大学医学院附属第六人民医院肾内科,上海 200233; 2.东南大学附属中大医院泌尿外科,南京 210009)
IL-17细胞因子家族由6个成员组成,包括IL-17A、IL-17B、IL-17C、IL-17D、IL-17E(也称为IL-25)和IL-17F。它们通过与受体结合发挥生物学效应,已经发现的IL-17受体包括IL-17RA、IL-17RB、IL-17RC、IL-17RD和IL-17RE。IL-17受体家族的特征性结构是受体位于细胞质尾部的称之为“SEF/IL-17R(SEFIR)”的保守区域[1],SEF/IL-17受体(SEF/IL-17R,SEFIR)与Toll/IL-1受体(Toll-IL-1 receptor,TIR)结构域相似,都属于STIR(SEFIR and TIR)-结构域超家族[2]。IL-17C与IL-17A的受体有共同的IL-17RA链,生物学功能也相似,而与IL-17A明显不同之处是,IL-17C主要是上皮细胞源性的细胞因子[3]。IL-17RE是IL-17C的特异性受体,在上皮细胞和Th17细胞中高度诱导表达,并与IL-17RA形成异二聚体受体复合物,进而通过NF-κB和MAPK等途径传递信号[4-5]。IL-17C可通过自分泌或旁分泌方式与该IL-17RA/IL-17RE复合物结合,引起炎症反应,促进促炎症细胞因子、趋化因子和抗菌肽的释放[3,6]。IL-17C通过与膜表面受体IL-17RE结合,促进Th17细胞活化。Th17细胞活化一方面可激活适应性免疫系统,增强机体抵御感染的能力而起到免疫保护作用;另一方面其过度活化可导致炎症放大而致病。已有研究表明,多种自身免疫性疾病与Th17细胞的过度活化有关[7-8]。
在过去的20年中,IL-17C在人类疾病的动物模型和人的标本中得到了广泛的研究。在许多疾病中,从感染性疾病到自身免疫性疾病,甚至是肿瘤性疾病,都观察到IL-17C水平增加[9-12]。IL-17C不仅在机体抵御感染方面发挥保护作用,还起致病作用,导致不受控制的炎症,而用中和抗体抑制IL-17C显示出保护效应[13]。尽管已经知道IL-17C与这些疾病的发病机制有关,但目前,可用的商品化的人IL-17C单克隆抗体还很少,这阻碍了对疾病的进一步研究。因此,开发和制备人IL-17C单克隆抗体对于阐明IL-17C相关疾病的发病机制具有重要意义和价值。
临床上,针对IL-17A或其受体IL-17RA的抗体类药物在靶向治疗某些自身免疫性疾病中取得了巨大的成功。例如,IL-17A特异性抗体如苏金单抗已经在中重度斑块状银屑病患者的系统性生物治疗中应用了数年[14]。该单抗也被应用于强直性脊柱炎患者的治疗,能够显著缓解他们的症状和体征[15]。司库奇尤单抗可应用于中、重度斑块状银屑病和关节病型银屑病。鉴于靶向IL-17A或IL-17RA的抗体在临床实践中出色的应用价值,寻找IL-17C特异性抗体,为患者提供更多的治疗选择具有重要意义。MOR106(诺华)是一种IL-17C特异性抗体,能够选择性地与人和小鼠IL-17C结合,从而抑制IL-17C与IL-17RE的结合。临床前研究表明,MOR106可以缓解银屑病和特应性皮炎实验动物模型的皮肤炎症[13]。目前,MOR106已在中重度特应性皮炎患者中完成了Ⅰ期临床试验(ClinicalTrials.gov Identifier:NCT03568071),试验结果进一步验证了其治疗效果。本课题组最近证实了IL-17C在肾脏缺血/再灌注损伤(IRI)中的致病作用,发现用中和抗体或IL-17RE敲除抑制IL-17C可以改善肾小管损伤、肾脏氧化应激和肾脏炎症[16]。因此,针对IL-17C的抗体药物具有良好的治疗应用前景。
本研究利用杂交瘤技术成功制备了9株新的抗人IL-17C中和性单克隆抗体。这些新的单抗具有受体阻断活性明显和特异性强的特性,可协助为进一步研究IL-17C的生物学功能和相关疾病的发病机制,以及开发针对IL-17C的新型抗体药物奠定基础。
1 材料与方法
1.1 实验动物和细胞
6周龄雌性BALB/c小鼠,体重(20±2) g,购自中国科学院上海实验动物中心。动物饲养于SPF级动物房,并按照中国科学院动物护理和使用指南进行照料、饲养和使用。骨髓瘤细胞系SP2/0由中国科学院细胞库提供。
1.2 试剂与仪器
人IL-17C蛋白、小鼠IL-17C蛋白、人IL-17RE、重组人IL-17A、IL-17B、IL-17E和IL-17F蛋白(购自百普赛斯,中国);重组HA1乳液;PBS缓冲液;弗氏完全佐剂、弗氏不完全佐剂、HAT培养基、四甲基联苯胺(TMB)、小鼠抗体亚型分型试剂盒(重链)(Sigma,美国);胎牛血清(Hyclone,美国);辣根过氧化物酶(HRP)标记的山羊抗小鼠IgG抗体(Biolegend,美国);RPMI 1640培养基(Gibco,美国);小鼠抗体亚型分型试剂盒(轻链)(博奥龙,中国);体外杂交瘤细胞培养基、微孔板读数仪、二氧化碳培养箱、液氮罐、高速冷冻离心机(Thermo Fisher Scientific,美国);Protein G层析柱(Cytiva,美国);重组人IL-17D蛋白(Abcam,英国);37 ℃培养箱(上海一恒科学仪器有限公司,中国);超低温冰箱(Panasonic,日本);移液枪(Eppendorf,德国);蛋白电泳仪(天能,中国);烘箱(博迅,中国);显微镜(奥林巴斯有限公司,中国)。
1.3 用于免疫和功能分析的抗原
本研究利用AcroBiosystems公司提供的人IL-17C蛋白作为免疫原免疫小鼠。该蛋白表达于HEK293细胞,含有组氨酸标签ILC-H52H7。该蛋白质含有AA His19-Val197(Accession #Q9P0M4-1),SDS-PAGE凝胶电泳测定其纯度高于95%,并保留了IL-17C的天然构象,因此,是制备中和IL-17C单克隆抗体的理想抗原。利用AcroBiosystems公司提供的小鼠IL-17C蛋白作为交叉反应检测的抗原。该蛋白含有AA Asp 17-Gln 194(Accession #Q8K4C5-1),由HEK293细胞表达,并含有组氨酸标签ILC-M52H7。为了测定所制备的单克隆抗体是否能够阻断IL-17C与其受体的结合,采用人IL-17C的特异性受体人IL-17RE对其进行功能分析。该蛋白表达于HEK293,含有AA Thr155-His454。
1.4 单克隆抗体的制备和功能鉴定
1.4.1 动物免疫 取4只6周龄雌性BALB/c小鼠,编号分别为1,2,3和4,以人IL-17C蛋白作为免疫原免疫小鼠,免疫方案所示见表1。

表1 小鼠免疫方案
1.4.2 细胞融合 加强免疫3 d后,收获小鼠脾细胞并使用50% PEG(W/V)与骨髓瘤细胞系SP2/0(中国科学院细胞库)融合,并分布在96孔板中。
1.4.3 阳性杂交瘤细胞的筛选 细胞融合后第10 d,使用ELISA法筛选每个孔培养物上清液对IL-17C蛋白的抗体反应性。
1.4.4 阳性杂交瘤细胞的扩增和克隆化培养 利用有限稀释法对杂交瘤细胞进行克隆化培养。3个周期后,建立了杂交瘤克隆。其中,确定为阳性克隆的孔,将这一孔的细胞扩增和冻存。
1.4.5 单克隆抗体的大规模制备 将杂交瘤细胞置于PFHM-Ⅱ无蛋白培养基中培养。在体外培养过程中,杂交瘤细胞可分泌抗人IL-17C单克隆抗体,收集培养上清液,离心去除细胞及其碎片,最终获得所需要的单克隆抗体。
1.4.6 单克隆抗体的效价检测 竞争ELISA法筛选具有受体阻断活性的杂交瘤克隆。
1.4.7 单克隆抗体的纯度鉴定 使用Protein G层析柱对单克隆抗体进行纯化,并对纯化后的单抗进行SDS-PAGE凝胶电泳,分析所纯化抗体蛋白的纯度。
1.4.8 单克隆抗体的交叉反应性测定 利用竞争ELISA法测定单克隆抗体是否与小鼠IL-17C发生交叉反应。
1.4.9 单克隆抗体的特异性鉴定 取人重组IL-17C蛋白抗原适量以及等量人重组IL-17A、IL-17B、IL-17C、IL-17D、IL-17E和IL-17F蛋白,再分别取浓度为1.5 mg/mL的hIL-17C-7F10和hIL-17C-10A7作为一抗,用PBS将单抗稀释成浓度为1.000 μg/mL,山羊抗小鼠IgG-HRP为二抗(稀释比例为1∶2 000),利用ELISA法检测单抗是否特异性识别人IL-17C。
1.4.10 单克隆抗体的亚型鉴定 按照小鼠抗体亚型分型试剂盒说明书鉴定单克隆抗体重链和轻链的亚型。
1.4.11 抗人IL-17C单抗7F10的免疫荧光鉴定 以抗人IL-17C单抗7F10为一抗(1∶100稀释),山羊抗小鼠IgG-HRP为二抗(1∶500稀释),利用免疫荧光检测IL-17C在人肾组织的表达与分布。
1.4.12 抗人IL-17C单抗7F10的免疫组化鉴定 以抗人IL-17C单抗7F10为一抗(1∶250稀释),山羊抗小鼠IgG-HRP为二抗(1∶1 000稀释),利用免疫组织化学法检测IL-17C在人肾组织的表达与分布。
2 结 果
2.1 第3次免疫后小鼠抗血清效价ELISA检测结果
小鼠第2次免疫后,眼球采血并分离血清,利用ELISA法检测小鼠血清抗hIL-17C抗体的效价,结果见表2。以阳性血清与阴性血清之比(P/N)≥2.1时为阳性的判断标准,小鼠1血清抗体高于1∶40 500;小鼠2血清抗体效价高于1∶4 500,小鼠3血清抗体效价高于1∶121 500;小鼠4血清抗体效价高于1∶364 500。根据结果可知其中编号为1,3和4的小鼠抗血清效价较高,免疫效果较好,可用于进一步的细胞融合。

表2 第3次免疫后小鼠血清抗体效价ELISA检测结果
2.2 ELISA法筛选具有人IL-17C受体阻断活性的抗体
细胞融合后,使用ELISA法建立了与人IL-17C蛋白强烈反应的杂交瘤克隆。进一步用竞争ELISA法筛选具有受体阻断活性的杂交瘤克隆。将细胞培养上清液与500 ng/mL hIL-17RE预孵育,如果待测抗体具有受体阻断作用,IL-17RE与包被抗原IL-17C的结合将显著降低。最终,筛选出9株表现出显著的受体阻断活性的杂交瘤克隆,见图1。
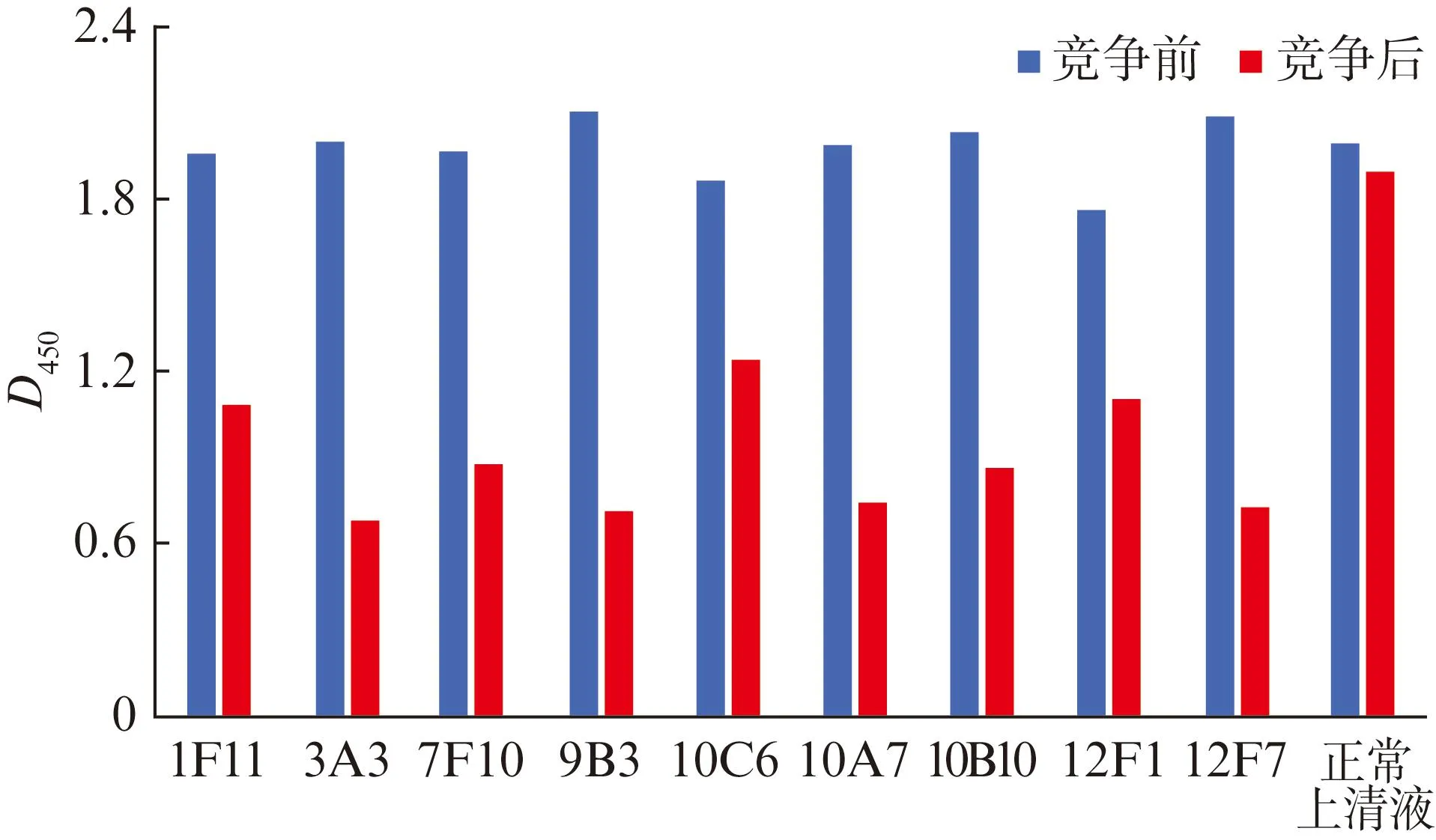
图1 单克隆抗体受体阻断活性测定结果
2.3 单克隆抗体的纯度鉴定
经Protein G亲和层析纯化后,对纯化的单克隆抗体进行SDS-PAGE凝胶电泳。可观察到纯化后的抗体纯度很高,在相对分子质量约52 000和25 000处分别可见重链、轻链2个条带,见图2。
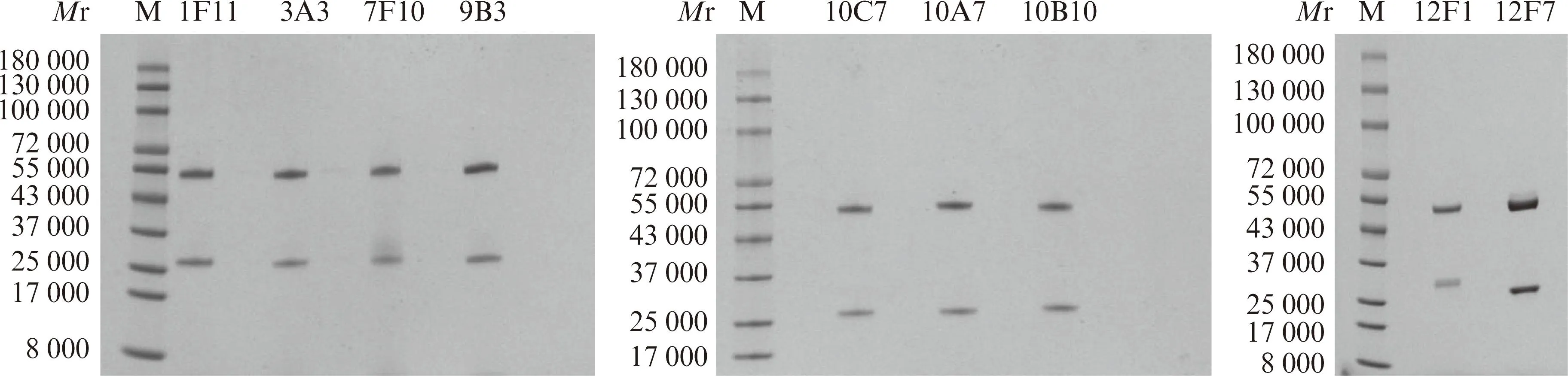
图2 纯化后抗体SDS-PAGE分析
2.4 交叉反应性鉴定
人和小鼠IL-17C的氨基酸序列相似性为83%,因此对得到的单克隆抗体能否与小鼠IL-17C发生交叉反应进一步测定。将单克隆抗体细胞培养上清液与1 μg/mL mIL-17C预孵育1 h以及不与任何蛋白孵育,利用竞争ELISA法测定其交叉反应性。结果表明,克隆7F10和10A7可与人和小鼠IL-17C发生交叉反应,见图3。
2.5 单克隆抗体7F10和10A7的特异性鉴定
分别利用抗人IL-17C单抗7F10和10A7为一抗,山羊抗小鼠IgG-HRP为二抗,取人重组IL-17A、IL-17B、IL-17C、IL-17D、IL-17E和IL-17F蛋白抗原适量,进行ELISA检测。结果表明,hIL-17C-7F10和hIL-17C-10A7均选择性结合人IL-17C,而未观察到与人IL-17A、IL-17B、IL-17D、IL-17E或IL-17F发生交叉反应,见图4。
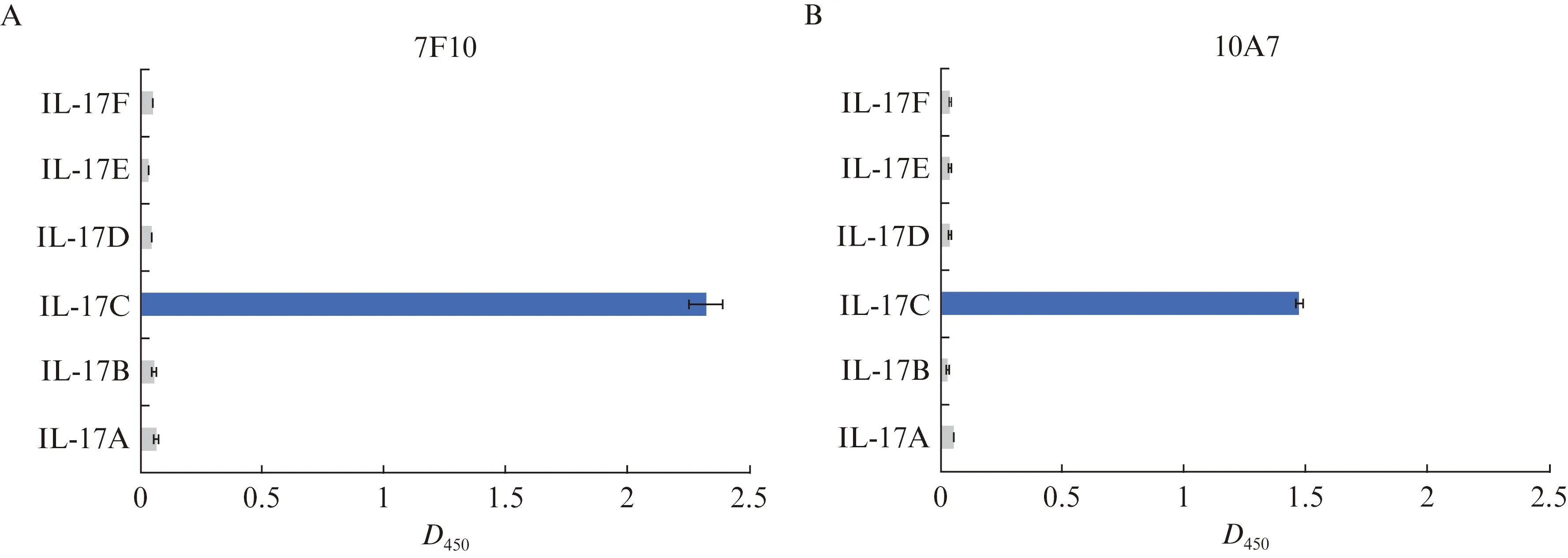
图4 单克隆抗体7F10和10A7选择性结合人IL-17C
2.6 单克隆抗体7F10和10A7的亚型鉴定
采用抗体亚型分型试剂盒进行鉴定,结果显示,单克隆抗体7F10和10A7均属于IgG1亚类,轻链为κ型,见图5。
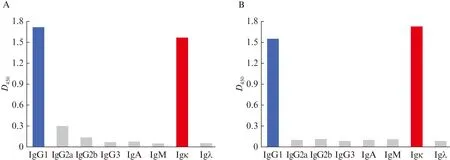
图5 单克隆抗体7F10和10A7亚型鉴定
2.7 抗人IL-17C单抗7F10的免疫荧光鉴定
以抗人IL-17C单抗7F10为一抗,利用免疫荧光技术,成功检测到IL-17C在正常人肾组织的表达。IL-17C主要表达在肾小管[16]。免疫荧光结果显示,抗人IL-17C单抗7F10可与肾小管组织发生反应,产生特异性的红色荧光,而肾小球中未见特异性红色荧光,见图6。

图6 单克隆抗体7F10的免疫荧光鉴定
2.8 抗人IL-17C单抗7F10的免疫组化鉴定
以抗人IL-17C单抗7F10为一抗,利用免疫组织化学技术,成功检测到IL-17C在正常人肾组织的表达。IL-17C主要表达在肾小管[16]。免疫组化结果亦显示,人正常肾组织肾小管表达IL-17C,而肾小球不表达IL-17C,见图7。
3 讨 论
过去对于IL-17细胞因子家族的研究集中在IL-17A,将其作为自身免疫性疾病的重要分子之一。近年来,越来越多的证据显示,IL-17C参与了宿主黏膜抗感染防御反应和多种自身免疫性疾病的发病机制。Krohn等[8]首次报道了IL-17C在免疫介导的肾小球疾病中的致病作用;WANG等[16]最近进一步证实了IL-17C在缺血性急性肾损伤(acute kidney injury,AKI)中的致病作用,这引起了人们对IL-17C在肾脏疾病中潜在参与的高度关注。尽管IL-17C在黏膜抗感染免疫反应中起着保护作用,但其在炎症刺激下在不同上皮组织中更经常发挥着致病作用。然而,IL-17C如何参与自身免疫性疾病和肾脏疾病的发病机制还未阐明。可能的致病机制如下:(1) IL-17C在炎症反应中发挥炎症放大器作用。IL-17C能够促进促炎症细胞因子和趋化因子的表达以及中性粒细胞的募集[11,16]。(2) IL-17C促进Th17细胞应答。Th17细胞以分泌IL-17A、IL-17F为主要特征,它还能分泌产生IL-10、IL-21、IL-22、IL-6和TNF-α等细胞因子,参与了多种炎症性和自身免疫性疾病的病理过程[17]。(3) IL-17C增强了IL-2的表达以促进NK细胞的活化。根据Huang等[7]的研究,在自身免疫性肝炎模型中,在Con A的刺激下,肝细胞产生的IL-17C与其在肝脏驻留T细胞中表达的受体IL-17RE结合,促进T细胞分泌IL-2,进一步激活NK细胞,引起肝脏损伤。在所研究的潜在信号通路中,用具有受体阻断活性的中和性单克隆抗体进行干扰,将有助于进一步探索IL-17C的生物学功能和阐明相关疾病的发病机制。
最近研究表明,与IL-17A和IL-17F相比,IL-17C在疾病早期即上调[18]。根据一项关于COVID-19的最新前瞻性研究,IL-17C在早期就被上调,无症状参与者血清中IL-17C的水平明显高于有症状的参与者,这表明IL-17C可能保护肺部免受组织损伤和缓解随后的临床症状[19]。在多种自身免疫性疾病,如银屑病、特应性皮炎和实验性自身免疫性脑脊髓炎(experimental autoimmune encephalomyelitis,EAE)中观察到IL-17C的水平升高[13,20]。对中度至重度银屑病患者的血浆蛋白分析表明,经过系统治疗的患者的IL-17C的循环水平低于未治疗的患者[21]。因此,可以考虑将循环IL-17C作为一种潜在的生物标志物来评估系统性抗银屑病治疗的效果。在患有肾脏疾病的患者或小鼠模型中也观察到IL-17C的水平升高。例如,与健康对照组相比,急性抗中性粒细胞胞质抗体(mlli-neutrophil cyto-plasmic antibodies,ANCA)相关的新月形肾小球肾炎患者的血清中IL-17C水平明显增加,而IL-17A、E或F则没有[8]。此外,IL-17C在AKI患者和小鼠的肾脏活检中也明显增加[16]。由于IL-17C水平在多种疾病中均有不同程度的升高,因此,IL-17C单克隆抗体可用于通过ELISA等免疫学检测方法来量化IL-17C在疾病中的表达,并结合各种临床参数为这些疾病的诊断和治疗提供新策略。
本研究用HEK293表达的人IL-17C蛋白作为抗原免疫BALB/c小鼠,通过细胞融合和杂交瘤技术,成功筛选出9株可稳定分泌具有显著的受体阻断效应的杂交瘤细胞株,分别命名为1F11、3A3、7F10、9B3、10C6、10A7、10B10、12F1和12F7。抗体的主要药用价值之一在于是否具有受体阻断活性[22]。筛选出既能识别人又能识别小鼠IL-17C的单克隆抗体可直接在小鼠模型中完成药效实验,有利于将来治疗性单抗的进一步开发,否则要用转人IL-17C的转基因小鼠做药效实验,开发难度将大很多。因此,本研究利用竞争ELISA法鉴定制备的单抗是否既能识别人又能识别小鼠IL-17C,结果表明,单抗7F10和单抗10A7可以引起人和小鼠IL-17C之间的交叉反应。亚型鉴定结果显示二者均为IgG1亚类,轻链为κ型。但是,此技术生产的是鼠源性的单克隆抗体,用于人身上会产生强烈的免疫反应。因此,未来的研究需要通过人源化对单克隆抗体进行进一步改造,以满足医疗需求。目前,已有多种抗体人源化改造策略,可以显著减少潜在的免疫原性风险,而几乎不改变其对抗原的高亲和力和强特异性,生物活性也较少改变[23]。这些方式改造的人源化单克隆抗体有助于从基础成功转化到临床。如能成功进行人源化改造,则可能对IL-17C介导的免疫炎症性疾病具有临床应用价值。
总之,本研究中抗人IL-17C单克隆抗体的成功制备为进一步开发人源化IL-17C单克隆抗体和新的针对IL-17C的靶向药物用于IL-17C相关疾病的免疫治疗提供了可能。此外,目前检测IL-17C表达的免疫检测方法价格昂贵,不能很好地用于临床,而本研究中制备的单克隆抗体7F10作为一抗可应用于免疫荧光和免疫组化检测,可能有助于改进用于IL-17C的免疫检测方法,如Western印迹法检测、免疫荧光检测、免疫组织化学和IL-17C ELISA试剂盒。
