基于网络药理学和分子对接技术探讨高良姜治疗痛风和高尿酸血症的作用机制
2024-01-10任腾腾于潇飞李云刘业志张同妍郭中原
任腾腾,于潇飞,李云*,刘业志,张同妍,郭中原
(1.山东中医药大学 药学院,山东 济南 250355;2.山东省立第三医院 药学部,山东 济南 250031;3.中国中医科学院 中药研究所,北京 100700;4.河南中医药大学 药学院,河南 郑州 450000)
当前,随着社会的发展,人民生活水平逐渐提高,痛风和高尿酸血症已成为临床常见病,高尿酸血症临床表现为血清尿酸(UA)含量升高(男性UA ≥ 420 μmol/L,女性UA ≥ 360 μmol/L)。当血清 UA 水平高于正常阈值时,尿酸单钠(MSU)晶体沉积在关节上,引起关节损伤和炎症反应,最终使人患上痛风[1-2]。近年来,痛风和高尿酸血症的发病率和患病率逐年增加[3]。全球痛风患病率在 0.1% 到 10% 之间[4];2016 年统计显示中国痛风发病率为 5.61%,并呈逐年上升趋势[5]。具有易诊难治,复发率较高的特点,严重降低患者的生活质量。因此,降低血清UA含量是预防和治疗痛风、高尿酸血症的主要措施[6]。目前,临床上对于痛风和高尿酸血症主要有物理治疗、药物治疗以及手术治疗等,但因发病机制复杂,均无法根治。临床上常用的药物如别嘌醇、苯溴马隆等均存在不同程度的不良反应[7-9]。因此,寻找和开发活性优良的降低血清UA药物迫在眉睫。近年来科学研究已经证实,高良姜中的黄酮类成分能显著降低高尿酸血症小鼠的血清UA水平[10-11]。高良姜我国的传统中药材,具有温胃止呕,散寒止痛的功效。黄酮类、挥发油和二苯基庚烷等是其主要化学成分[12-13]。药理研究发现,高良姜具有抗氧化、抗胃溃疡、抗炎等作用[14-15]。在民间,高良姜被广泛用作食材、汤料、调味品以及香料等,对其进行降尿酸产品开发可带来较好的经济和社会效益。然而,高良姜治疗痛风和高尿酸血症的机制尚不清楚,尤其是其有效化学成分的分子靶点机制,因此,有必要对高良姜治疗痛风和高尿酸血症的具体靶点和通路等进一步探索。
本研究首先运用网络药理学,建立了“成分-疾病-靶点-通路”网络关系图,再通过蛋白质-蛋白质交互作用和靶点富集分析,最后筛选出活性成分,分析高良姜治疗痛风和高尿酸血症的分子机制,并利用分子对接验证活性成分与蛋白的亲和力,为高良姜治疗痛风和高尿酸血症的作用机制研究提供依据。
1 材料与方法
1.1 高良姜化学成分及其作用靶点的收集
药物化学成分及靶标数据来源于TCMSP数据库(http://tcmspw.com/tcmsp.php)[16],以“高良姜”为关键词检索化学成分,对高良姜的有效成分进行筛选,其中设定口服生物利用度(OB)≥ 30%,类药性(DL)≥ 0.18。从TCMSP中获取相筛选成分的靶点,并利用Uniprot数据库进行靶点名称规范。基于Pubchem数据库[17]获得上述化合物的SDF结构。
1.2 高尿酸血症和痛风疾病作用靶点的收集
以“hyperuricemia”、“gout”为关键词使用OMIM数据库,Disgenet数据库,Genecards数据库进行检索,得到高尿酸血症和痛风疾病作用靶点。
1.3 高良姜-高尿酸血症和痛风共同靶点的筛选
运用Venny2.1在线作图工具,导入高良姜筛选成分作用靶点、痛风及高尿酸血症相关靶点,绘制韦恩图,两者取交集后获得高良姜药物-痛风及高尿酸血症共同靶点,即为高良姜治疗痛风及高尿酸血症的潜在作用靶点。
1.4 网络构建及分析
运用Cytoscape 3.7.2软件将“高良姜-化学成分-作用靶点-高尿酸血症和痛风疾病”网络图可视化,通过Network Analyzer对网络图进行药物、成分、靶标、通路之间的拓扑计算分析,Degree值代表了化学成分与作用靶点之间的相关个数,而Degree数值由大到小表代表化学成分关键程度由大到小,从而获得核心成分。
1.5 PPI网络构建及核心靶点分析
将高良姜与疾病的共同靶点导入STRING数据库,确定蛋白种类为“Homo sapiens”,设置最低相互作用阈值参数0.4,再获取PPI网络关系数据后,将数据导入Cytoscape软件,绘制PPI网络图,其中,Degree值的高低根据节点的大小、颜色及其深浅变化不同表示。基于拓扑分析筛选核心靶点,将PPI网络导入Cystoscap 3.7.2中,使用NetworkAnalyzer工具进行拓扑解析,以degree,betweenness centrality,average shortest path length 和closeness centrality四种参数为参考标准,选择degree分值超过平均分的基因为核心靶点,使用R 3.6.1工具绘制靶点条形图。
1.6 GO和KEGG富集分析及可视化
为了说明中药化合物对应的预测靶点在基因功能和通路中的作用,运用R软件Bioconductor生物信息软件进行关键靶基因的GO和KEGG富集分析(P<0.05,Q<0.05),输出可视化条形图及气泡图。
1.7 分子对接验证
LibDock 是 Discovery Studio 中的一种对接方法[8]。 通过这种计算机辅助虚拟活性筛选的方法,可以在不进行实验的情况下的筛选出小分子的活性,经过多年的发展,该方法准确性高,操作简便,可进行小分子高通量活性筛选,是目前药物研究领域较为重要的一种技术。在 PPI 网络的核心靶标中,选择前 5 个靶标进行分子对接虚拟活性验证。在Discovery Studio 19.0(Chuang Teng Technology Co.,Ltd.,Beijing,China)中,使用Libdock算法评估化合物与痛风和高尿酸血症靶点之间的潜在分子结合模式。结合位点分别基于共结晶配体与 5 个靶标的结合来定义。在对接筛选实验之前,去除靶标蛋白共结晶配体,并使用相同的参数将制备的配体与蛋白质对接。根据对接结果,选择具有最低对接能量的最佳得分对接模型代表化合物的最佳配体结合位点。对于每个配体,计算相互作用能量以定义配体和受体之间的相互作用,并分析预测的结合相互作用。
2 结果与分析
2.1 对高良姜的化学成分的筛选
在TCMSP数据库中设定OB ≥ 30%、DL ≥ 0.18,对高良姜的有效成分进行筛选,共得到潜在活性成分13个(表1),TCMSP数据库筛选出180个活性成分作用靶点。
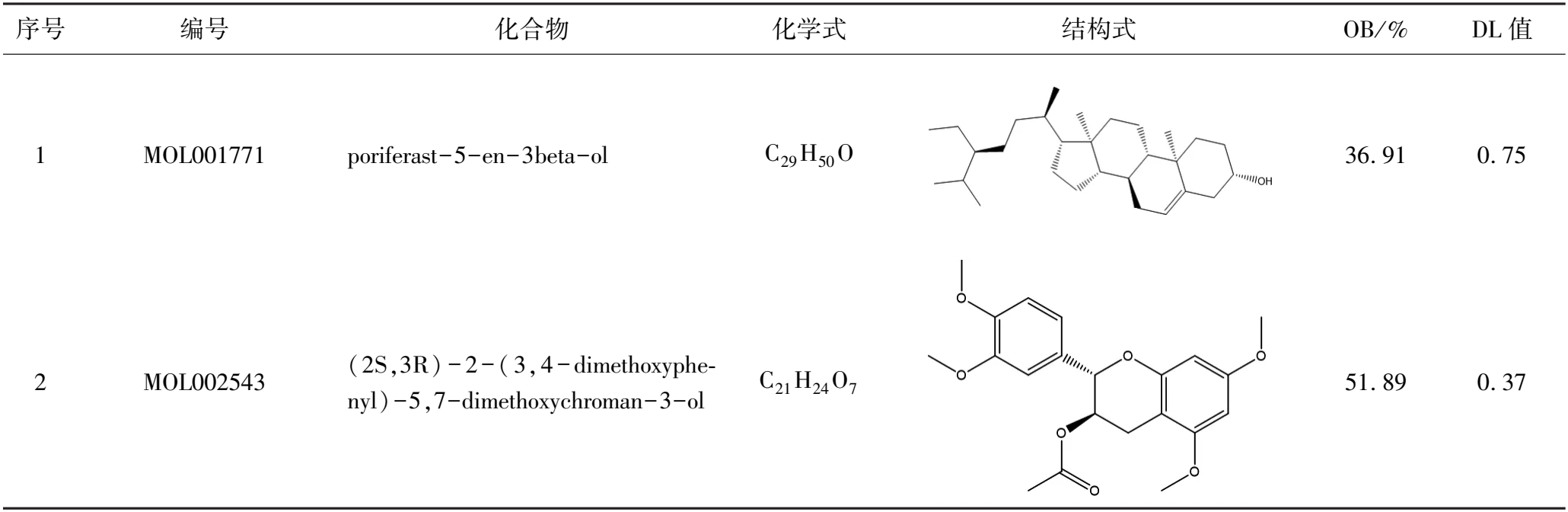
表1 高良姜的潜在活性成分
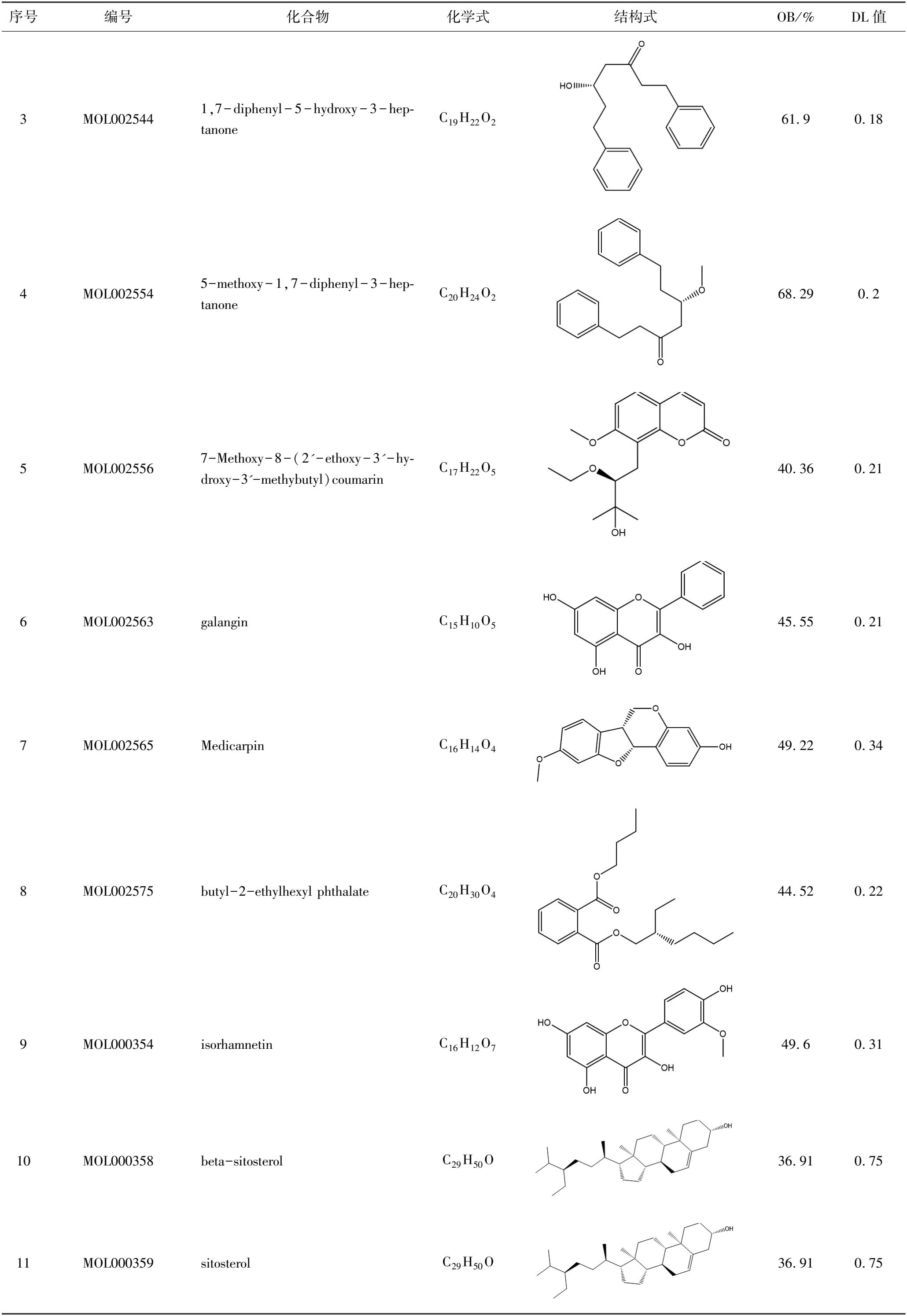
表1(续)

表1(续)
2.2 疾病作用靶点筛选
以“hyperuricemia”、“gout”为关键词,分别在OMIM、Disgenet、Genecards 数据库进行检索,去重后分别获得1 101个痛风作用靶点,802个靶点高尿酸血症作用靶点,二者取交集后获得319个两疾病的共同靶点(如图1)。

图1 高尿酸血症和痛风共同靶点
2.3 高良姜药物-痛风及高尿酸血症疾病共同靶点的筛选
采用Venny2.1在线作图工具,导入180个高良姜药物靶点、1 101个痛风作用靶点,802个高尿酸血症作用靶点,绘制韦恩图,三者取交集后获得药物-疾病共同靶点28个(如图2)。
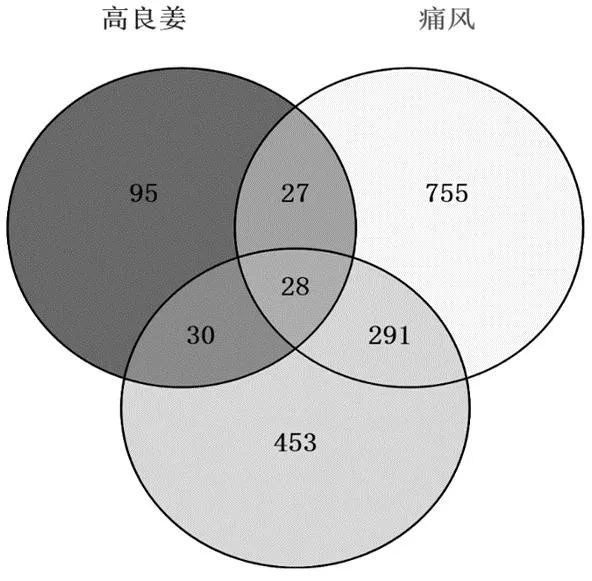
图2 高良姜与痛风、高尿酸血症靶点韦恩图
2.4 网络构建及分析
采用Cytoscape软件导入高良姜中13个潜在活性成分和28个药物-疾病共同靶点,绘制“高良姜-化学成分-作用靶点-高尿酸血症和痛风疾病”网络图(如图3)。高良姜中的11种活性成分(删除其中2个与疾病靶点无交集的成分)根据degree降序排列分别为 quercetin,kaempferol,isorhamnetin,galangin,beta-sitosterol,1,7-diphenyl-5-hydroxy-3-heptanone,7-Methoxy-8-(2'-ethoxy-3'-hydroxy-3'-methybutyl)coumarin,medicarpin,(2S,3R)-2-(3,4-dimethoxyphenyl)-5,7-dimethoxychroman-3-ol,5-methoxy-1,7-diphenyl-3-heptanone,butyl-2-ethylhexyl phthalate。
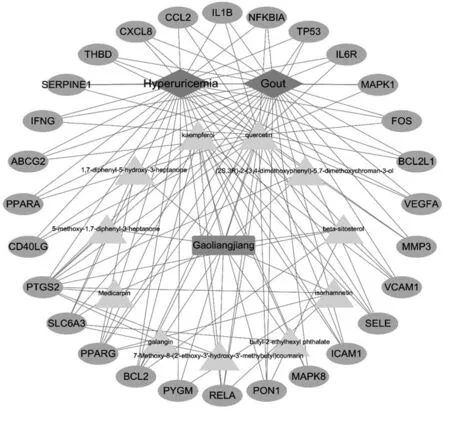
注: 图中紫色代表高良姜,绿色三角形代表高良姜中的11种活性成分,蓝色椭圆形代表28个药物-疾病共同靶点,红色菱形代表疾病。
2.5 PPI网络构建及核心靶点分析
2.5.1 构建蛋白交互作用网络图
为了更直观地表征高良姜治疗痛风及高尿酸血症的作用机制,采用STRING 数据库分析高良姜与两疾病的28个交集靶点基因的交互作用,按“1.5”PPI网络构建方法将所得数据导入 Cytoscape 3.7.2软件中,制作PPI网络(如图4)。经软件计算可知,网络中共含有28个节点,210条边,平均节点数15。

图4 高良姜与痛风及高尿酸血症交集基因蛋白相互作用网络
2.5.2 基于拓扑分析的核心靶点筛选
将PPI网络导入Cystoscap 3.7.2中,通过“1.5”中基于拓扑分析的核心靶点筛选的方法以NetworkAnalyzer工具实现拓扑分析,采用R 3.6.1制作前 30 位靶点的条形图(如图5)。基于 PPI 拓扑分析排名前5位的核心靶标在蛋白质相互作用网络中较为关键,包括 CCL2、CXCL8、IL1B、VEGFA、ICAM1。
2.6 KEGG 和GO富集分析
2.6.1 GO富集分析
将28个共同靶点经R语言运行后得到GO 条目1 256条,结果显示,交集基因集合共富集至1205条生物学过程(Biological process,BP)通路;交集基因集合共富集至10条细胞组分表达(Cellular component,CC)过程;交集基因集合共富集至41个与分子功能(Molecular function,MF)相关的过程。从 BP 的富集结果来讲,高良姜治疗痛风及高尿酸血症的靶标主要参与调节对脂多糖的反应、对细菌来源分子的反应、细胞对生物刺激的反应、对营养水平的反应、细胞对脂多糖的反应、对肿瘤坏死因子的反应、细胞对细菌来源分子的反应、衰老、白细胞细胞-细胞黏附、细胞对外界刺激的反应等(图6(a))。从 CC 的富集结果来说,靶标主要涉及质膜筏、膜微结构域、RNA聚合酶II转录因子复合物、膜区、转录因子复合物、核转录因子复合物、质膜外侧、血小板α颗粒腔等(图6(b))。从 MF 的富集结果来讲,靶标主要参与调节细胞因子受体结合、磷酸酶结合、细胞因子活性、受体配体活性、蛋白磷酸酶2A结合、蛋白酶结合、蛋白磷酸酶结合、RNA聚合酶II转录因子结合、BH结构域结合、死亡结构域结合等(图6(c))。
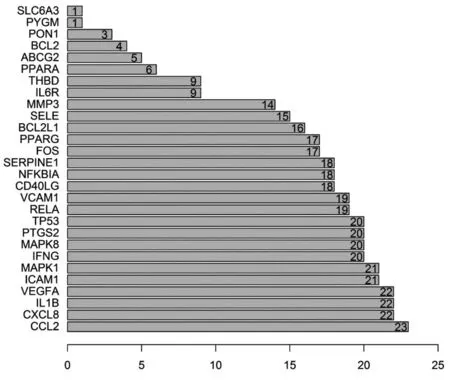
图5 排名前30的核心靶点
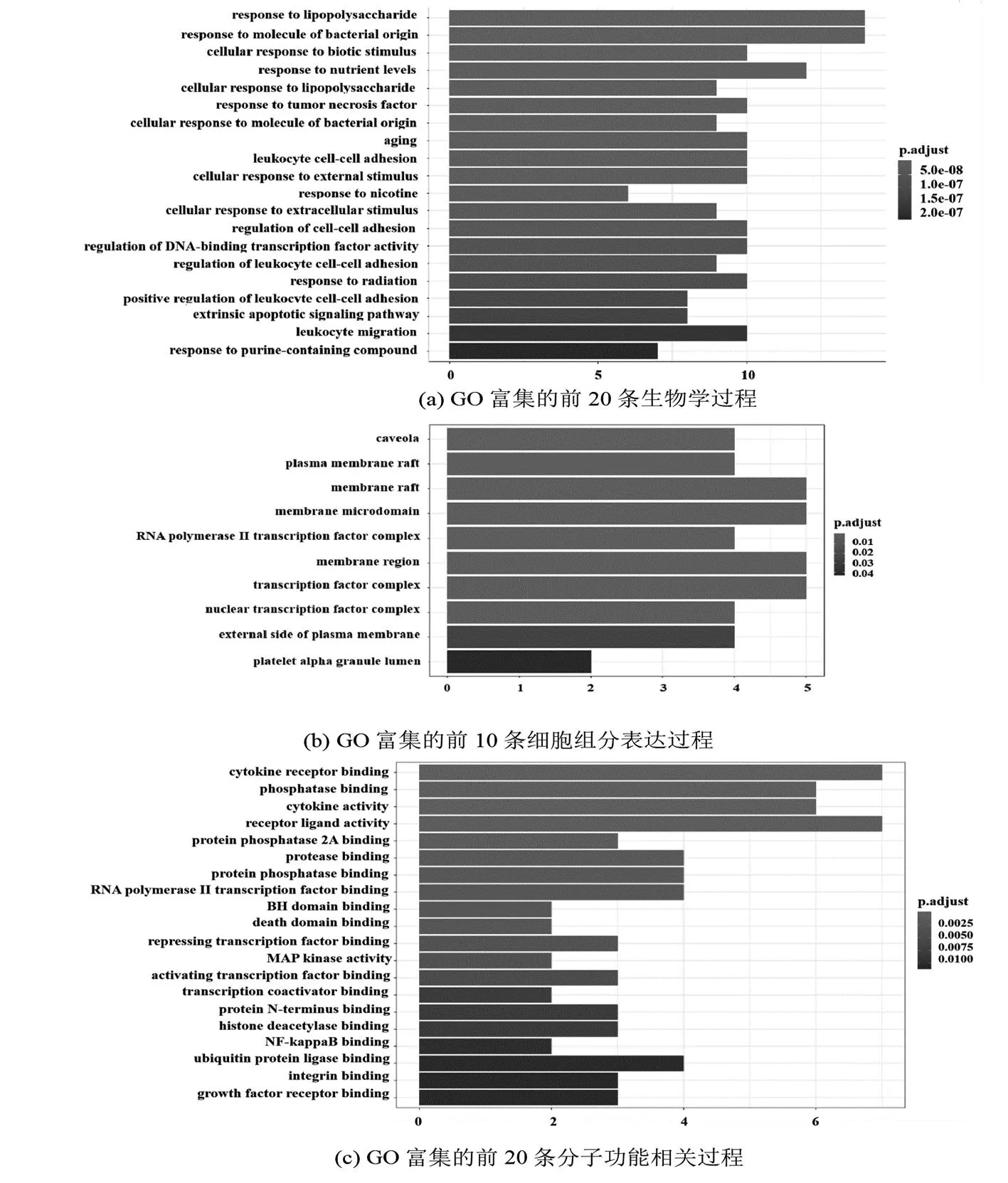
图6 高良姜治疗痛风及高尿酸血症的GO富集分析条形图
2.6.2 KEGG富集分析
高良姜治疗痛风及高尿酸血症的28个共同靶点导入R语言分析后得到118条KEGG通路,前20位KEGG通路条形图(如图7),其中P-value代表富集显著性,所有通路都是有意义(P-value<0.05)且颜色越红则说明显著性越高。主要信号通路涉及:糖尿病并发症中的AGE-RAGE、液体剪切应力和动脉粥样硬化、TNF、IL-17、NF-κB、类风湿关节炎、Nod样受体、Toll样受体等信号通路,这提示高良姜可能是通过调控多个通路发挥治疗痛风及高尿酸血症作用。
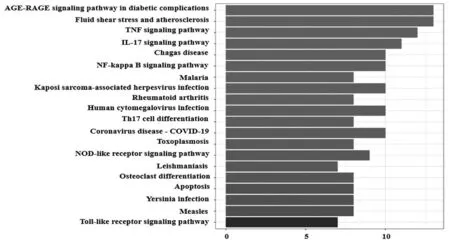
图7 高良姜治疗痛风、高尿酸血症的KEGG富集分析
2.7 分子对接结果
LibDock 是 Discovery Studio 中的一个对接应用程序,将具有不同结合亲和力的配体分子对接以生成热图,以指示配体与其结合位点之间的相互作用,并优化获得的能量 (Ayoub et al.,2018)。最后,保留得分较高的对接构象。使用这种筛选方法,可以缩小PPIs的范围,并且可以进一步筛选潜在的生物活性配体。从PBD数据库(http://www.rcsb.org/pdb/)中检索到 前5 个靶标的晶体结构(PDB ID分别为CCL2:4zk9,CXCL8:6n2u,IL1B:6y8m,VEGFA:1vpf,ICAM1:1iam),去除蛋白质中的水分子并纯化蛋白质。从 PubChem 数据库 (https:// pubchem.ncbi.nlm.nih.gov/)获得前5 个化合物高良姜素(galangin)、异鼠李素(isorhamnetin)、β-谷甾醇(beta-sitosterol)、山柰酚(kaempferol)、槲皮素(quercetin)的3D分子结构。采用治疗痛风和高尿酸血症的药物别嘌醇(allopurinol)作阳性对照配体。
结果发现,高良姜素、异鼠李素、β-谷甾醇、山柰酚、槲皮素分别与CCL2、CXCL8、IL1B、VEGFA有较好的结合,LibDock对接得分均高于阳性药别嘌醇,而与ICAM1未结合(表2)。5种化合物中异鼠李素分别与4种蛋白获得了最高的LibDock对接得分(如图 8)。异鼠李素与CCL2(PBD ID:4ZK9)结合的LibDock分数为 78.2015(如图 8(a)),其结合作用通过异鼠李素B环与SER B:63、THR B:45氨基酸残基形成碳氢键;C环与SER B:63、LEU B:25、ILE B:20氨基酸残基形成π-Sigma相互作用;C环与SER B:21、ARG B:24氨基酸残基形成amide-π堆叠相互作用;A、B、C环与VAL B:22、LEU B:25、ILF B:20、ILF B:51氨基酸残基形成π-alkyl相互作用。异鼠李素与CXCL8(PBD ID:6N2U)结合的LibDock分数为85.6050(如图 8(b)),其结合作用通过异鼠李素A、B环羟基与LEU A:3、VAL A:25氨基酸残基形成常规氢键;A环与ARG A:24、LYS A:1形成碳氢键;A、B、C环与ILE A:26形成π-alkyl相互作用。异鼠李素与IL1B (PBD ID: 6Y8M) 结合的LibDock分数为85.8516(如图 8(c)),其结合作用通过异鼠李素C环羰基与ASN A:108形成常规氢键;B环甲氧基与LYS A:103、ASP A:54形成碳氢键;A环与IEU A:110 形成π-alkyl相互作用。异鼠李素与VEGFA结合的LibDock分数(PBD ID:1VPF)为78.2015(如图 8(d)),其结合作用通过异鼠李素C环羟基与CYS B:61形成常规氢键;B、C环与ASP B:63、GLU B:64、GLU B:64、CYS B:61形成碳氢键;A、C环与CYS B:60形成π-alkyl相互作用。

注:图中用三字母氨基酸代码及其位置注释残基, 疏水残基呈绿色,而极性残基呈紫色,水分子呈青色,受体和配体之间的相互作用用不同颜色的虚线表示,与相应的残基颜色一致。

表2 高良姜中5个化合物与4个靶标LibDock分子对接得分
3 总结与讨论
痛风是一种慢性疾病,由于血清尿酸水平过高导致尿酸晶体沉积在关节并引起炎症,表现为关节红、肿、热、痛,常见于指尖、肘、跖趾、跟腱等部位;2016 年统计显示中国痛风发病率为5.61%,并呈逐年上升趋势[5]。目前,对于痛风和高尿酸血症还没有根治的方法。西医是主要的治疗方法,但长期使用药物会产生副作用。本研究基于网络药理学技术分析,探讨高良姜治疗痛风和高尿酸血症的活性成分及作用机制。结果从TCMSP数据库中获得了11种潜在活性化合物,前5位关键成分为槲皮素、山柰酚、异鼠李素、高良姜素、β-谷甾醇;筛选出高良姜药物-痛风及高尿酸血症疾病28个共同靶点,通过PPI网络构建及核心靶点分析前4位关键靶点是CCL2、CXCL8、IL1B、VEGFA;关键通路包括糖尿病并发症中的AGE-RAGE信号通路、液体剪切应力和动脉粥样硬化、TNF信号通路、IL-17信号通路、NF-κB信号通路、类风湿关节炎等信号通路;此外,高良姜还通过调节20个生物过程、10个细胞组分表达过程和20个分子功能来防治痛风和高尿酸血症。这也说明高良姜由多种化合物组成,通过多途径作用于痛风和高尿酸血症的不同靶点,为后期临床用药和作用机制研究提供依据。
基于KEGG富集分析的结果,本文选择了与痛风和高尿酸血症治疗相关的糖尿病并发症中的AGE-RAGE信号通路、IL-17信号通路、TNF信号通路进行如下分析:
糖尿病并发症中的AGE-RAGE信号通路。高级糖基化终末产物(AGEs)是还原糖与脂质、蛋白质和核酸结合的非酶合成的产物。AGEs与其受体产生的晚期糖基化终末产物(RAGE)结合能诱导各种类型的细胞和器官的氧化应激和炎症[19-20]。图9为AGE-RAGE信号通路在糖尿病并发症中的分析结果。研究表明,AGEs联合RAGE可显著提高OA软骨细胞中TGF-β和MMP-9 mRNA、IL-1、蛋白的表达水平,显著降低过氧化氢酶和超氧化物歧化酶(SOD)的活性,增加丙二醛水平,显著促进NF-κB 的核转位[21]。TGF-β和MMPs的表达水平可作为实验观察指标,以判断OA的严重程度。实验研究证明,槲皮素能够抑制丝裂原活化蛋白激酶 (MAPKs) 的磷酸化、核因子 κ-B 激酶 (IKK)α/β等与炎症过程相关的信号通路,激活转录因子 2 (ATF2) 和核因子 (NF)-κB p65,并阻止 NF-κB p65 易位进入细胞核。通过降低IL-1β、IL-6、IL-8、ICAM-1、sICAM-1 和 MCP-1 产生阻断 MAPK 和 NF-κB 信号通路的激活进而改善炎症反应[22]。异鼠李素可剂量依赖性的降低NF-κB信号通路中TNF-α、IL-1β、IL-6、ICAM-1和TGF-β1的蛋白和mRNA的表达[23]。综上所述,糖尿病并发症中的AGE-RAGE信号通路可能是高良姜治疗痛风性关节炎的关键通路。

图9 糖尿病并发症中的AGE-RAGE信号通路图
IL-17信号通路。在急性痛风性关节炎的早期阶段会出现局部炎症加强,伴随着关节红肿和剧烈疼痛[24]。其中,IL-17是一种主要的促炎因子[25]。由IL-17信号通路图(如图10)可知,IL-17通过激活相关受体,介导NF-κB通路的激活;而TNF-α、IL-1β等炎性细胞因子也能增强IL-17的活性,增强基质金属蛋白酶(MMP1/3/9/13)的表达[25]。文献研究证实,IL-17与其受体结合,可激活NF-κB和MAPK等下游通路,诱导IL-6、TNF-α等表达,继而诱发炎症反应[26]。在痛风性关节炎患者中也存在这一过程,由于NF-κB和激活蛋白1(AP-1)通路被激活[27],可增加促炎细胞因子IL-1β、IL-8、IL-17、TNF-α和NLRP3的表达[28]。实验研究证明,高良姜素及高良姜醇提物[29]、异鼠李素[30]能有效降低大鼠血清中的 IL-1β、IL-6、TNF-α等促炎症因子的水平,槲皮素[30]、山奈酚[31]、谷甾醇[32]可降低TNF-α水平,表明高良姜可能通过抑制IL-17信号通路来治疗痛风和高尿酸血症。
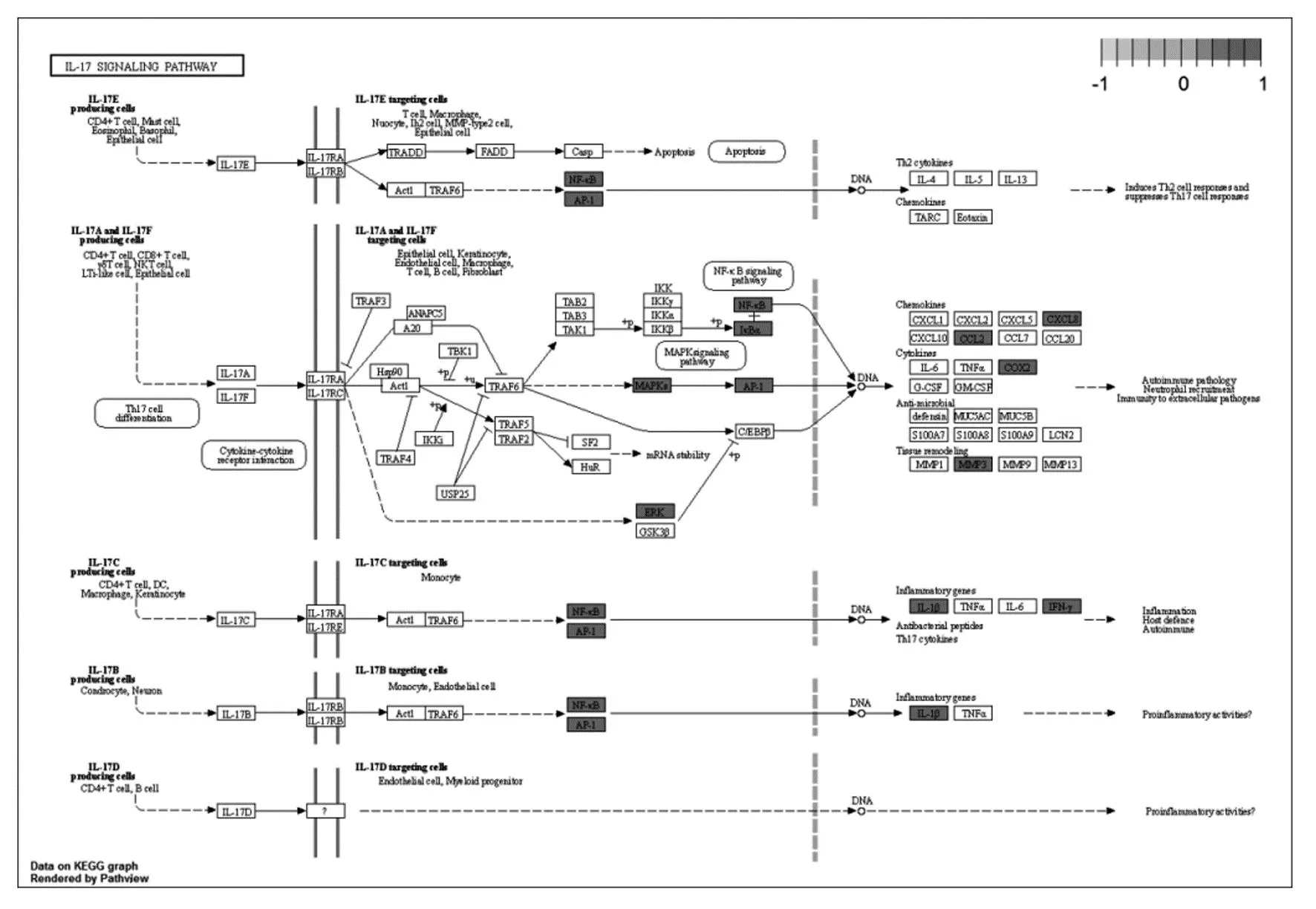
图10 IL-17信号通路图
TNF信号通路。TNF-α是一种促炎细胞因子,能诱导炎症因子 IL-1β的表达,两者之间具有相互刺激的作用, IL-1β可以提高TNF-α的活性[34]。通过分析TNF信号通路图(如图11)可知,NF-κB通路被激活,增加了应激活化蛋白激酶(JNK1/2)和细胞外调节蛋白激酶(ERK1/2)的磷酸化水平,进而促进促炎细胞因子IL-1β和IL-6的表达,来诱导炎症反应的发生。实验研究证实,TNF-α可诱导类风湿关节炎(RA)分泌脂多糖,促进成纤维细胞样滑膜细胞的增殖,促进其表达炎症因子如IL-1β和IL-6,并增加细胞外调节蛋白激酶(ERK1/2)的磷酸化水平[35]。TNF-α在尿酸钠(MSU)晶体诱导的小鼠痛风性关节中显著升高,并与关节炎的严重程度呈正相关[36]。而高良姜素及高良姜醇提物[29]、异鼠李素[30]能有效降低大鼠血清中的 IL-1β、IL-6、TNF-α等促炎症因子的水平,山奈酚[31]可通过抑制LPS诱导的IL-6、IL-1β和COX-2分泌发挥抗炎作用,槲皮素[32]、谷甾醇[33]可降低TNF-α的表达水平,表明高良姜可能通过抑制TNF-α信号通路来治疗痛风和高尿酸血症。
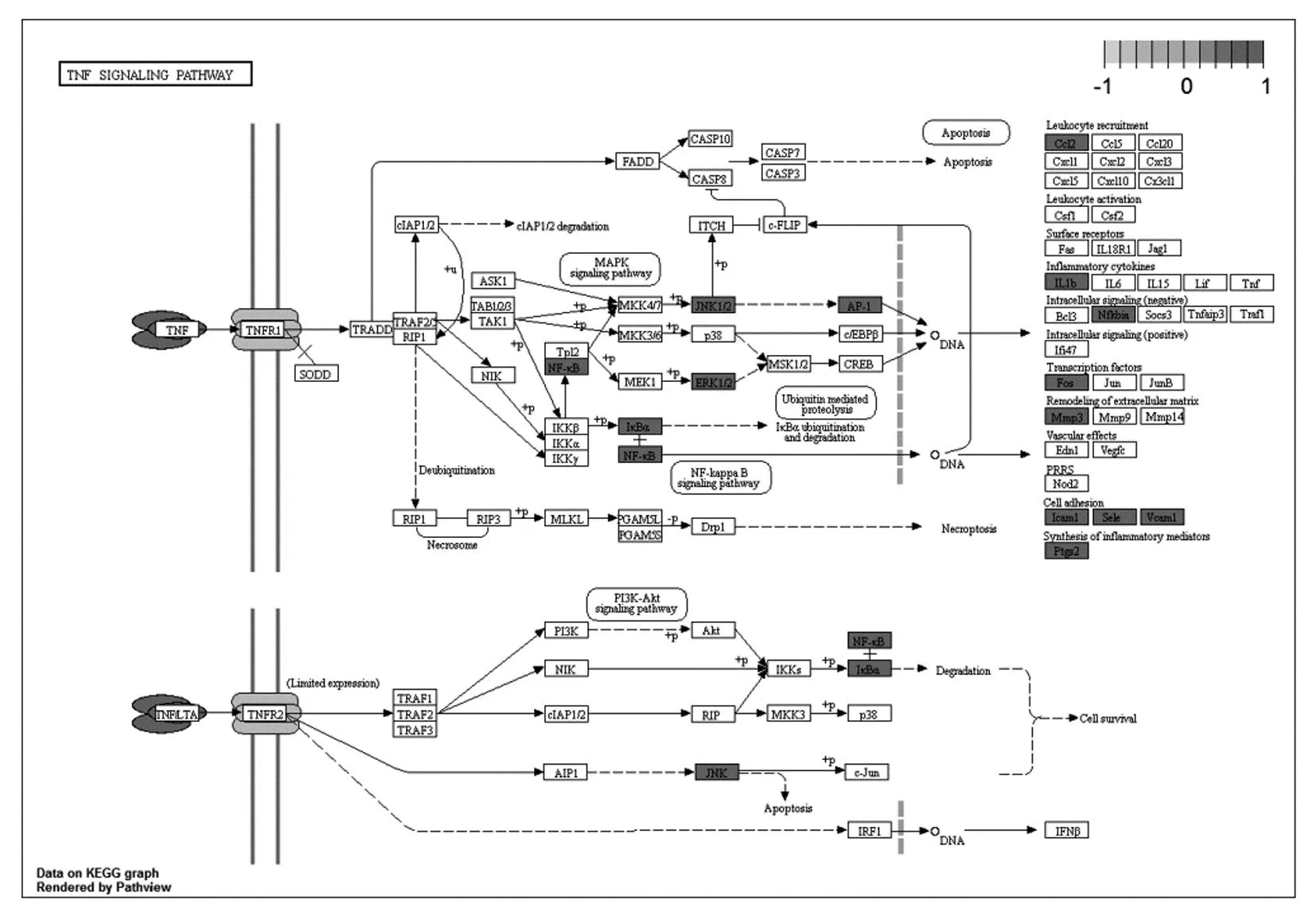
图11 TNF信号通路图
目前,高良姜总黄酮及单体化合物高良姜素、异鼠李素、β-谷甾醇、山柰酚、槲皮素降尿酸药理活性研究报道较多,说明活性显著,但是临床应用或相关产品开发较少。本研究通过网络药理学方法,阐述了高良姜防治痛风和高尿酸血症的复杂网络关系,其作用特点是多成分调控多靶点,继而调控多通路的炎症反应。通过分析高良姜降尿酸的活性成分和分子机制,为进一步开展高良姜降尿酸作用机制研究和降尿酸产品开发提供了科学依据。本研究所获得的关键活性成分和作用靶点是基于网络药理学数据库的信息,分子对接虚拟筛选技术验证了成分与靶点的亲和作用,但仍需动物实验进一步验证,因此后续将在此基础上开展相关实验进一步证实高良姜治疗痛风及高尿酸血症的作用机制。
