二尖瓣瓣环钙化与心房颤动射频导管消融术后复发的相关性研究
2024-01-10薛佳李冰蒋晨曦王伟汤日波龙德勇董建增姚艳
薛佳 李冰 蒋晨曦 王伟 汤日波 龙德勇 董建增 姚艳
目的:探讨二尖瓣瓣环钙化(MAC)与心房颤动射频导管消融术后复发的相关性。
方法:纳入2019年1月1日至2020年12月31日在首都医科大学附属北京安贞医院心内科行射频导管消融术的心房颤动患者785例,根据术后有无心房颤动复发分为复发组和未复发组。采用单因素Cox回归模型分析与心房颤动复发相关的危险因素,采用多因素Cox回归模型评估MAC对心房颤动复发的影响。
结果:平均随访(16±10) 个月,心房颤动射频导管消融术后复发患者190例(24.2%),未复发患者595例(75.8%)。与未复发组比,复发组患者年龄更大,非阵发性心房颤动的比例更高,超声心动图中MAC和中/重度二尖瓣反流的比例更高,左心房前后径(LAD)更大,CHA2DS2-VASc得分更高(P均<0.001)。单因素分析表明,MAC与射频导管消融术后心房颤动复发具有明确的相关性(HR=2.530,95%CI:1.639~3.907,P<0.001)。在校正年龄和性别后,MAC与射频导管消融术后心房颤动复发风险增加仍具有显著相关性(HR=1.52,95%CI:1.14~2.17,P<0.001)。对年龄、性别、非阵发性心房颤动、高血压、糖尿病、LAD、中重度二尖瓣反流、CHA2DS2-VASc评分进行多因素校正后,MAC与心房颤动复发风险增加仍有关(HR=1.48,95%CI:1.13~1.95,P=0.001)。
结论:MAC与心房颤动消融术后复发风险增加显著相关。
二尖瓣瓣环钙化(MAC)是二尖瓣环的一种慢性、退行性病变,与冠心病、心房颤动、心力衰竭、缺血性脑卒中等心脑血管疾病的发生密切相关[1]。早期Framingham研究显示,MAC在自然人群中发生率为2.8%,在老年人群中发生率>10%[2]。近年的一项大样本横断面研究显示,22.4%的自然人群存在MAC,以60~75岁的男性为主[3]。
MAC和心房颤动发生之间存在显著相关性,其相关性独立于传统危险因素,如年龄、性别、高血压、糖尿病等[4]。动脉粥样硬化多种族(MESA)研究发现,MAC能预测心房颤动的发生[5],随着MAC严重程度进展,心房颤动发生风险也会增加[6]。一项大样本心房颤动队列显示,MAC与心房颤动患者的心血管发病率、心血管死亡率和全因死亡率增加有关[7]。目前,MAC对心房颤动射频导管消融术后复发的影响尚未阐明。本研究旨在探讨射频导管消融术后心房颤动复发是否与MAC有关。
1 资料与方法
1.1 研究对象
纳入2019年1月1日至2020年12月31日首都医科大学附属北京安贞医院心内科行射频导管消融术的阵发性或持续性心房颤动患者875例。纳入标准:所有药物治疗无效或希望行射频导管消融术的心房颤动患者,术前均接受常规的经胸超声心动图或经食道超声心动图。排除标准:患有甲状腺功能亢进症、先天性心脏病、严重贫血、风湿性心脏病、既往已行心房颤动导管消融术或外科消融术的患者。排除54例既往行心房颤动射频导管消融术患者,36例缺乏随访数据患者,最终纳入785例患者。本研究经首都医科大学附属北京安贞医院医学伦理委员会批准(批号:2023121X)。所有患者均签署了知情同意书。
1.2 数据收集
1.2.1 基线资料收集
从医院数据库中收集患者基本信息,包括性别、年龄、体重指数、心房颤动类型和持续时间,既往病史(包括高血压、糖尿病、冠心病、慢性心力衰竭、缺血性脑卒中/短暂性脑缺血发作、吸烟史),术前超声心动图参数[包括有无MAC、二尖瓣反流程度、左心房前后径(LAD)、左心室舒张末期内径、左心室射血分数],CHA2DS2-VASc评分,手术时间,透视时间,消融时间,手术术式(包括双侧肺静脉隔离、双侧肺静脉隔离+二尖瓣峡部、左心房顶部、三尖瓣峡部线性消融、术中电复律),血生化检查(包括血肌酐、估算肾小球滤过率、总胆固醇、低密度脂蛋白胆固醇),以及用药信息。
MAC诊断标准:超声心动图观察到二尖瓣瓣环处的强回声结构,部分累及到二尖瓣前后叶[8]。
1.2.2 术后随访资料收集
所有患者出院前均接受常规心电图检测,在射频导管消融术后第1、2、3、6、12、18、24、30个月进行24小时动态心电图检测,每3个月电话询问患者一般情况,观察有无心房颤动复发等信息。心房颤动复发定义为术后3个月后持续时间大于30 s的房性心动过速、心房扑动和心房颤动[9]。
1.2.3 电生理检查和心房颤动射频导管消融术
所有患者入院行心脏电生理检查及三维电解剖标测系统指导下心房颤动射频导管消融术。局麻后穿刺双侧股静脉置入鞘管,经右侧股静脉置入SOUNDSTAR超声导管于右心房,三维超声心动图下重建卵圆窝、左心房、左右肺静脉等结构,多角度探查左心耳未见血栓,心包未见积液。在X线引导下,经左股静脉置入一根10极诊断导管于冠状窦内,将右侧短鞘更换为长鞘,在三维超声心动图结合X线指导下穿刺房间隔,成功后将长鞘置于左心房。通过长鞘将标测导管放置于左心房对左心房及双肺静脉建模,消融导管对阵发性心房颤动行双侧环肺静脉消融,对持续性心房颤动患者,根据术中表现决定是否加做左心房顶部线、底部线、二尖瓣峡部、三尖瓣峡部消融等。消融导管在35 W的功率下(灌注流速17 ml/min)行环肺静脉消融。手术过程中,激活全血凝固时间维持在300~350 s。手术终点定义为恢复窦性心律和环肺静脉电隔离,起搏标测验证达双向阻滞。对术中未恢复窦性心律的患者,酌情行电复律术。
若无禁忌证,术后常规服用抗心律失常药物(胺碘酮或普罗帕酮),若术后3 个月空白期无心房颤动复发,停用抗心律失常药。根据CHA2DS2-VASc评分评估术后3个月是否继续应用口服抗凝药。
1.3 统计学方法
采用SPSS 19.0进行统计学分析。符合正态分布的连续性变量以均值±标准差表示,采用t检验;分类变量以频数(%)表示,采用卡方检验。采用单因素Cox回归模型分析与心房颤动复发相关的危险因素,采用多因素Cox回归模型评估MAC对心房颤动复发的影响。以P<0.05为差异有统计学意义。
2 结果
2.1 射频导管消融术后心房颤动复发组与未复发组的基线资料比较(表1)
表1 射频导管消融术后心房颤动复发组与未复发组的基线资料比较(±s)
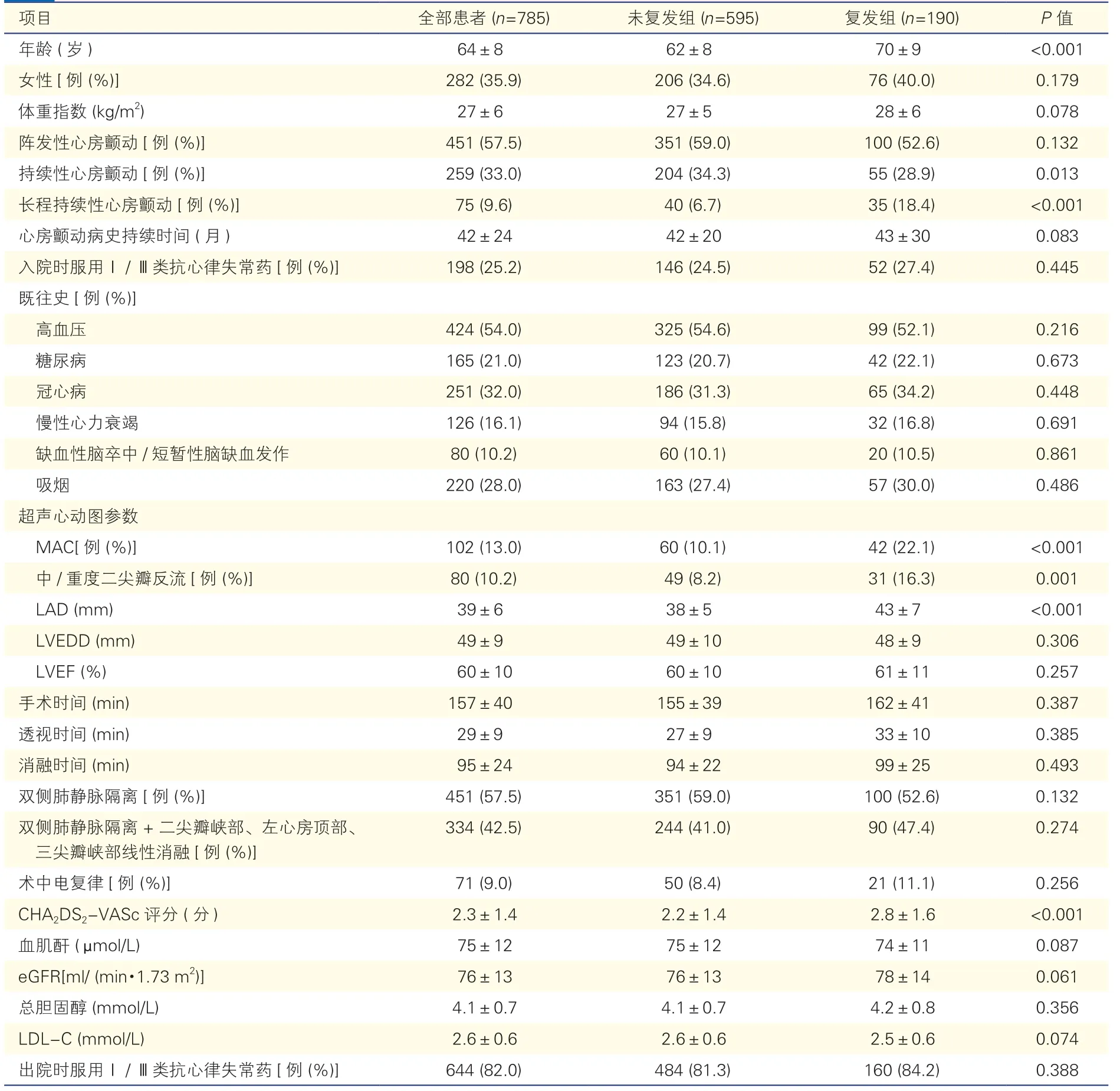
表1 射频导管消融术后心房颤动复发组与未复发组的基线资料比较(±s)
注:MAC:二尖瓣瓣环钙化;LAD:左心房前后径;LVEDD:左心室舒张末期内径;LVEF:左心室射血分数;eGFR:估算肾小球滤过率;LDL-C:低密度脂蛋白胆固醇。
年龄 (岁)64±862±870±9<0.001女性[例 (%)]282 (35.9)206 (34.6)76 (40.0)0.179体重指数 (kg/m2)27±627±528±60.078阵发性心房颤动[例 (%)]451 (57.5)351 (59.0)100 (52.6)0.132持续性心房颤动[例 (%)]259 (33.0)204 (34.3)55 (28.9)0.013长程持续性心房颤动[例 (%)]75 (9.6)40 (6.7)35 (18.4)<0.001心房颤动病史持续时间 (月)42±2442±2043±300.083入院时服用Ⅰ/Ⅲ类抗心律失常药[例 (%)]198 (25.2)146 (24.5)52 (27.4)0.445既往史[例 (%)]高血压424 (54.0)325 (54.6)99 (52.1)0.216糖尿病165 (21.0)123 (20.7)42 (22.1)0.673冠心病251 (32.0)186 (31.3)65 (34.2)0.448慢性心力衰竭126 (16.1)94 (15.8)32 (16.8)0.691缺血性脑卒中/短暂性脑缺血发作80 (10.2)60 (10.1)20 (10.5)0.861吸烟220 (28.0)163 (27.4)57 (30.0)0.486超声心动图参数MAC[例 (%)]102 (13.0)60 (10.1)42 (22.1)<0.001中/重度二尖瓣反流[例 (%)]80 (10.2)49 (8.2)31 (16.3)0.001 LAD (mm) 39±638±543±7<0.001 LVEDD (mm) 49±949±1048±90.306 LVEF (%) 60±1060±1061±110.257手术时间 (min)157±40155±39162±410.387透视时间 (min)29±927±933±100.385消融时间 (min)95±2494±2299±250.493双侧肺静脉隔离[例 (%)]451 (57.5)351 (59.0)100 (52.6)0.132双侧肺静脉隔离+二尖瓣峡部、左心房顶部、三尖瓣峡部线性消融[例 (%)]334 (42.5)244 (41.0)90 (47.4)0.274术中电复律[例 (%)]71 (9.0)50 (8.4)21 (11.1)0.256 CHA2DS2-VASc评分 (分) 2.3±1.42.2±1.42.8±1.6<0.001血肌酐 (μmol/L)75±1275±1274±110.087 eGFR[ml/ (min·1.73 m2)]76±1376±1378±140.061总胆固醇 (mmol/L) 4.1±0.74.1±0.74.2±0.80.356 LDL-C (mmol/L) 2.6±0.62.6±0.62.5±0.60.074出院时服用Ⅰ/Ⅲ类抗心律失常药[例 (%)]644 (82.0)484 (81.3)160 (84.2)0.388
785例患者中,女性282例(35.9%),714例(91.0%)患者在术中恢复窦性心律,71例(9.0%)患者通过加做同步电复律恢复窦性心律。术后平均随访(16±10)个月期间,190例(24.2%)复发心房颤动,595例(75.8%)未复发。复发组MAC患病率为22.1%,未复发组MAC患病率为10.1%。与未复发组比,心房颤动复发患者年龄更大,长程持续性心房颤动的发生率更高,超声心动图参数中MAC和中/重度二尖瓣反流的发生率更高,LAD更大,CHA2DS2-VASc得分更高(P均<0.01)。
2.2 射频导管消融术后心房颤动复发危险因素的单因素Cox回归分析(表2)
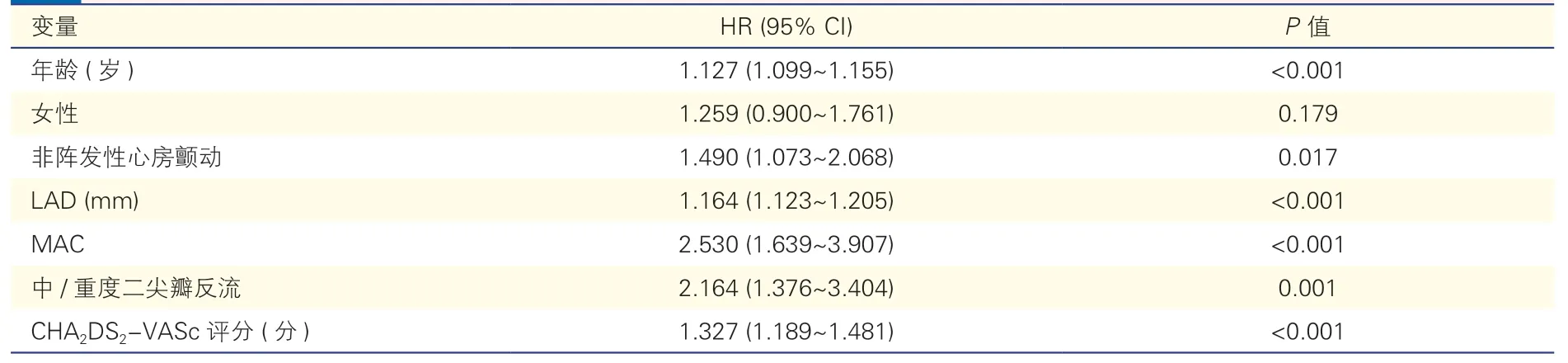
表2 射频导管消融术后心房颤动复发危险因素的单因素Cox回归分析(n=785)
单因素Cox回归分析显示,年龄、非阵发性心房颤动、LAD、MAC、中/重度二尖瓣反流、CHA2DS2-VASc评分与心房颤动患者射频导管消融术后复发相关(P均<0.05)。
2.3 MAC与心房颤动复发相关性的多因素Cox回归分析(表3)
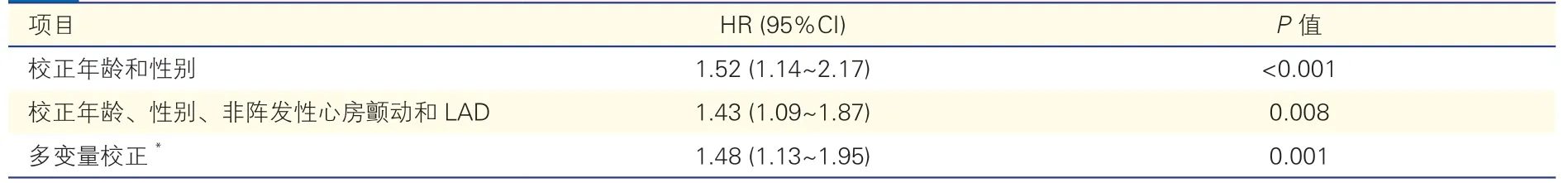
表3 MAC与心房颤动复发相关性的多因素Cox回归分析(n=785)
多因素Cox回归分析显示,在校正年龄和性别后,MAC与心房颤动复发显著相关(HR=1.52,95%CI:1.14~2.17,P<0.001)。在对年龄、性别、非阵发性心房颤动、LAD进行校正后,MAC与心房颤动复发仍具有显著相关性(HR=1.43,95%CI:1.09~1.87,P=0.008)。同时对年龄、性别、非阵发性心房颤动、高血压、糖尿病、LAD、中/重度二尖瓣反流、CHA2DS2-VASc评分进行多因素校正后的Cox回归分析中,MAC与心房颤动复发风险增加仍有关(HR=1.48,95%CI:1.13~1.95,P=0.001)。
3 讨论
本研究发现,MAC与心房颤动患者射频导管消融术后复发风险增加有关,且独立于年龄、性别、非阵发性心房颤动、高血压、糖尿病、LAD、中/重度二尖瓣反流、CHA2DS2-VASc评分等传统心房颤动发生的危险因素。
心房颤动射频导管消融术已成为有症状的、药物无效的阵发性或持续性心房颤动患者的一线治疗方案。尽管射频导管消融术的治疗效果明确,但术后心房颤动复发仍是巨大挑战。射频导管消融术后心房颤动复发已被证实受多因素影响,包括年龄、心房颤动的病程、左心房大小等[10],发现新的可靠的心房颤动复发预测因子具有重要的临床意义[11]。
流行病学研究发现MAC是心房颤动发生的预测因子。Framingham研究发现,存在MAC的研究对象比无MAC的研究对象更有可能发生心房颤动,在校正了混杂因素后两者仍具有强相关性[4]。MESA研究发现,合并MAC的患者其心房颤动发病率几乎是未合并MAC者的4倍[5]。通过测量MAC每年的变化程度进一步发现,MAC进展患者的心房颤动风险增加了50%,证明了MAC严重程度的进展与心房颤动发生具有相关性[6]。本研究发现,MAC与心房颤动射频导管消融术后结局相关,为临床预测心房颤动复发提供了参考。
MAC与心房颤动射频导管消融术后复发之间可能存在多种病理生理机制。二尖瓣的钙化可能沉积在靠近希氏束及其分支的室间隔膜部,从而延缓心房内和心房间的电传导,构成折返性心房颤动发生的机制[12]。MAC多伴有更大的LAD,MAC合并的中/重度二尖瓣反流可能导致左心房增大,进而导致心房颤动发生[8]。在Framingham研究中,校正了心房颤动的传统危险因素、急性心肌梗死和慢性心力衰竭后MAC和心房颤动仍具有显著相关性,而对基线LAD进行校正后,两者的相关性不具有统计学意义。因此推测MAC可能通过引起左心房扩大,从而导致心房颤动的发生风险增加[4]。此外,炎症反应也可能在MAC中发挥作用。炎症介质参与心房结构和电重构,包括心房纤维化、缝隙连接异常和细胞内钙处理异常,导致心房颤动发生[13]。
因此,MAC与射频导管消融术后心房颤动复发具有显著相关性,有望进一步对心房颤动射频导管消融术后复发进行危险分层。
利益冲突:所有作者均声明不存在利益冲突
