紫檀芪通过调控氧化应激和NLRP3炎症小体抑制肝癌增殖迁移
2024-01-10刘晨曾乌查黄赟
刘晨, 曾乌查, 黄赟
肝细胞癌(hepatocellular carcinoma, HCC)是最常见的肝恶性肿瘤类型,约占肝恶性肿瘤总病例数的90%[1-2]。HCC的病因主要有病毒性肝炎、非酒精性脂肪肝和酒精相关性肝病等[2]。近年来,尽管在治疗性手术(手术切除和肝移植)、放疗、全身化疗、靶向治疗和免疫治疗等方面取得了进展,但HCC患者的预后较其他癌症仍然较差[2]。因此,寻找新的、有效的干预策略,探索更多有效的辅助治疗方案,对提高HCC患者长期生存率具有重要的临床意义和社会价值。
近年来,从中草药中寻找高效、低毒的辅助抗癌药物成为肿瘤治疗研究的新热点。紫檀芪(pterostilbene,PTE,3,5-二甲氧基-4′-羟基苯乙烯)是一种酚类化合物,提取自紫檀、蓝莓和花榈木等天然作物中,具有多种药理作用,包括抗肿瘤、抗氧化、抗炎、抗纤维化和抗衰老等[3-4]。PTE能够激活多种信号通路从而抑制肿瘤的发生、发展,其广泛的抗癌活性、逆转化疗药物的耐药性以及增加放疗敏感性等作用已在乳腺癌、宫颈癌和结肠癌等肿瘤中得到验证[5]。已有研究[6-9]报道,PTE在肝脏中的保护作用可能与其抗氧化应激、抗炎等作用密切相关。本研究旨在探索PTE在HCC增殖和迁移过程中的作用机制,并探讨PTE对氧化应激和 NLRP3 炎症小体的影响,以期为PTE进一步应用于HCC的临床治疗提供新的思路和依据。
1 材料与方法
1.1 主要试剂和细胞系 PTE(纯度>97 %,上海Aladdin公司);3-(4,5-二甲基噻唑-2)-2,5-二苯基四氮唑溴盐[3-(4,5-dimethyl-2-thiazolyl)-2,5-diphenyl-2-H-tetrazolium bromide, MTT]试剂盒、二甲基亚砜(dimethyl sulfoxide,DMSO)、VAS2870、N-乙酰半胱氨酸(N-Acetyl-L-cysteine,NAC)、过氧化氢(hydrogen peroxide, H2O2)、脂多糖(lipopolysaccharide,LPS)(美国Sigma-Aldrich公司);白细胞介素1β(interleukin-1β,IL-1β)、IL-18 ELISA试剂盒(美国Life Technologies公司);核苷酸结合寡聚化结构域样受体蛋白3(nucleotide-binding oligomerization domain, leucine-rich repeat and pyrin domain-containing3,NLRP3)、凋亡相关的斑点样蛋白(apoptosis-associated speck-like protein containing a CARD,ASC)、含半胱氨酸的天冬氨酸蛋白水解酶1(cysteine-requiring aspartate protease 1,Caspase-1)、尼克酰胺腺嘌呤二核苷酸磷酸氧化酶4(recombinant nicotinamide adenine dinucleotide phosphate oxidase 4,NOX4)、IL-1β抗体、周期蛋白-D1(Cyclin D1,CCND1)抗体、E-钙黏蛋白(E-cadherin)抗体、N-钙黏蛋白(N-cadherin)抗体(美国Cell Signaling Technology公司);抗甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)抗体(美国Proteintech公司);磷酸盐缓冲液(phosphate buffered saline,PBS)、牛血清白蛋白(bovine serum albumin,BSA)、胎牛血清(fetal bovine serum, FBS)、改良Eagle培养基(dulbecco’s modified eagle medium, DMEM)(美国Gibico公司);草酸铵结晶紫染色液(北京 Solarbio 公司);Transwell细胞培养小室(美国康宁公司);永生化人肝细胞LO2、HCC Hep3B、HepG2、Bel-7404 (上海中乔新舟生物技术有限公司);HCC Bel-7402 (上海联迈生物工程有限公司)。
1.2 方法
1.2.1 细胞培养 细胞在37 ℃、体积分数为0.05的CO2培养箱中培养。当细胞融合达70% 密度时更换为无血清培养基,再给予药物处理。
1.2.2 平板克隆形成实验 细胞以200 个/孔的密度种植于6孔培养板上。培养14 d后用PBS洗涤,再用2.0% 结晶紫染色。使用显微镜对细胞克隆团进行计数,并确保每个细胞团含50个以上细胞。
1.2.3 细胞存活率及增殖能力检测 采用MTT细胞增殖实验检测细胞的存活率和增殖情况。细胞以1 500个/孔(用于测定增殖活力)或5 000个/孔(用于测定存活率)的密度种植在96孔板中,培养1~2 d。PTE预处理后每孔加入20 μL MTT(5 mg/mL)。孵育4 h后去除培养基,每孔加入150 μL DMSO。在490 nm波长下测量光密度(optical density, OD)值。
1.2.4 细胞划痕实验 细胞用PTE预处理后接种于6 孔板中。当细胞生长密度为80%时,用移液器吸头尖端划痕,PBS(pH值=7.4)小心洗去残留的细胞碎片,再加入含2% FBS的DMEM继续培养。同一位置在0、24、48 h 时间点进行拍照以观察细胞迁移情况。
1.2.5 细胞迁移实验 采用Transwell实验评估细胞迁移能力。将细胞(密度为1×105个/孔)用不含FBS的DMEM培养基培养于Transwell装置的上室中,下室用500 μL含10% FBS的DMEM填充,37 ℃下孵育18 h。孵育期结束后,将底膜完整剪切并用2.0% 结晶紫染色。显微镜下随机选择5个不同视野拍照并统计。
1.2.6 EdU细胞增殖实验 使用Apolo488体外成像试剂盒进行EdU细胞增殖检测。用10 μmol/L的EdU试剂孵育Bel-7404和Hep3B细胞2 h,用4%多聚甲醛室温固定30 min,再用 0.3% Triton X-100透化并配合EdU试剂染色。细胞核用5 μg/mL 的4′,6-二脒基-2-苯基吲哚(4′,6-diamidino-2-phenylindole, DAPI)染色10 min。在荧光显微镜下,计数5个随机视野中EdU阳性细胞的数量并进行统计分析。
1.2.7 免疫荧光染色 将Hep3B细胞以1×105个/孔密度接种在24孔板内的玻璃盖玻片上。过夜培养后,用PBS洗涤细胞3次,并在室温下以4%多聚甲醛固定20 min。洗涤3次后,加入0.1% Triton X-100 室温下静置15 min。洗涤3次后,再加入5% BSA 37 ℃ 孵育30 min。加一抗在4 ℃下孵育16 h。复温洗涤3 次后,再加入二抗37 ℃ 孵育 1 h。最后使用DAPI染细胞核,封片。采用Olympus FV10i-W共焦显微镜观察并拍摄图片。
1.2.8 Western-blot实验 4 ℃条件下提取细胞蛋白,加入蛋白裂解液30 min后超声碎裂细胞,离心(12 000×g,4 ℃,15 min)后转移上清,测蛋白浓度。加入1/4体积的loading buffer,沸水浴10 min后自然冷却。配置10%的十二烷基硫酸钠-聚丙烯酰胺凝胶进行电泳分离蛋白,湿转法转膜,5% BSA中室温下封闭1 h,后用相应一抗4 ℃孵育过夜(GAPDH稀释比例为1∶2 000,NOX4、NLRP3、ASC、Caspase-1和IL-1β稀释比例均为1∶1 000),洗涤后用相应二抗(稀释比例为1∶10 000)室温下孵育1 h。最后用电化学发光法进行显影,以GAPDH 作为对照内参进行半定量分析。
1.2.9 qRT-PCR实验 加入1 mL TRIzol裂解细胞,提取总RNA。采用TakaRa Prime script RT reagent kit 进行cDNA逆转录操作。采用TAKARA试剂盒及实时荧光定量PCR仪进行荧光定量PCR分析。使用2-△△Ct计算目的基因的相对表达量。引物序列如下:
NOX4:
正向TCCATTGAAAGCACTGTGTCG
反向CACATGCACGCCTGAGAAAA
GAPDH:
正向CTGCACCACCAACTGCTTAG
反向GTCTTCTGGGTGGCAGTGAT
1.2.10 H2O2检测 收集贴壁细胞并裂解,离心收集上清液。向避光的96孔板每个孔中加入待测样品或标准品50 μL,再加入H2O2检测试剂100 μL,室温条件下孵育30 min;孵育完成后用酶标仪在560 nm波长条件下测定。根据标准曲线计算出相应样品内H2O2的浓度。
1.2.11 细胞活性氧(reactive oxygen species, ROS)检测 消化贴壁细胞,800 r/min离心3 min,用PBS洗涤 2 次后重悬,将细胞密度调整为5×104mL-1。把细胞悬液依次加入96孔板内,每孔 100 μL,孵育过夜。装载探针,使用无血清的DMEM培养基按1∶1 000的比例稀释2′,7′-二氢二氯荧光素二乙酸酯(2,7-Dichlorodihydrofluorescein diacetate,DCFH-DA),直至终浓度为10 μmol/L。洗涤样品2遍后,向每孔样品中加入稀释后的DCFH-DA工作液200 μL,37 ℃条件下孵育30 min。孵育完成再洗涤 3 次后行荧光检测,采用酶标仪检测荧光值,在480 nm的激发波长和525 nm 的发射波长下定量DCFH-DA荧光。
1.2.12 ELISA法检测IL-1β使用IL-1βELISA检测试剂盒进行检测。裂解细胞后,离心收集上清液。在反应板中每孔各加入标准品或待测样品100 μL,充分混匀后于37 ℃放置120 min。用洗涤液充分洗涤4~6 次后,再往每孔中加入一抗工作液100 μL充分混匀,37 ℃静置60 min。每次洗板后,按先后顺序分别往每孔加酶标抗体工作液100 μL(37 ℃,30 min)、酶标抗体工作液100 μL(37 ℃,30 min)和底物工作液100 μL(37 ℃暗处反应15 min)。最后每孔加入100 μL终止液混匀,立即用酶标仪在450 nm处测OD值。绘制标准曲线,计算相应样品内IL-1β的实际浓度。
1.2.13 ELISA法检测IL-18 使用IL-18 ELISA检测试剂盒进行检测。裂解细胞后,离心收集上清液。在酶标板中每孔各加入标准品或待测样品100 μL,37 ℃孵育90 min。弃去液体甩干后,每孔加入抗体工作液100 μL,37 ℃孵育60 min。洗板后,每孔再加入酶结合物工作液100 μL,37 ℃ 孵育30 min。再次洗板后,每孔加入底物溶液90 μL,37 ℃避光孵育15 min。最后每孔加入 50 μL 终止液混匀,立即用酶标仪在450 nm处测OD值。绘制标准曲线,计算相应样品内IL-18的实际浓度。
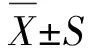
2 结 果
2.1 PTE对肝细胞和HCC生存能力的影响 采用MTT实验测定PTE对正常人肝细胞系LO2和4种人HCC细胞系(Hep3B、HepG2、Bel-7402和Bel-7404)生存能力的影响。将细胞置于不同浓度的PTE或不同刺激时间下进行培养,可见PTE抑制Hep3B、HepG2、Bel-7402和Bel-7404细胞的生存能力,且有浓度依赖性。其中,50%有效抑制浓度(half maximal inhibitory concentration,IC50)分别为(53.16±3.49)、(60.30±2.19)、(61.85±4.15)、(51.61±2.80) μmol/L。然而,在相同浓度或者相同刺激时间的PTE作用下,永生化人肝细胞LO2的存活率所受影响较小,IC50为(92.65±8.15) μmol/L。选取浓度为60 μmol/L的PTE进行进一步实验,发现该浓度的PTE刺激可以有效抑制HCC细胞的生存能力,并呈明显的时间依赖性。96 h 培养时间内,PTE对正常人肝细胞系LO2仅显示出轻微的抑制作用(LO2组与 Hep3B、HepG2、Bel-7402和Bel-7404 组比较,差别有统计学意义,t值分别为3.43、2.85、3.01和3.45,P<0.01)。上述结果表明,在体外实验中PTE能够降低HCC细胞的生存能力(图1A)。
PTE:紫檀芪;CCND1:周期蛋白-D1;MTT:3-(4,5-二甲基噻唑-2)-2,5-二苯基四氮唑溴盐;DAPI:4′,6-二脒基-2-苯基吲哚;EdU:5-乙炔基-2′-脱氧尿苷。A:细胞存活率;B:MTT实验;C:平板克隆实验;D:EdU实验;E:Western-blot实验(PTE组:60 μmol/L浓度的PTE刺激48 h)。与0 μmol/L组或control组比较,△:P<0.05;与50 μmol/L组比较,#:P<0.05。
2.2 PTE对HCC增殖能力的影响 MTT实验结果显示,随着PTE刺激浓度增加,Hep3B和Bel-7404 细胞增殖曲线逐渐趋于平缓(Hep3B细胞组间比较,F=9.02,P<0.01;Bel-740细胞组间比较,F=10.09,P<0.01),说明PTE可降低Hep3B和Bel-7404细胞的增殖速度且具有浓度依赖性(图1B)。平板克隆形成实验结果显示,随着PTE刺激浓度的增加,细胞集落形成数量呈明显下降(Bel-7404细胞3组间比较,F=9.02,P<0.01;Hep3B细胞3组间比较,F=10.09,P<0.01,图1C)。EdU细胞增殖实验结果提示,PTE刺激后Hep3B和Bel-7404细胞增殖能力减弱,表现为S期细胞核红色染色(阳性细胞数)比例减少,与0 μmol/L组比较,差别有统计学意义(Bel-7404细胞3组间比较,F=62.56,P<0.01;Hep3B细胞3组间比较,F=30.66,P<0.01,图1D)。Western-blot实验结果提示,PTE(60 μmol/L)刺激后Bel-7404和Hep3B细胞中CCND1蛋白水平下调(Bel-7404:t=5.09,P<0.01;Hep3B:t=9.21,P<0.01,图1E)。以上体外实验结果表明,PTE降低了HCC细胞的增殖能力。
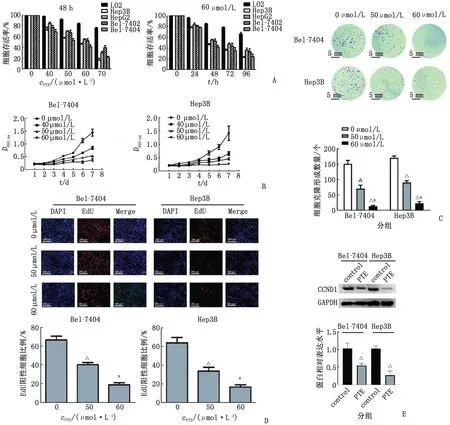
2.3 PTE对HCC体外迁移能力的影响 采用不同浓度的PTE(50和60 μmol/L)刺激Bel-7404和Hep3B细胞48 h。细胞划痕实验结果表明,与0 h组比较,48 h后PTE组的细胞迁移能力降低,并显示出浓度依赖性。不同浓度PTE作用48 h后,与0 μmol/L组比较,Hep3B细胞残余划痕面积的差别均有统计学意义(P<0.01);Bel-7404细胞残余划痕面积亦存在差别(P<0.01,图2A)。Transwell实验结果证实,Bel-7404和Hep3B细胞的迁移数目也被PTE抑制,并显示出浓度依赖性(Bel-7404细胞组间比较,F=52.34,P<0.01;Hep3B细胞组间比较,F=39.28,P<0.01,图2B)。Western-blot 实验结果提示,PTE(60 μmol/L)刺激后Hep3B和Bel-7404细胞中的E-cadherin蛋白水平上调及N-cadherin 蛋白水平下调(图2C)。以上体外实验结果表明,PTE可以抑制HCC细胞的迁移能力。
PTE:紫檀芪;E-cadherin:E-钙黏蛋白;N-cadherin:N-钙黏蛋白;GAPDH:甘油醛-3-磷酸脱氢酶。A:细胞划痕实验;B:Transwell 实验;C:Western-blot实验(PTE组:60 μmol/L浓度的PTE刺激48 h)。与0 μmol/L组或control组比较,△:P<0.05;与50 μmol/L组比较,#:P<0.05。
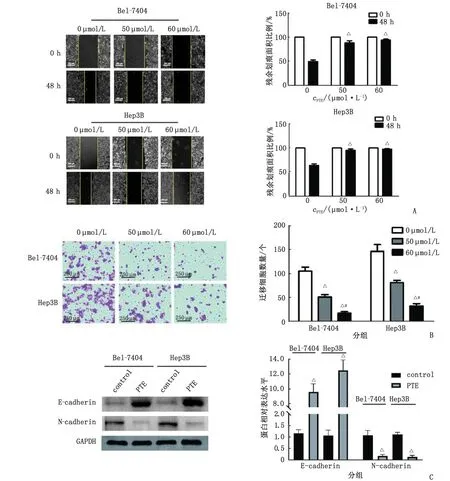
2.4 PTE对Hep3B细胞氧化应激的影响 PTE能下调Hep3B细胞中H2O2的水平,具有明显的剂量依赖性(F=105.02,P<0.01,图3A)。PTE亦能下调Hep3B细胞中ROS的水平,该效应同样具有剂量依赖性(F=247.92,P<0.01,图3B)。以上结果证实,PTE可以抑制Hep3B细胞中的氧化应激水平。
PTE:紫檀芪;H2O2:过氧化氢;NAC:N-乙酰半胱氨酸;NOX4:尼克酰胺腺嘌呤二核苷酸磷酸氧化酶4;GAPDH:甘油醛-3-磷酸脱氢酶;DCFH-DA:2′,7′-二氢二氯荧光素二乙酸酯。A和C:过氧化氢浓度测定;B、D和G:ROS活性检测;E:Western-blot实验;F:qRT-PCR实验测定NOX4的 mRNA表达水平。与0 μmol/L组或control组比较,△:P<0.05;与50 μmol/L组比较,#:P<0.05;与H2O2组比较,▲:P<0.05;与PTE组比较,◆:P<0.05;与VAS2870组比较,★:P<0.05。
给予经典的ROS诱导剂H2O2(100 mmol/L)刺激2 h后,Hep3B细胞中的H2O2水平明显升高,但这一变化可被PTE(60 μmol/L)所抑制(图3C);其中,PTE组、H2O2组分别与control组比较,差别有统计学意义(PTE组vscontrol组,t=15.04,P<0.01;H2O2组vscontrol组,t=7.89,P<0.01),PTE+H2O2组与PTE组比较,差别有统计学意义(t=6.24,P<0.01)。PTE(60 μmol/L)与过氧化物抑制剂NAC的联合应用对ROS的抑制作用产生叠加效应(PTE组vscontrol组,t=11.97,P<0.01;NAC组vs control组,t=21.21,P<0.01;PTE+NAC组vsPTE组,t=6.49,P<0.01)(图3D)。
2.5 PTE对Hep3B细胞NOX4表达的影响 PTE刺激48 h后,Hep3B中细胞NOX4蛋白表达水平明显下调,并呈现出剂量依赖性(F=323.40,P<0.01,图3E)。同样予PTE处理后,Hep3B中细胞NOX4 mRNA表达水平明显下调,并呈现剂量依赖性(F=271.10,P<0.01,图3F)。上述实验结果表明,PTE对ROS的抑制作用可能与其调控NOX4相关。PTE和VAS2870的联合应用对ROS的抑制作用产生叠加效应(图3G)。以上结果表明,PTE对Hep3B细胞增殖和迁移能力的抑制,可能是通过下调细胞内NOX4来源的ROS水平实现。
2.6 PTE对Hep3B细胞NLRP3炎症小体活化的影响 PTE刺激48 h后,Hep3B细胞中NLRP3、ASC、Caspase-1(p10)和IL-1β的蛋白表达水平呈现出剂量依赖性下调(图4A)。免疫荧光染色结果显示,与control组比较,LPS组中NLRP3、ASC、Caspase-1(p10)和IL-1β表达明显增多;而予PTE(60 μmol/L)处理后,LPS+PTE组中NLRP3、ASC、Caspase-1(p10)和IL-1β蛋白表达水平较LPS组下降。以上结果表明,LPS诱导的NLRP3炎症小体复合物的组装被PTE所抑制(图4B)。
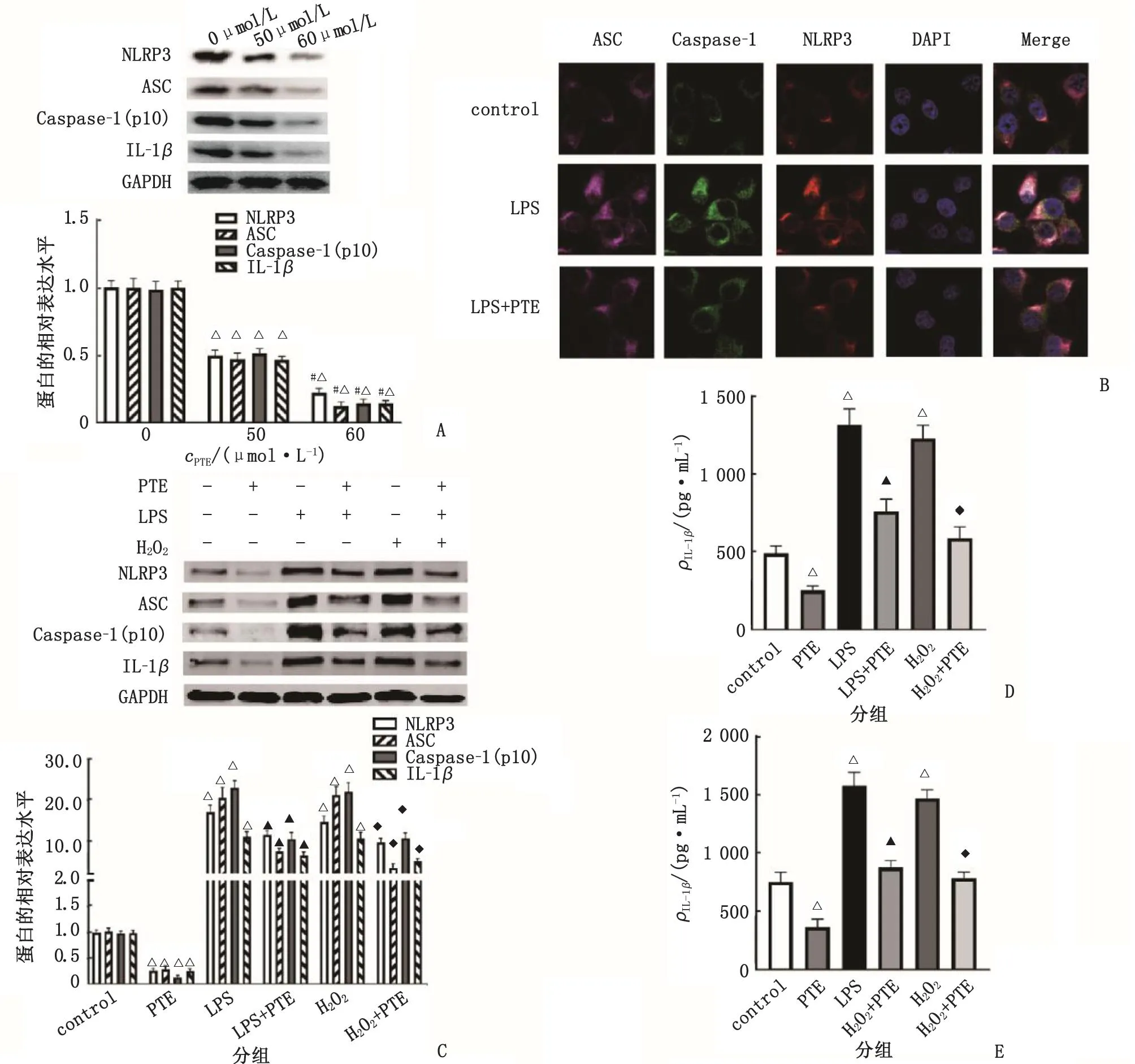
PTE:紫檀芪;H2O2:过氧化氢;LPS:脂多糖;NAC:N-乙酰半胱氨酸;IL-1β:白细胞介素1β;IL-18:白细胞介素18;NLRP3:核苷酸结合寡聚化结域样受体蛋白3;ASC:凋亡相关的斑点样蛋白;Caspase-1:含半胱氨酸的天冬氨酸蛋白水解酶1;Merge:融合;DAPI:4′,6-二脒基-2-苯基吲哚;GAPDH:甘油醛-3-磷酸脱氢酶。A和C:Western-blot实验测定NLRP3、ASC、Caspase-1(p10)和IL-1β的蛋白表达水平;B:NLRP3 炎症小体组装图(细胞免疫荧光染色);D:IL-1β浓度测定;E:IL-18浓度测定。与0 μmol/L组或control组比较,△:P<0.05;与50 μmol/L 组比较,#:P<0.05;与LPS组比较,▲:P<0.05;与H2O2组比较,◆:P<0.05。
使用经典的炎症诱导因子LPS或ROS诱导剂H2O2刺激Hep3B细胞后,明显上调NLRP3、ASC、Caspase-1(p10)和IL-1β的蛋白表达水平,但PTE干预后下调NLRP3、ASC、Caspase-1(p10)和IL-1β的表达水平(图4C)。检测Hep3B细胞中IL-1β和IL-18的水平:LPS或H2O2刺激Hep3B细胞后,明显上调Hep3B细胞中IL-1β和IL-18水平,但PTE干预后下调了IL-1β和IL-18水平(图4D、E)。上述结果证实,PTE可以抑制Hep3B细胞中NLRP3炎症小体的活化,并下调下游IL-1β和IL-18的表达水平。
2.7 PTE通过调控氧化应激和NLRP3炎症小体抑制HCC的增殖和迁移 MTT实验结果提示,LPS或H2O2刺激后可明显增强Hep3B细胞的增殖能力(control组vsLPS组,t=3.73,P=0.015;control 组vsH2O2组,t=2.69,P=0.035),而PTE干预后(60 μmol/L)可抵消上述刺激的变化(图5A)。Transwell 实验证实,LPS或H2O2刺激可明显增强Hep3B细胞的迁移能力(control组vsLPS组,t=5.41,P<0.01;control组vsH2O2组,t=3.44,P=0.026),加入PTE干预后上述趋势发生逆转(图5B)。上述结果再次验证,PTE可通过抑制氧化应激和NLRP3炎症小体,从而抑制HCC的增殖与迁移能力(图5C)。

PTE:紫檀芪;H2O2:过氧化氢;LPS:脂多糖;IL-1β:白细胞介素1β;IL-18:白细胞介素18;NLRP3:核苷酸结合寡聚化结域样受体蛋白3;ASC:凋亡相关的斑点样蛋白;Caspase-1:含半胱氨酸的天冬氨酸蛋白水解酶1;NOX4:尼克酰胺腺嘌呤二核苷酸磷酸氧化酶4;ROS:细胞活性氧;MTT:3-(4,5-二甲基噻唑-2)-2,5-二苯基四氮唑溴盐;HCC:肝细胞癌。A:MTT实验;B:Transwell实验;C:研究机制示意图。与0 μmol/L组或control组比较,△:P<0.05;与LPS组比较,▲:P<0.05;与H2O2组比较,◆:P<0.05。
3 讨 论
我国是肝癌高发地区,每年全球约50%的新发肝癌病例发生在中国。此外,我国每年肝癌死亡病例数占全球的50%,且大多数HCC的患者被确诊时通常已处于晚期[10]。中国HCC患者的 5 a 总生存率为12%,中位死亡时间为23个月[10]。目前临床上对晚期HCC的治疗手段有限且效果欠佳。既往文献[3]也证实,PTE在人体内毒性小,可以被迅速吸收且广泛分布,具有较好的代谢稳定性和生物利用度。本研究比较了4种HCC与正常肝细胞LO2在PTE刺激下存活率的差别,结果提示,在相同浓度和刺激时间下,PTE对于正常肝细胞仅有轻微毒性,从而间接证明了PTE治疗的安全性,与既往的研究[3]结果一致。因此,PTE可以作为一种天然、安全和有效的肝癌治疗辅助药物。
本研究结果发现,PTE可以有效抑制HCC细胞的增殖能力和集落形成能力。在多种肿瘤中,细胞周期蛋白CCND1的过度表达并伴随细胞周期蛋白依赖性激酶(cyclin-dependent kinases,CDK)活性的失调,引发肿瘤细胞异常增殖[11-12]。本研究发现,PTE刺激后Hep3B和Bel-7404细胞中CCND1蛋白的表达明显减少。此外,细胞划痕实验和Transwell 实验结果均证实,PTE具有抑制HCC细胞迁移的作用。上皮-间充质转化(epithelial-to-mesenchymal transition, EMT)信号在肿瘤细胞迁移表型中起重要调控作用[13-14]。本研究证明,PTE刺激后HCC中EMT信号受到抑制,具体表现为E-cadherin的表达增加和N-cadherin的表达降低。综上,PTE在体外能够有效抑制HCC细胞的增殖和迁移。
氧化应激系指体内氧化和抗氧化这2个拮抗体系的失衡所引起的机体生化、生理过程异常。其中,ROS是最重要的氧化剂;在氧化应激条件下,过量的ROS会激活各种转录因子,导致炎症、肿瘤细胞增殖、迁移和血管生成等[15]。研究[15]表明,ROS在肝癌的发生、发展机制中发挥着双重作用:一方面ROS可促进DNA损伤,导致潜在致癌突变的发生;ROS还可以作为信号分子来驱动肿瘤细胞增殖、迁移,包括增强EMT、癌细胞的迁移和侵袭以及与内皮细胞的黏附作用;ROS能通过改变表观遗传调控促进肝癌发生、发展;ROS还被证明在HCC细胞中激活TGF-β1/Smad3/Xct通路,增强肝癌的脂质过氧化作用[16]。另一方面,过量的ROS增加氧化损伤、细胞衰老,增强ROS依赖性的死亡方式比如凋亡、焦亡和铁死亡等,从而限制肿瘤的进展[15]。本研究发现,PTE抑制了Hep3B细胞中ROS和 H2O2水平;而用经典的ROS诱导剂H2O2刺激Hep3B细胞后,细胞中的ROS水平升高,但这一变化可被PTE所抑制。PTE联合过氧化物抑制剂NAC能够进一步下调细胞内ROS和H2O2水平。
NOX是一类以生成活性氧类物质为主要功能的蛋白复合体,NOX的多种蛋白亚基如NOX1、NOX2及NOX4等均参与HCC的发生、发展过程[17-19];其中,既往文献[18-21]已证实NOX4的高表达与HCC的预后密切相关,它能通过调控EMT、癌细胞死亡方式以及巨噬细胞分化等过程,参与HCC的发生、发展。因此,NOX4已经成为抗肿瘤治疗的一个重要靶点。生理状态下,NOX4能持续产生低水平H2O2,且NOX4主要通过自身mRNA水平调节ROS生成;NOX4作为ROS的主要来源之一,病理状态下NOX4过表达会引起ROS生成明显增多,体内氧化应激平衡被打破[22]。在肿瘤微环境中,NOX4是能量代谢的感受器,当线粒体ATP下降时,NOX4活性增强,ROS产生增多,从而导致肿瘤细胞凋亡被抑制[23]。本研究结果证实,PTE在体外实验中显著降低Hep3B细胞中NOX4转录和翻译的表达水平;PTE与NOX4特异性阻断剂VAS2870的联合应用对HCC中ROS和H2O2的抑制作用产生了叠加效应。以上结果说明,PTE通过调控NOX4这个关键分子,影响Hep3B细胞的氧化应激水平,进而抑制细胞的增殖和迁移能力。因此,可以推断PTE对ROS的抑制作用与其下调NOX4的表达相关,通过阻断细胞内NOX4来源的ROS生成是PTE抑制Hep3B细胞增殖、迁移作用的可能机制之一。
NLRP3炎症小体复合物是目前结构和功能最明确的一种炎症小体,主要由模式识别受体NLRP3,衔接分子ASC和效应分子前体Caspase-1组成[24]。炎症小体能够识别病原相关分子模式(pathogen-associated molecular patterns,PAMPs)或者内源性损伤相关分子模式(damage associated molecular patterns,DAMPs),募集和激活促炎症蛋白酶Caspase-1;活化的Caspase-1切割IL-1β和IL-18 的前体,产生成熟的IL-1β和IL-18,发挥促炎作用[24]。既往研究[25-27]已证实,NLRP3炎症小体能介导各种促炎细胞因子分泌,与HCC的增殖、侵袭、血管生产和迁移等各个阶段的进展均有密切相关。ROS被认为是驱动NLRP3炎症小体活化的主要因素之一[24];ROS可以触发NLRP3炎症小体激活,进而抑制癌细胞的增殖和迁移[6,25,28-29]。本研究发现,PTE明显下调了Hep3B细胞中NLRP3炎症小体组分NLRP3、ASC和Caspase-1(p10)的表达水平,进而抑制了炎症小体的活化组装。此外,使用经典的炎症诱导因子LPS或者ROS诱导剂H2O2刺激Hep3B细胞可以上调NLRP3炎症小体组分的表达,但这一效应亦能被PTE所抑制。PTE对NLRP3炎症小体的抑制作用也进一步下调了其下游的IL-1β和IL-18分泌水平,从而抑制炎症反应。以上结果表明,PTE抑制ROS诱导的NLRP3炎症小体激活,可能是PTE抑制Hep3B细胞增殖和迁移产生的分子机制之一。此外,核因子-κB(nuclear factor-kappa B,NF-κB) 信号通路的激活被认为是NLRP3炎症小体活化启动阶段的重要标志[24]。已有研究[30-31]报道,柴胡皂苷D及延龄草提取物可以通过ROS/NF-κB/NLRP3/GSDMD信号轴调控肺癌的增殖和迁移。同时,既往多数文献[32-33]证实,PTE对NF-κB信号通路活化起到抑制作用,可以抑制肿瘤细胞的增殖和迁移;在肝癌中PTE对NF-κB 信号通路的作用值得进一步深入探讨。
本研究存在以下不足之处:PTE对NLRP3炎症小体活化的具体机制缺乏进一步探讨,后续的研究将结合NF-κB信号通路进行更深入的探讨。同时,本研究缺乏PTE在体内实验方面抑制HCC增殖、迁移的相关数据,在后续研究中可以采用原位种植方法在裸鼠肝包膜下接种荧光标记的HCC,采用体外动态显影方式追踪细胞迁移情况。
