达格列净对中青年2型糖尿病患者非酒精性脂肪肝的改善作用
2024-01-09高秀莹朱传明郭彩红朱巍
高秀莹,朱传明,郭彩红,朱巍
1 北京航天总医院内分泌科,北京 100076;2 北京航天总医院影像科
非酒精性脂肪性肝病(NAFLD)作为代谢综合征在肝脏的表现,在肥胖和2 型糖尿病(T2DM)患者中普遍存在,新近一项研究显示T2DM 患者中NAFLD患病率为55.3%[1]。NAFLD 病情持续进展可能会导致肝硬化甚至肝细胞癌,然而目前对于NAFLD 的治疗不足。具有减重及改善胰岛素抵抗作用的降糖药是治疗T2DM合并NAFLD患者的首选。吡格列酮及一些胰高血糖素样肽1受体激动剂(GLP-1 RAs)可减轻脂肪肝,但吡格列酮可增加体质量,而GLP-1 RAs不仅价格较为昂贵,而且会产生一定的胃肠反应,因此限制了此类药物的临床应用。达格列净是首个钠—葡萄糖协同转运蛋白-2 抑制剂(SGLT2i),不仅降糖疗效确切[2],而且具有减重、调脂、降压、降尿酸作用[3-5],还可减少尿蛋白,改善肾脏终点事件[6],降低心血管死亡及心衰住院率[7]。关于达格列净对NAFLD的影响国内外研究较少,且多存在研究病例较少、研究时限较短、或采用B超定性评估脂肪肝变化,缺乏准确的定量评估。本研究将达格列净应用于40例中青年T2DM 合并NAFLD 患者中,应用定量CT(QCT)测量肝脏脂肪含量,观察其对该类人群NAFLD 的影响。现报告如下。
1 资料与方法
1.1 临床资料 选取2020 年6 月—2021 年3 月北京航天总医院收治的中青年T2DM 合并NAFLD 患者40 例,男24 例,女16 例;年龄(46.0 ± 5.6)岁;糖尿病病程(6.6 ± 4.2) a。T2DM 的诊断参照2020 年ADA 标准[8];NAFLD 的诊断依据2010 年中华医学会肝脏病学分会制定的《非酒精性脂肪性肝病诊疗指南》的超声或CT 诊断标准[9]。纳入标准:①年龄20~59 岁;②T2DM,经两种或两种以上口服降糖药(不包括SGLT-2i)治疗后血糖控制不达标,空腹血糖>7 mmol/L,餐后2 小时血糖>10 mmol/L,糖化血红蛋白(HbA1C)≥7%;③合并NAFLD,近2 周内未应用任何护肝药物。排除标准:①饮酒史、病毒性肝炎、药物性肝病等其他肝病,严重肝功能不全(转氨酶≥正常上限3 倍);②肾功能不全(血肌酐≥正常上限);③合并严重心脑血管疾病、心功能不全以及其他严重疾病;④反复发作的低血糖;⑤糖尿病酮症酸中毒;⑥低血压;⑦泌尿生殖系统感染;⑧重度骨质疏松或骨折;⑨合并甲亢或甲减;⑩合并急性感染、恶性肿瘤及自身免疫性疾病;⑪妊娠哺乳期以及近期有妊娠需求的妇女。本研究经我院伦理委员会批准,入选患者均签署知情同意书。
1.2 达格列净口服方法 入选患者在维持原降糖方案(未应用SGLT2i类药物)不变的基础上,加用达格列净片(阿斯利康公司,规格:10 mg×14 片)治疗,每日1 次10 mg 于早晨服用,不受进食限制,治疗期间,每4 周复诊1 次,监测指血糖,观察、记录患者用药后的不良反应,共服药20 周。试验期间维持原降压、调脂等治疗方案,不服用其他可能影响患者体质量、血糖、血压、血脂、尿酸的药物及护肝药物。
1.3 观察指标及观察方法 肝脏脂肪含量及内脏脂肪面积测定:患者分别于治疗前后行腹部QCT 检查,均由本院影像科一名主治医师专人操作,将获得的扫描数据上传至QCT 测量分析软件工作站进行数据测量。首先,采用国际原子能委员会提供的换算公式,测量肝脏脂肪含量百分比。其次,测量脐水平层面腹部内脏脂肪面积和皮下脂肪面积。同时,测量腰椎L1~L3骨密度值,并计算其平均值。肝功能、炎症因子检测及肝纤维化评估:患者分别于治疗前、治疗20 周时采集空腹静脉血,于我院检验科检测谷丙转氨酶(ALT)、谷草转氨酶(AST)、γ-谷氨酰转肽酶(GGT)、血小板计数、超敏C 反应蛋白(hs-CRP)、白细胞介素6(IL-6)。IL-6 测定采用西门子全自动化学发光免疫分析仪(IMMULITEl000)测定。用FIB-4指数评估肝纤维化[10],FIB-4指数=年龄(岁)×AST(U/L)/[血小板计数(×109/L)×ALT(U/L)1/2]。代谢指标检测:患者分别于治疗前、治疗20 周时采集空腹静脉血及空腹晨尿,于我院检验科检测糖代谢指标:HbA1C、空腹血糖、空腹胰岛素,血脂谱:甘油三酯(TG)、总胆固醇(TC)、低密度脂蛋白(LDL-C)、高密度脂蛋白(HDL-C),骨代谢指标:血钙、血磷、25-羟基维生素D,肾功能:肌酐、尿酸、尿微量白蛋白/肌酐(UACR)。采用稳态模型计算胰岛素抵抗指数及胰岛β 细胞功能指数:HOMA-IR=空腹血糖(mmol/L)×空腹胰岛素(μU/mL)/22.5;HOMA-β=20×空腹胰岛素/(空腹血糖-3.5)。采用MDRD 公式估算肾小球滤过率(eGFR)。收集人体测量指标:患者分别于治疗前、治疗20 周时测定身高、体质量、血压,计算体质量指数(BMI),BMI=体质量(kg)/身高(m2)。
1.4 统计学方法 采用SPSS19.0 统计软件。符合正态分布的计量资料以±s表示,治疗前后的比较采用配对t检验。P<0.05 为差异有统计学意义。
2 结果
2.1 T2DM 合并NAFLD 患者治疗前后肝脏脂肪含量、肝功能、肝纤维化指标比较 治疗前后肝脏脂肪含量、肝功能、肝纤维化指标比较见表1。结果显示,治疗后患者的肝脏脂肪含量、ALT、AST、γ-GGT 均较治疗前显著下降(P均<0.05),提示达格列净可改善脂肪肝、降低肝酶,但并未改善肝纤维化评分。
表1 T2DM合并NAFLD患者治疗前后肝脏脂肪含量、肝功能、肝纤维化指标比较(± s)

表1 T2DM合并NAFLD患者治疗前后肝脏脂肪含量、肝功能、肝纤维化指标比较(± s)
注:与治疗前比较,*P<0.05。
?
2.2 T2DM 合并NAFLD 患者治疗前后血清炎症因子水平比较 治疗前后血清炎症因子水平比较见表2。结果显示,治疗后患者的血清hs-CRP、IL-6 均较治疗前显著下降(P均<0.05)。
表2 T2DM合并NAFLD患者治疗前后血清炎症因子水平比较(± s)

表2 T2DM合并NAFLD患者治疗前后血清炎症因子水平比较(± s)
注:与治疗前比较,*P<0.05。
?
2.3 T2DM 合并NAFLD 患者治疗前后体脂指标比较 治疗前后体脂指标比较见表3。结果显示,治疗后患者的体质量、BMI、内脏脂肪面积、皮下脂肪面积、腹部总脂肪面积均较治疗前显著下降(P均<0.05),其中内脏脂肪面积较皮下脂肪面积下降更为显著(13.4%vs. 11.9%)。
表3 T2DM合并NAFLD患者治疗前后体脂指标比较(± s)

表3 T2DM合并NAFLD患者治疗前后体脂指标比较(± s)
注:与治疗前比较,*P<0.05。
?
2.4 T2DM 合并NAFLD 患者治疗前后血糖、胰岛素抵抗及胰岛功能比较 治疗前后血糖、胰岛素抵抗及胰岛功能比较见表4。结果显示,治疗后患者的空腹血糖、HbA1C、HOMA-IR 均较治疗前显著下降(P均<0.05),HOMA-β 较治疗前显著升高(P<0.05),提示达格列净显著降糖的同时,可使胰岛素抵抗减轻,胰岛β 细胞功能改善。
表4 T2DM合并NAFLD患者治疗前后血糖、胰岛素抵抗及胰岛功能比较(± s)

表4 T2DM合并NAFLD患者治疗前后血糖、胰岛素抵抗及胰岛功能比较(± s)
注:与治疗前比较,*P<0.05。
?
2.5 T2DM 合并NAFLD 患者治疗前后代谢相关指标比较 治疗前后收缩压、舒张压、TG、TC、LDL-C、HDL-C 比较见表5,治疗前后尿酸、eGFR、UACR、血钙、血磷、25-羟基维生素D、骨密度比较见表6。
表5 T2DM合并NAFLD患者治疗前后收缩压、舒张压、TG、TC、LDL-C、HDL-C比较(± s)

表5 T2DM合并NAFLD患者治疗前后收缩压、舒张压、TG、TC、LDL-C、HDL-C比较(± s)
注:与治疗前比较,*P<0.05。
?
表6 T2DM合并NAFLD患者治疗前后尿酸、eGFR、UACR、血钙、血磷、25-羟基维生素D、骨密度比较(± s)
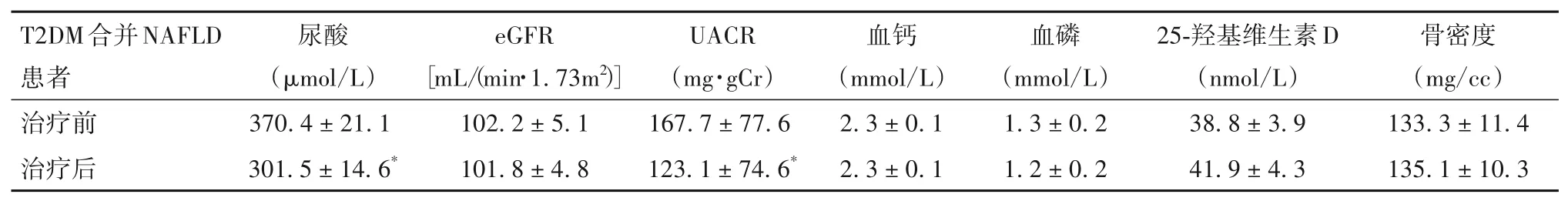
表6 T2DM合并NAFLD患者治疗前后尿酸、eGFR、UACR、血钙、血磷、25-羟基维生素D、骨密度比较(± s)
注:与治疗前比较,*P<0.05。
?
3 讨论
T2DM 与NAFLD 密切相关、相互促进,T2DM 可使NAFLD 进展为更严重的非酒精性脂肪性肝炎及肝硬化的风险增加[11],NAFLD 会加快糖尿病相关靶器官损害的进程。但目前对NAFLD 的重视不足,尤其中青年患者治疗的意义更大,积极的治疗可延缓甚至阻断疾病进展到终末期肝病的进程。目前,针对T2DM 合并NAFLD 的治疗,一线治疗生活方式干预需要患者良好的依从性,而药物治疗的证据仍有限,兼顾减重及减轻NAFLD 的降糖药是治疗的优选。研究[12-14]显示,吡格列酮、利拉鲁肽、司美格鲁肽可减轻肝脏脂肪沉积、改善脂肪性肝炎,减缓肝纤维化进展,但吡格列酮可增加体质量和骨折风险,不利于T2DM 患者的管理,而SGLT2i 中不同的药物种类对NAFLD的疗效不一[15]。
达格列净是首个SGLT2i,除显著降糖外,同时能减重、改善血脂谱、改善胰岛素抵抗,这些特点将有助于减轻NAFLD。目前,关于达格列净对NAFLD 的影响国内外研究较少。瑞士的EFFECT-Ⅱ研究[16]对T2DM 合并NAFLD 患者应用达格列净和(或)n-3 羧酸治疗12 周,结果显示只有两者联用能降低肝脏脂肪含量,而达格列净单药治疗仅可降低肝细胞损害标志物。一项随机对照研究[17]招募了32 例T2DM 患者,显示达格列净治疗8 周可降低肝脏脂肪分数,但并不影响外周组织对胰岛素的敏感性。王丽娜等[18]对糖尿病合并脂肪肝患者加用达格列净治疗12 周,采用B超定性评估脂肪肝,显示达格列净能改善胰岛素抵抗,促进脂肪肝缓解。一项随机对照研究对38例T2DM 合并NAFLD 患者应用达格列净治疗12周,显示达格列净可显著降低肝内脂质含量及ALT 水平[19]。ARASE 等[20]对17 例T2DM 合并NAFLD 患者研究发现,SGLT2i 治疗24 周可降低肝脏脂肪含量,改善肝功能,并且肝脏脂肪含量降低程度与体质量变化及HOMA-IR 变化呈正相关。KINOSHITA 等[21]发现,在降糖疗效相当的情况下,达格列净在改善NAFLD 的疗效上与吡格列酮相当,优于格列美脲。然而,目前关于SGLT2i对肝纤维化的影响尚有争议。SHIMIZU 等[22]对57 例T2DM 合并NAFLD 患者应用达格列净5 mg/d治疗24 周,显示达格列净在严重肝纤维化患者中能降低肝硬度,减轻肝纤维化。AKUTA 等[23]报道应用卡格列净治疗T2DM 合并NAFLD 患者24周可达到肝脏组织学的改善,并降低肝纤维化评分33%。亦有研究[24]对20 例T2DM 合并NAFLD患者应用卡格列净治疗12 月,显示卡格列净可降低肝脏脂肪含量及肝酶、Ⅳ型胶原水平,但并未改善FIB-4 评分。本研究结果显示,达格列净治疗20 周可显著降低患者的肝脏脂肪含量,降低肝酶,改善脂肪肝,这与既往研究相一致;本研究采用FIB-4 指数评估肝纤维化,结果显示达格列净治疗20 周并未改善肝纤维化评分,这可能与本研究样本量较小、治疗前时无显著肝纤维化及研究时限较短有关;达格列净治疗20 周后,患者的体质量、BMI、内脏脂肪面积、皮下脂肪面积均较治疗前显著下降,其中内脏脂肪面积较皮下脂肪面积下降更为显著;患者的血糖显著下降,胰岛素抵抗显著减轻,胰岛β 细胞功能改善;患者血压、甘油三酯、总胆固醇、尿酸、尿微量白蛋白均较治疗前显著下降;上述结果提示,达格列净可改善代谢综合征,这与文献[25-26]报道相一致。本研究还显示,达格列净治疗对骨代谢无显著影响,此结果也与既往研究[27]一致。
胰岛素抵抗和炎症氧化应激在NAFLD 的发病机制中发挥了重要的作用,目前达格列净改善NAFLD 的机制未明。动物研究表明达格列净通过抗炎、抗氧化应激、抗肝纤维化和抗肝细胞凋亡的机制改善NAFLD。临床研究[28]显示,对T2DM 合并NAFLD 患者应用SGLT2i 治疗6 个月可降低IL-1β、IL-6 等促炎细胞因子及氧化应激水平。另一项3 期临床研究事后分析显示[29],卡格列净300 mg/d 治疗52 周可显著升高血清脂联素水平、降低血清IL-6 水平。本研究进一步探索了达格列净改善NAFLD 的可能机制,结果显示达格列净治疗20 周可降低hs-CRP、IL-6 炎症因子水平,这与既往研究结论相一致,IL-6 等炎症因子的降低提示慢性炎症状态的改善,并与达格列净改善NAFLD的作用密切相关。
总之,在中青年T2DM 合并NAFLD 患者应用达格列净治疗20 周,在降糖、减重、改善胰岛功能、减轻胰岛素抵抗、改善代谢综合征的同时,可显著降低肝脏脂肪含量,降低肝酶,降低血清IL-6等炎症因子水平,改善脂肪肝。
