急性淋巴细胞白血病患者外周血滤泡辅助性T细胞亚群比例、血清细胞因子水平变化及其相关性
2024-01-09张冉冉龚珊张瑞张淋一张曼姁曲建华
张冉冉,龚珊,张瑞,张淋一,张曼姁,曲建华
新疆医科大学第一附属医院血液病中心,乌鲁木齐 830054
急性淋巴细胞白血病(ALL)是一种发生在B细胞或者T 细胞的未成熟淋巴细胞的肿瘤性疾病,主要病理表现为大量原始细胞聚集在骨髓内,破坏骨髓正常的造血,而产生一系列的症状,包括贫血、出血、感染等[1]。在标准化疗过程中,ALL 容易产生耐药性和复发,复发后的治疗会引起各种并发症,导致患者的存活率显著降低,使治疗充满挑战,寻找新的、不良反应少、患者能耐受的治疗方法是目前临床上亟待解决的关键问题[2]。T 淋巴细胞亚群在体液免疫和细胞免疫方面发挥重要作用,其亚群比例平衡偏移可能导致免疫监视功能异常,进而促进肿瘤细胞的生长增殖[3]。研究[4]发现,接受免疫化疗的ALL 患者出现辅助性T 细胞1 型(Th1)数量升高、辅助性T 细胞2 型(Th2)及调节性T 细胞(Treg)数量减低,提示免疫化疗治疗影响ALL 患者T 细胞,尤其是CD4+T 细胞,可能导致机体免疫功能障碍。Tfh1 分泌Th1 型细胞因子干扰素-γ(IFNγ),Tfh2 分泌Th2 型细胞因子IL-γ,Tfh17 分泌Th17细胞因子IL-17。目前,关于ALL 患者Tfh 亚群及细胞因子之间的作用关系尚不明确,国内鲜有相关报道[5-10]。2022 年5 月—2023 年6 月,我们观察了ALL外周血Tfh 亚群比例、血清细胞因子水平变化,并分析两者间及其与患者预后的关系,旨在为ALL 的免疫治疗提供新思路。
1 资料与方法
1.1 临床资料 选取2022 年5 月—2023 年6 月新疆医科大学第一附属医院收治的初次确诊未经治疗的ALL 患者30 例(观察组),男18 例,女12 例;中位年龄43.00(21.75,58.00)岁;所有患者均经细胞形态学、免疫学、细胞遗传学及分子生物学分型明确诊断,排除慢性淋巴细胞白血病的急淋变及既往有相关自身免疫性疾病、感染、肿瘤病史的患者,符合《血液病诊断及疗效标准》的诊断标准。观察组再根据ALL 患者预后危险分层标准[11]分为预后良好者[13例,年龄<35 岁,初诊WBC<30×109/L(B-ALL)或<100×109/L(T-ALL),早期达完全缓解(CR)且CR 后MRD 阴性/<10-4]和预后不良者[17 例,年龄≥35岁,初诊WBC≥30×109/L(B-ALL)或≥100×109/L(T-ALL),达CR 时间超过4周且CR 后MRD 阳性/≥10-4]。另选取同期健康体检者20 例(对照组),男10 例,女10 例;中位年龄48.5(37.75,58.00)岁。两组一般资料无统计学差异,具有可比性。本研究获得新疆医科大学第一附属医院伦理委员会批准(批准文号:K202306-11),受试者均知情同意。
1.2 外周血Tfh 比例、血清细胞因子测算 分别采集观察组和对照组空腹外周静脉血4 mL,置于肝素钠抗凝试管中,颠倒混匀后静置,于2 h 内送检。采集好的外周血经室温150 g 离心5 min,收集上层血清,立即冻存于-80 ℃冰箱,备用。①外周血Tfh 亚群:采用流式细胞术检测。取存有4 mL 新鲜外周血的 肝素钠抗凝管,标记所有受试者序号,在流式管壁上标记相对应序号,准备需要的抗体。吸取100 μL 外周血置于相同编号的流式管内,分别加入抗体CD4-FITC、CXCR3-PE/Dazzle、CCR6-PerCP/Cyanine5.5、CXCR5-PE 各1 μL,在避光环境下温育20 min;后加入1 mL 溶血剂混匀,在避光环境下静置20 min;随后经150 g 下离心5 min,倒去上清;加入2 mL 的PBS 溶液混匀,经150 g 下离心5 min,随后加入PBS 溶液300 μL 混匀重悬细胞,然后上流式细胞仪检测Tfh(CD4+CXCR5+)、Tfh1(CD4+CXCR5+CXCR3+CCR6-)、Tfh2(CD4+CXCR5+CXCR3-CCR6-)及Tfh7(CD4+CXCR5+CXCR3-CCR6+) 的细胞比例,获取数据后,应用FlowJo软件分析。②血清IFN-γ、IL-4、IL-17:采用ELISA法检测。将血清标本放置室温解冻,同时将Human IFN-γ、IL-4、IL-17的ELISA 试剂盒提前放至室温平衡20 min;在酶标包被板上设标准品孔,加入不同稀释浓度的标准品50 μL,并设空白孔及待测孔;在待测孔中加待测样品40 μL,再加抗IFN-γ、IL-4、IL-17抗体各10 μL,晃动混匀,每孔加入酶标试剂50 μL,空白孔除外;再加入100 μL 过氧化物酶工作液,封板,37 ℃孵育1 h,弃去液体并甩干,洗板5 次,每孔加入100 μL 的底物溶液,37 ℃孵育15 min,50 μL 终止溶液终止反应,检测每孔450 nm 吸光度,根据测得的标准品浓度以及对应的OD 值绘制标准曲线,计算出血清IFN-γ、IL-4、IL-17。
1.3 统计学方法 采用SPSS26.0 统计软件。符合正态分布的计量资料以xˉ ± s 表示,比较采用t检验;相关性分析采用Pearson 相关分析法。P<0.05 为差异有统计学意义。
2 结果
2.1 两组外周血Tfh 亚群比例比较 外周血Tfh 亚群比例比较见表1。
表1 两组外周血Tfh亚群比例比较(%,± s)
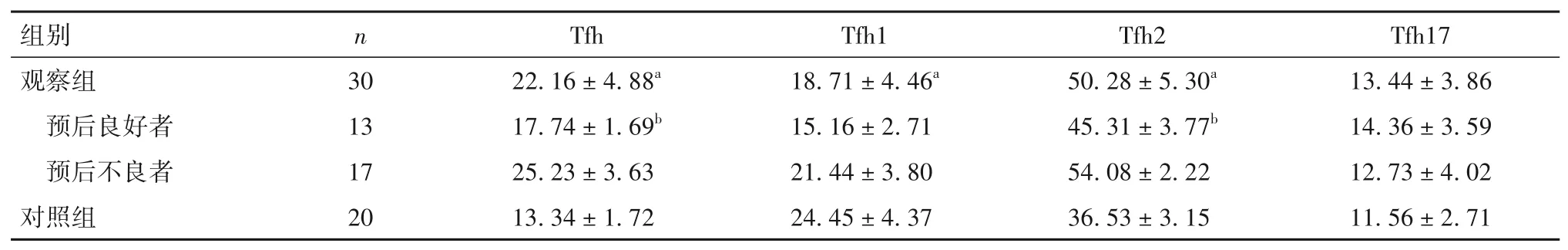
表1 两组外周血Tfh亚群比例比较(%,± s)
注:与对照组比较,aP<0.05;与预后不良者比较,bP<0.05。
?
2.2 两组血清IFN-γ、IL-4、IL-17 水平比较 血清IFN-γ、IL-4、IL-17水平比较见表2。
表2 两组血清IFN-γ、IL-4、IL-17水平比较(ng/L,± s)

表2 两组血清IFN-γ、IL-4、IL-17水平比较(ng/L,± s)
注:与对照组比较,aP<0.05;与预后不良者比较,bP<0.05。
?
2.3 观察组外周血Tfh 亚群比例与血清细胞因子的相关性 观察组Tfh、Tfh2 比例与ALL 患者血清IL-4 水平呈正相关(r分别为0.860、0.965,P均<0.05),Tfh 比例与血清IFN-γ 水平呈负相关(r为-0.289,P<0.05)。
3 讨论
ALL 是一种恶性造血系统肿瘤,其能够浸润到骨髓、血液或其他器官和组织中,引起骨髓造血功能障碍和免疫功能障碍。ALL起病急,发展迅速,具有很高的异质性,因其发病机制及病因的复杂性,患者预后较差,平均生存期仅3 个月[12-13]。现阶段AL 的主要治疗包括化学治疗及造血干细胞移植等方法,尽管随着化疗方案的优化及造血干细胞移植技术的提升,在一定程度上ALL 患者的缓解率及生存时间有所延长,但是仍有部分的患者因疾病复发或难治而死亡[14]。近年来,不断研究和发展的免疫疗法成为一种具有潜力治疗手段,可提高ALL 的精准靶向诊疗。
随着对ALL 疾病不断深入研究,已证实免疫功能紊乱与ALL 的发病机制有关。在抗肿瘤免疫中,淋巴细胞具有重要的作用,T 细胞亚群之间通过相互协调、相互拮抗来维持免疫应答的相对平衡,研究发现的 T 细胞亚群的失调和平衡紊乱参与了ALL疾病进展[3-4,15]。这些年,在免疫学领域,新发现的CD4+T细胞亚群Tfh细胞越来越受到重视,它搭起人体的细胞免疫和体液免疫的桥梁作用[16]。Tfh 细胞是一种不同于Th1、Th2 和Treg 细胞的CD4+T 细胞新亚群,主要定位于B 淋巴滤泡,辅助初始B 细胞增殖分化成熟、抗体类别转换及分泌,促进生发中心形成。已有研究[17]表明,B细胞淋巴瘤患者Tfh细胞数量增多,过度活化的Tfh 细胞,通过分泌如肿瘤坏死因子α、IL-4 及IL-21 等细胞因子可能改变肿瘤微环境,促进肿瘤细胞逃逸。最近的一项研究表明,CLL患者Tfh 细胞的增加与临床分期和肿瘤负荷有关,提示Tfh 在CLL 发病机制中起重要作用,特别是Tfh1细胞水平升高,与肿瘤负荷相关性更强,进而参与了疾病的进展[18]。ZHOU 等[10]研究学者报道,初诊治疗前ALL 患者外周血中Tfh 细胞水平明显高于健康对照组,而在诱导化疗2、4、6个疗程后,缓解者Tfh 水平呈下降趋势,至第6 个疗程末,接近甚至低于健康人,这提示Tfh 过度活化与ALL 疾病进展密切相关。本研究发现,与对照组比较,观察组外周血Tfh 和Tfh2 比例明显增加,Tfh1 比例降低,这表明ALL患者存在免疫功能紊乱,Tfh亚群的变化可能与疾病的发病有关。本研究还显示,观察组预后不良者较良好者Tfh、Tfh2 比例明显增高,而Tfh1 比例无明显差异。提示Tfh 表达量随着ALL 患者危险度进展不断升高,患者体内存在Tfh2 比例升高,Tfh1 比例降低,导致Tfh1/Tfh2比例失衡,且平衡偏向Tfh2,这表明Tfh 可能增强免疫抑制作用,特别是Tfh2 发挥主导作用,促进了疾病的进展。
细胞因子的失衡有助于抑制免疫应答,对于逃避免疫监视至关重要。IFN-γ 是一种主要由T 细胞和自然杀伤细胞产生调节和效应细胞因子,在肿瘤微环境中,其是肿瘤免疫监测的重要参与者,包括抗增殖、抗血管生成和促凋亡等作用[19]。IL-4 是一种多效性的细胞因子,对B 细胞的活化、增殖、分化等不同阶段都发挥重要的作用,其可以下调Th1细胞,抑制抗肿瘤免疫反应。低水平的IFN-γ 可以活化自然杀伤细胞的活化和细胞毒性T 淋巴细胞,降低肿瘤抗原的识别能力,诱导肿瘤细胞发生逃避,还能作用于CD8+T细胞,减弱其对肿瘤细胞的毒性,增加抑制免疫细胞的产生[20]。杨志刚等[4]学者检测了初诊急性白血病患者中血清中IFN-γ 和IL-4,发现ALL患者血清IL-4 水平升高,IFN-γ 水平降低,并检测到ALL 患者机体存在Th1/Th2 比例失衡,使免疫微环境处于抑制状态,不利于抗肿瘤免疫反应,从而导致白血病细胞逃逸。本研究同样检测观察组血清中IFN-γ 和IL-4 水平,并得出了一致的结论;在不同预后分层者中,还发现在预后不良者血清中IL-4 水平更高和IFN-γ 水平更低。故推测在ALL 疾病恶性进展过程中,大量炎症细胞及免疫细胞被活化,高水平的IL-4 和低水平的IFN-γ 导致ALL 患者免疫微环境紊乱,使CD4+Th 细胞向Tfh 分化、增殖。而Tfh 数量的增多,使机体免疫功能发生改变,可能诱导疾病的发生。为了进一步研究ALL 疾病进展中免疫与炎症因素的关系,我们分析了ALL患者血清IFN-γ、IL-4与Tfh 亚群的相关性,结果显示Tfh、Tfh2 与ALL 患者血清IL-4 呈正相关,且与Tfh2 的相关性更强,Tfh与血清中IFN-γ水平呈负相关。我们发现,血清IL-4水平升高与外周血的Tfh2 密切相关,推测IL-4 由Tfh2 产生,而IFN-γ 与Tfh1 没有相关性,推测IFN-γ细胞因子不仅来自Tfh1,还可能来自其他免疫细胞,如Th1细胞。提示ALL 患者体内高水平IL-4和低水平IFN-γ,导致Tfh1/Tfh2免疫平衡发生变化,增多的Tfh2 通过分泌大量IL-4,抑制IFN-γ 的产生及Tfh1的活化,进而导致机体抗肿瘤免疫反应下调,促进肿瘤细胞发生免疫逃逸。
总之,ALL 患者外周血Tfh 及Tfh2 比例增加和Tfh1 比例减小,血清IFN-γ 水平降低和IL-4 水平升高,其与患者预后不良有一定的关系,可能参与了ALL的免疫功能紊乱,并且增强了免疫抑制作用,参与了疾病进展。
