泰拉霉素注射液对自然感染猪呼吸道疾病的治疗效果
2024-01-09赵新祥金永东杨申永李建国吴聪明
王 玲,赵新祥,金永东,杨申永,李建国,吴聪明
( 1. 艾美科健(中国)生物医药有限公司,山东 济宁 272073 ; 2. 中国农业大学动物医学院,北京 100193 )
猪呼吸道疾病是规模化、集约化养猪场经常发生的疾病。该病病因复杂,除多种原发性和继发性病原可引起猪呼吸道疾病外,猪群饲养密度过大、营养不良、免疫功能低下、猪舍通风不良、饲养环境质量差、季节交替等因素均可成为呼吸道疾病暴发的诱因。目前,猪肺炎支原体(MHP)、胸膜肺炎放线杆菌(APP)、多杀性巴氏杆菌(PM)、副猪嗜血杆菌(HPS)、支气管败血波氏杆菌(BB)等是引起我国猪群暴发呼吸道疾病的常见病原菌且尚无有效疫苗预防,严重影响了养猪业的健康发展[1-3]。
泰拉霉素(tulathromycin)是一种动物专用大环内酯类半合成抗生素,主要用于治疗由敏感菌引起的牛、猪呼吸系统疾病。泰拉霉素不仅对放线杆菌、支原体、巴氏杆菌、嗜血杆菌等病原菌的抗菌作用较强,而且具有用量少、一次给药、低残留等优点[4-7]。我国现行使用较为广泛的大环内酯类药物有红霉素、泰乐菌素、替米考星等,这些药物虽然在控制动物呼吸系统疾病中发挥了重要作用,但随着使用时间延长均出现了不同程度的耐药性,导致治疗效果逐步降低。因此需要加强泰拉霉素等新型抗菌药物的开发与应用[8-10]。基于此,本研究选择两种泰拉霉素注射液[11-13]分别作为对照药和受试药,开展针对自然感染呼吸道疾病猪的治疗试验,以明确按推荐剂量使用该制剂的有效性和安全性,为临床合理用药提供参考。
1 材料与方法
1.1 试验材料
1.1.1 试验动物
本试验在山东省某规模化猪场开展,试验猪场饲养的700余头50~70日龄保育猪中有200余头先后发病,表现出发热、呼吸困难、精神沉郁、食欲减退等临床症状。通过临床检查、病理剖检和实验室检测(包括呼吸道疾病相关病原菌分离鉴定、呼吸道疾病相关病毒和支原体抗体检测),确诊为由APP、HPS、PM单一或混合感染引起的呼吸道疾病,并从患病猪群中按标准遴选120头猪开展试验。
试验猪入选标准:肛温≥40 ℃,且呼吸异常(呼吸评分≥2)、状态异常(状态评分≥2)。
试验猪排除标准:患有非呼吸道相关疾病;过度虚弱,通过单一或单次用药治疗不太可能改善;接种过呼吸道疾病相关细菌(APP、PM、HPS等)疫苗;试验前15 d内使用过可能影响本试验的药物(如全身性使用糖皮质激素、非甾体抗炎药、抗菌药物等)。
1.1.2 试验药物两种泰拉霉素注射液,分别设为对照药和受试药,规格均为50mL∶5 g,包装为50 mL/瓶。
1.1.3 试剂与设备
试验试剂:TSA培养基、TSB培养基、小牛血清及相关病原抗体检测ELISA试剂盒等。
试验设备:注射器、体温计、灭菌棉拭子、PCR仪、电泳仪、恒温培养箱、离心机等。
上述试剂与设备均由中国农业大学国家兽药安全评价中心提供。
1.2 试验设计
从发病猪群中遴选120 头患病猪,随机分成2 组(Ⅰ组、Ⅱ组),每组60头猪,每圈即1个重复。将试验猪转移至隔离猪舍内分批、分圈饲养(每批猪一个圈,其中A圈Ⅰ组、Ⅱ组各15头,B圈Ⅰ组、Ⅱ组各12头,C圈Ⅰ组、Ⅱ组各11 头,D 圈Ⅰ组、Ⅱ组各14 头,E 圈Ⅰ组、Ⅱ组各8 头),试验期间饲喂不含任何药物成分的饲料,自由采食和饮水;圈舍清扫、消毒按猪场常规进行。试验期11 d。
试验开始时,对每头试验猪进行临床检查、采集鼻拭子和称重后给药治疗。Ⅰ组猪给予受试药,Ⅱ组猪给予对照药,给药剂量均为2.5 mg/kg 体重(1 mL/40 kg 体重),均只用药1次,在耳后侧中部进行肌内注射(当注射剂量超过2 mL时需分点注射)。
试验期间允许使用的药物种类:针对病毒的疫苗、抗寄生虫药物、改善消化功能的药物;不允许使用的药物种类:全身性使用的抗菌药或抗炎药、针对试验药物目标病原(APP、PM、HPS等)的疫苗。
1.3 测定指标及方法
1.3.1 体温、呼吸及状态
试验期间每日在固定时间对试验猪进行临床检查,包括测量体温(肛温)并参考文献[14]进行呼吸和状态评分,评估标准见表1。

表1 试验猪呼吸和状态评估标准Tab.1 Criteria for respiratory and state assessment of the experimental pigs
1.3.2 病原菌检出率
给药前采集所有试验病猪的鼻拭子;试验期间,若试验猪出现死亡,采集其肺部病料;试验结束前,采集所有未退出试验病猪的鼻拭子。上述采集样品置于保温箱保存(2~8 ℃)送至实验室检测。使用含牛血清(体积分数5%)和NAD(10 mg/L)的TSA 培养基分离呼吸道疾病相关病原菌;挑取可疑菌落染色镜检后,转接至含牛血清(体积分数5%)和NAD(10 mg/L)的TSB 培养基进行纯培养;参考文献[15]设计APP、PM、HPS 等相关病原菌的特异性引物进行PCR鉴定纯化菌株。若无PCR扩增产物,则参照文献[16]设计细菌16S rRNA基因的通用引物进行PCR,获得相关目的片段后进行测序鉴定。
1.3.3 死亡率
统计试验期间两组试验猪的死亡数,计算死亡率。
1.3.4 治疗效果
自试验开始时临床检查至给药后临床检查前的阶段内,若试验病猪发生死亡,不应判为治疗无效。试验第1~第9 d,每日临床检查若发现试验猪的状态评分为3或呼吸评分为3,且伴有直肠温度≥40.0 ℃,则判定为治疗无效,并进行安乐死剖检;若试验猪出现严重的非呼吸道疾病需要使用其他抗菌药物或抗炎药物进行治疗,则退出试验(需采集鼻拭子)且判定为治疗无效。
试验结束时,对所有未退出试验病猪进行临床检查,采集鼻拭子并称重后结束试验。若发现试验猪的状态评分=3 或呼吸评分=3,且伴有直肠温度≥40.0 ℃,则判定为治疗无效,并进行安乐死剖检;若试验猪出现严重的非呼吸道疾病要使用其他抗菌药物或抗炎药物进行治疗,则判定为呼吸道治疗无效。试验结束时,未退出试验的病猪体温正常(肛温38.0~39.5 ℃)且呼吸道疾病症状消失(状态评分和呼吸评分均为0),则视为治愈;未退出试验的病猪经判断为治愈或体温趋于正常(肛温<40.0 ℃)且呼吸道疾病症状有好转(状态评分和呼吸评分均<2),则视为治疗有效。记录相关数据并计算治愈率、有效率、无效率等。
1.3.5 不良反应发生情况
试验期间记录试验病猪出现的其他任何不良反应(如呼吸急剧加快、心跳明显升高、可视黏膜水肿、呕吐、腹泻等)及发生的不良事件。若有其他不良反应发生需进行全面诊断,预期不良反应后果,评估不良反应与试验药物之间的因果关系,采取处置措施(如给予紧急治疗)等。
同时观察试验病猪注射部位是否存在异常反应(如水肿、硬结、蜂窝织炎、血肿、脓肿、坏死等),若同一病猪有多个注射部位,仅记录最严重的反应。
1.4 数据统计与分析
采用SPSS 软件进行数据分析。两组试验猪的体温、呼吸评分、状态评分等数据采用T 检验进行比较,结果以“平均值±标准差”表示;两组试验猪的治愈率、有效率、无效率、死亡率、病原菌检出率等采用卡方检验进行比较。P<0.05表示差异显著。
2 结果与分析
2.1 试验期间猪体温与呼吸、状态评分变化情况(见表1~表3)
由表1 可知,试验第1 d,Ⅰ组和Ⅱ组猪平均体温均高于40 ℃;试验第2 d,两组猪的体温均降至40 ℃以下,与试验第1 d相比显著降低(P<0.05);试验第3 d,两组猪的体温均降至39.5 ℃以下,之后一直处于正常范围(38.0~39.5 ℃)。试验第1、2、6、8、9、10 d,两组猪的平均体温差异均不显著(P>0.05);试验第3、4、5、11 d,Ⅰ组猪平均体温均显著高于Ⅱ组(P<0.05)。

表1 试验期间猪体温变化情况Tab.1 Temperature changes of the pigs during the experiment 单位:℃
由表2 可知,试验第1 d,Ⅰ组和Ⅱ组猪的平均呼吸评分均高于2;试验第2 d,两组猪的平均呼吸评分均低于2,与试验第1 d相比显著降低(P<0.05);试验第3~第11 d,两组猪的平均呼吸评分均呈持续下降趋势,其中试验第5 d的平均呼吸评分为0.9,试验第11 d 的平均呼吸评分仅为0.1(仅个别患病猪存在轻度呼吸异常)。试验期间两组猪的呼吸评分差异均不显著(P>0.05)。

表2 试验期间猪呼吸评分变化情况Tab.2 Respiratory scores changes of the pigs during the experiment
由表3 可知,试验第1 d,Ⅰ组和Ⅱ组猪状态评分均高于2;试验第2 d,两组猪状态评分均低于2,与试验第1 d相比显著降低(P<0.05);试验第3~第11 d,两组猪的状态评分均呈持续下降趋势,其中试验第6 d 的状态评分为0.8,试验第11 d 的状态评分仅为0.2(仅少数患病猪仍存在轻微状态异常)。试验期间两组猪的状态评分差异均不显著(P>0.05)。
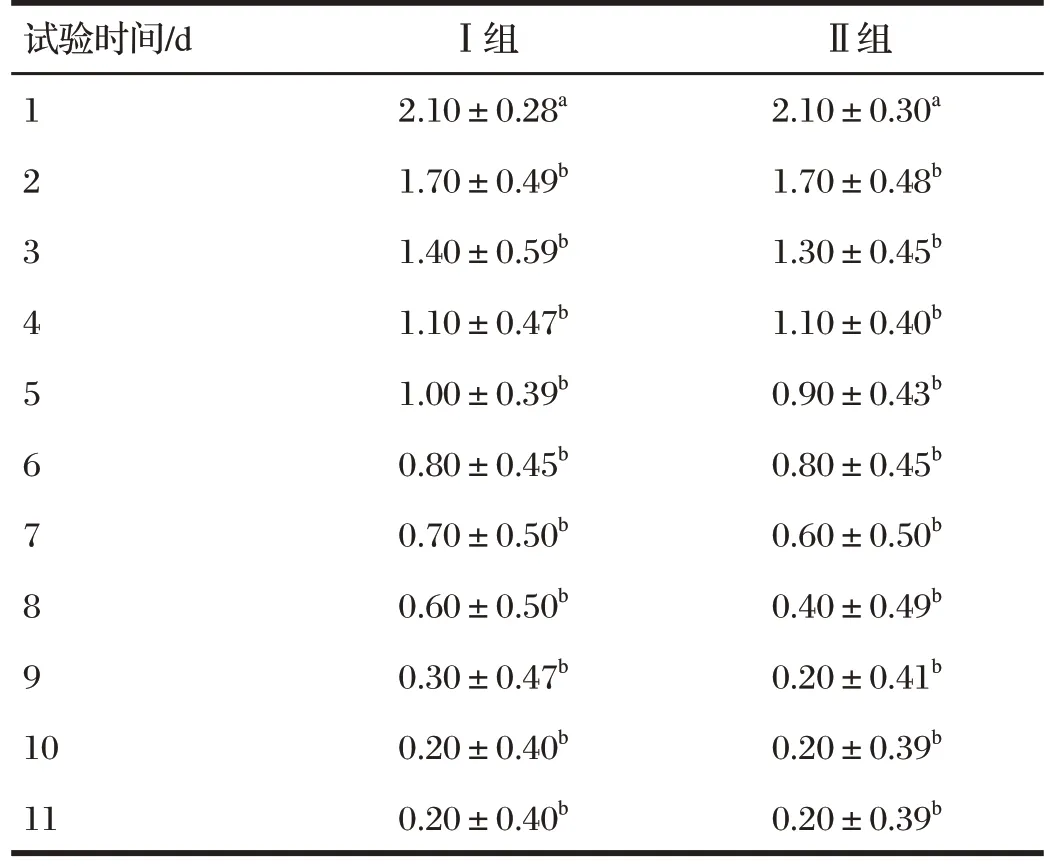
表3 试验期间猪状态评分变化情况Tab.3 Status scores changes of the pigs during the experiment
2.2 试验期间猪鼻拭子呼吸道疾病病原菌检出率(见表4)
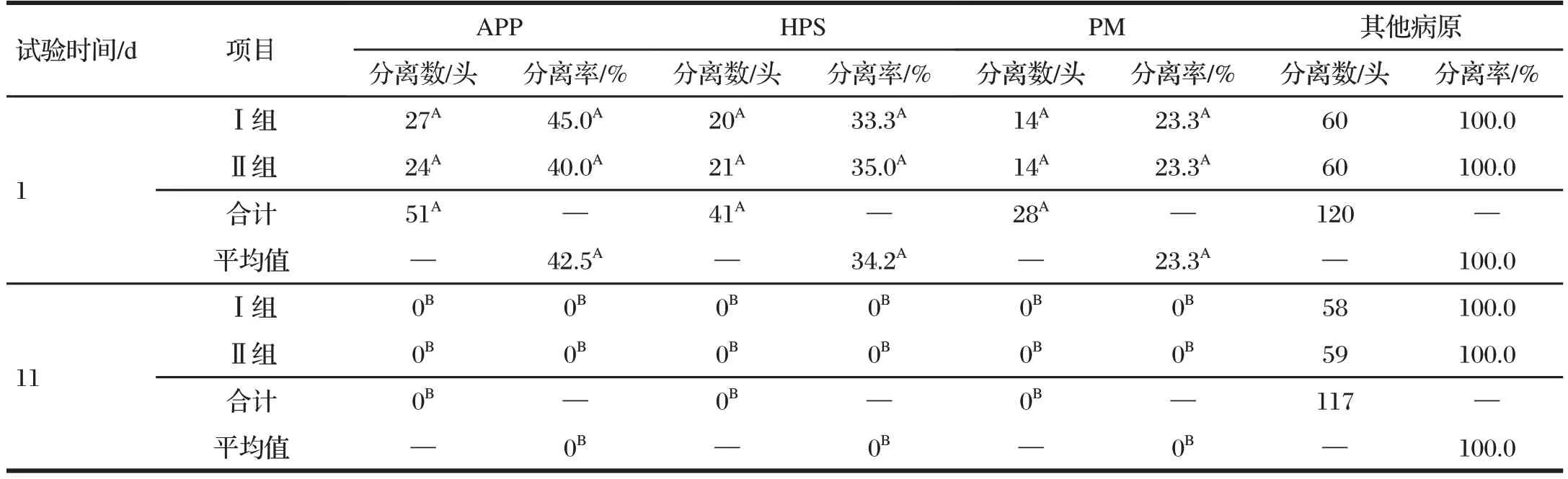
表4 试验期间猪鼻拭子呼吸道疾病病原菌检出率Tab.4 Detection rate of respiratory pathogens in the pig nose swabs during the experiment
由表4 可知,试验第1 d,120 头病猪中有51 头的鼻拭子分离出APP,分离率为42.5%;有41 头的鼻拭子分离出HPS,分离率为34.2%;有28 头的鼻拭子分离出PM,分离率为23.3%。除上述3 种病原菌外,从病猪鼻拭子中还分离出1~3种其他细菌,包括链球菌、葡萄球菌、肠球菌、大肠杆菌、克雷伯菌、支气管败血波氏杆菌、不动杆菌等,分离率为100%。分别比较Ⅰ组和Ⅱ组APP、HPS、PM 的分离率,差异均不显著(P>0.05),两组猪分离的其他细菌种类也较一致。试验第11 d时,所有未退出试验猪的鼻拭子均未分离出APP、HPS、PM,也未分离出链球菌和支气管败血波氏杆菌,但仍可分离出葡萄球菌、肠球菌、大肠杆菌、无雷伯菌、不动杆菌等。两组猪分离的细菌种类仍较一致。
2.3 治疗期间试验猪死亡率
统计试验期间两组猪的死亡情况,结果显示,Ⅰ组有2 头猪死亡,死亡率为3.3%(2/60);Ⅱ组有1 头猪死亡,死亡率为1.7%(1/60)。两组猪的死亡率无明显差异。
死亡猪生前均持续存在低热、呼吸困难、状态较差等临床表现。对3头死亡猪进行剖检,病理变化均集中在胸腔,主要表现为胸腔积液,肺充血、出血、局灶性坏死、肝变,肺表面附有纤维蛋白,肺与胸膜粘连等。采集3头死亡猪的病料(肺组织)进行病原菌分离鉴定,2 头病死猪分离出克雷伯菌,1头病死猪分离出不动杆菌。
2.4 试验猪的治愈率、有效率和无效率(见表5)

表5 试验猪的治愈率、有效率和无效率Tab.5 Cure rate, efficiency and inefficiency of the experimental pigs 单位:%
由表5可知,Ⅰ组猪的治愈率、有效率、无效率分别为75.0%、96.7%、3.4%;Ⅱ组猪的治愈率、有效率、无效率分别为78.3%、98.3%、1.7%。两组病猪的治愈率、有效率、无效率差异均不显著(P>0.05)。
2.5 试验猪不良反应发生情况
所有试验猪用药后,注射部位均未见疼痛表现,也未出现水肿、硬结、蜂窝织炎、血肿、脓肿、坏死等异常反应,更未出现过敏体征(如呼吸急剧加快、心跳明显升高、可视黏膜水肿、呕吐、腹泻等)。试验期间,Ⅰ组有2头猪死亡、Ⅱ组有1头猪死亡。对死亡猪进行剖检发现,病死猪均存在典型呼吸道疾病病变,而且从肺组织中分离出致病菌,故推测为呼吸道疾病引起猪死亡,与药物不良反应无关。
3 讨论
猪呼吸道疾病的病因复杂,可由多种病原感染引起。在做好相关病毒、支原体感染免疫预防前提下,由于气候变化等原因造成猪体抵抗力下降,其鼻腔定植的APP、HPS、PM等病原菌可侵染下呼吸道引起猪呼吸道疾病[17]。泰拉霉素注射液对自然感染呼吸道疾病的患病猪具有良好的治疗效果[18]。按2.5 mg/kg 体重剂量单次肌内注射泰拉霉素注射液,用药后试验猪鼻腔定植的APP、HPS、PM等病原菌可被清除,发热、呼吸困难、精神沉郁、食欲不振等症状可获得快速、持续改善直至消除,用药后第10 d 试验猪的治愈率超过75%,有效率超过95%。此外,泰拉霉素注射液用于治疗呼吸道疾病的患病猪较安全。本试验按2.5 mg/kg 体重剂量单次肌内注射泰拉霉素注射液,试验猪注射部位未出现疼痛、水肿、坏死等刺激性反应,也未见其他过敏体征,与前人文献报道一致[19]。
4 结论
本研究表明,泰拉霉素注射液用于治疗猪呼吸道疾病安全、有效,临床中可推广应用,推荐用法为肌内注射,剂量为2.5 mg/kg(以泰拉霉素计,相当于1 mL/40 kg体重)。
