lncRNA CASC11靶向调控miR-146a-3p对结肠癌细胞增殖、侵袭的影响*
2024-01-09廖薇薇傅祥炜温必盛杨维忠
廖薇薇, 傅祥炜, 温必盛, 杨维忠△
海南医学院第二附属医院 1消化内镜科 2普通外科,海口 570311
结肠癌是起源于结肠黏膜的消化系统恶性肿瘤,好发于乙状结肠,在我国发病率较高,患者的5年生存率约65%。结肠癌细胞易发生转移,其中淋巴转移常见,血行转移以经门静脉至肝最多见,也可直接蔓延侵犯邻近的组织和器官,造成患者生存率进一步降低。因此抑制结肠癌生长并抑制癌细胞转移,是提高患者生存率的关键[1-2]。癌症易感候选基因11(cancer susceptibility candidate 11,CASC11)作为一种新近发现的长链非编码RNA(long noncoding RNA,lncRNA),在肝癌、胃癌、结直肠癌、卵巢癌等多种癌症中发挥着重要的调控作用。以往研究表明,下调CASC11表达可抑制肝癌细胞的糖代谢、增殖和迁移[3-4];CASC11的高表达与宫颈癌患者的远期生存率呈负相关,对宫颈癌的进展起促进作用,沉默CASC11可以抑制宫颈癌细胞的迁移和侵袭,并减慢其肿瘤生长速度[5]。而microRNA-146a-3p(miR-146a-3p)是能够抑制肿瘤生长转移的一种抑癌因子,有研究显示,过表达miR-146a-3p可抑制膀胱癌细胞的侵袭、转移和生长,并诱导癌细胞衰老[6]。另有研究显示,非小细胞肺癌癌变组织中miR-146a的表达显著降低,部分变异基因型如SNP rs2910164可以促进miR-146a的表达,进而上调miR-146a-3p,降低非小细胞肺癌转移的风险[7]。持续或频繁的结肠炎症是导致结直肠癌的重要因素,通过对坏死性小肠结肠炎及克罗恩病的研究发现,给予miR-146a模拟物能改善结直肠的致瘤性炎症[8-9]。通过以上我们推测,miR-146a-3p可作为结肠癌潜在的治疗靶点。通过对Lncbase V.2数据库[10]检索可知,lncRNA CASC11与miR-146a-3p之间存在潜在的结合位点,因此推想lncRNA CASC11可能通过对miR-146a-3p的靶向下调来影响结肠癌细胞的增殖及侵袭。本研究通过对体外培养的SW620细胞进行lncRNA CASC11的表达调节,对此猜想进行验证。
1 材料与方法
1.1 材料与仪器
实验所用人结肠黏膜上皮细胞、人结肠癌组织源细胞及HCT116、SW620、SW480细胞系,以及细胞培养所用胎牛血清(FBS)、胰酶、双抗、培养液等购自武汉普诺赛生命科技有限公司;lncRNA CASC11 siRNA、lncRNA CASC11 inhibitor阴性对照、miR-146a-3p inhibitor、lncRNA CASC11空载质粒、lncRNA CASC11过表达质粒、miR-146a-3p 3′-UTR无义序列、野生型miR-146a-3p 3′-UTR报告质粒、突变型miR-146a-3p 3′-UTR报告质粒、相关引物、反转录荧光定量试剂盒、Trizol试剂均购自上海生工生物工程股份有限公司;EdU细胞增殖检测试剂盒、基底胶、LipofectamineTM2000、MTT试剂盒、结晶紫染色液、兔源抗人Bax抗体、小鼠源抗人Bcl-2抗体、双荧光素酶报告基因检测试剂盒均购自北京索莱宝科技有限公司;SDS-PAGE凝胶、5%抗体封闭液、小鼠抗人Vimentin及E-cadherin抗体、Alexa Fluor488标记的山羊抗小鼠二抗、Alexa Fluor 555标记的驴抗兔二抗、辣根酶标记多克隆二抗均购自上海碧云天生物技术有限公司。
仪器:M200 PRO型全波长自动酶标仪(Tecan公司,瑞士);FSX100型倒置荧光双目显微镜、AE2000型倒置光学显微镜(奥林巴斯公司,日本);CFX96型荧光定量PCR仪(BIO-RAD公司,美国);ABI 7500型实时荧光定量PCR系统(Applied Biosystems公司,美国)等。
1.2 实时荧光定量PCR(real-time fluorescence quantitative PCR,qRT-PCR)
细胞培养:37℃水浴解冻细胞后离心,以含有10% FBS和1%双抗的完全培养液重悬细胞,然后分别接种在培养瓶中于37.5℃、5% CO2无菌培养箱中培养,细胞长至95%汇合度时进行传代。
使用Trizol试剂分别提取人结肠黏膜上皮细胞、人结肠癌组织源细胞及人结肠癌细胞株HCT116、SW620、SW480中的总RNA,通过一步法反转录荧光定量试剂盒进行定量PCR,选取GAPDH作为lncRNA CASC11的内参,U6作为miR-146a-3p的内参,配制20 μL反应体系,反应程序设定:50℃ 5 min,95℃ 3 min,95℃ 10 s,60℃ 30 s,共40个循环。通过2-ΔΔCt法计算lncRNA CASC11、miR-146a-3p的相对表达量,引物序列见表1。

表1 引物序列
1.3 蛋白免疫印迹(Western blot)实验
将细胞置于冰上研磨,使用RIPA提取细胞总蛋白。蛋白上样量为20 μg,使用10%的SDS-PAGE凝胶电泳并转移到PVDF膜上。5%BSA封闭,一抗(1∶1000)4℃摇床孵育过夜。第二天室温孵育二抗(1∶5000)1 h。ECL显色液显影。
1.4 SW620细胞转染
将传代后的SW620细胞接种在无菌12孔板中,随机分为空白对照组(未处理组)、lncRNA CASC11 siRNA组、lncRNA CASC11 siRNA阴性对照组及lncRNA CASC11 siRNA+miR-146a-3p inhibitor共转染组(miR-146a-3p抑制组),培养12 h后更换为Opti-MEMⅠ培养液,使用LipofectamineTM2000对细胞进行转染,lncRNA CASC11 siRNA组与lncRNA CASC11 siRNA阴性对照组分别转染lncRNA CASC11 siRNA及其阴性对照,miR-146a-3p抑制组转染lncRNA CASC11 siRNA与miR-146a-3p inhibitor,6 h后更换为完全培养液,继续培养24 h后收集细胞备用。
1.5 检测SW620细胞增殖
MTT法:将SW620细胞接种在无菌96孔板中分组处理,每组设6个重复孔。转染24 h后更换为50 μL含MTT的培养液,并继续培养4.5 h后吸出,保留底部结晶,加入150 μL二甲基亚砜充分溶解结晶,于酶标仪490 nm波长下测量各孔吸光度值,计算细胞活力(%)=(转染组吸光度值-空白对照组吸光度值)/(对照组吸光度值-空白对照组吸光度值)×100%。
EdU法:将分组处理的SW620细胞接种在无菌的12孔板,加入50 μmol/L EdU溶液继续培养2 h后吸出,PBS洗涤细胞,加入4%多聚甲醛溶液固定后,参照EdU细胞增殖检测试剂盒说明于荧光显微镜下观察并拍照,所得图像运用Image J软件进行计数,得出EdU阳性率=EdU阳性细胞数/总细胞数×100%。
1.6 检测SW620细胞侵袭能力
通过Transwell小室检测细胞侵袭。将1.4中收集的各组SW620细胞调整至相同密度后分组接种在含FBS的完全培养液的上室中培养,在下室中加入不含血清的Leibovitz’s L-15培养液,培养24 h后弃去下室培养液,PBS洗涤后,用4%多聚甲醛溶液固定,结晶紫染色液染色,于光学显微镜下观察、拍照、计数着色细胞。
1.7 检测SW620细胞凋亡蛋白表达
将传代后的SW620细胞接种在预先置入爬片的无菌12孔板中,培养、分组及转染方法同1.4。24 h后取出爬片,经漂洗、固定、通透、封闭后,进行一抗孵育,兔源抗人Bax抗体(1∶200)和小鼠源抗人Bcl-2抗体(1∶100)4℃孵育过夜;第2天PBS漂洗爬片后以Alexa Fluor 488标记的山羊抗小鼠二抗及Alexa Fluor 555标记的驴抗兔二抗室温避光孵育10 min,染核后封片。每张爬片随机采集3个视野,Image J软件对每个视野Bax、Bcl-2蛋白的平均荧光强度进行定量后取均值,并计算Bax/Bcl-2比值(Bax蛋白的平均荧光强度/Bcl-2蛋白的平均荧光强度)。
1.8 检测SW620细胞lncRNA CASC11、miR-146a-3p及上皮间质转化标志Vimentin、E-cadherin mRNA及蛋白表达量
提取1.4中各组细胞总RNA,通过qRT-PCR检测各组细胞中lncRNA CASC11、miR-146a-3p表达量。通过Western blot检测Vimentin、E-cadherin的蛋白表达量。选择GAPDH作为Vimentin、E-cadherin的内参基因。各基因引物序列见表1。
1.9 检测SW620细胞中lncRNA CASC11对miR-146a-3p的靶向调控
将传代后的SW620细胞接种于无菌12孔板,37.5℃、5%CO2培养12 h后随机分为miR-146a-3p无义序列+lncRNA CASC11空载组、miR-146a-3p无义序列+lncRNA CASC11过表达组、野生型miR-146a-3p+lncRNA CASC11空载组、野生型miR-146a-3p+lncRNA CASC11过表达组、突变型miR-146a-3p+lncRNA CASC11空载组、突变型miR-146a-3p+lncRNA CASC11过表达组,按照1.4中方法分别对各组细胞进行相应转染处理,24 h后收集各组细胞,参照双荧光素酶报告基因检测试剂盒说明检测各组细胞双荧光素酶的相对活性。
1.10 统计学方法

2 结果
2.1 lncRNA CASC11和miR-146a-3p在结肠癌细胞中的表达
与人结肠黏膜上皮细胞相比,人结肠癌组织源细胞和人结肠癌细胞株HCT116、SW480、SW620中lncRNA CASC11表达量明显升高(均P<0.05),而miR-146a-3p表达量明显降低(均P<0.05)(图1)。

1:人结肠黏膜上皮细胞;2:人结肠癌组织源细胞;3:HCT116;4:SW480;5:SW620;A:lncRNA CASC11表达水平;B:miR-146a-3p表达水平;*P<0.05
2.2 lncRNA CASC11调控SW620细胞增殖
与空白对照组相比,lncRNA CASC11 siRNA组细胞活力、EdU阳性率均降低(均P<0.05),lncRNA CASC11 siRNA阴性对照组细胞活力、Edu阳性率均无显著变化(均P>0.05);与lncRNA CASC11 siRNA组相比,共转染组细胞活力、EdU阳性率均升高(均P<0.05)(图2)。

1:空白对照组;2:lncRNA CASC11 siRNA组;3:lncRNA CASC11 siRNA阴性对照组;4共转染组;A:EdU染色代表性图;B:MTT法检测细胞活力;C:EdU阳性细胞比例;*P<0.05
2.3 lncRNA CASC11调控SW620细胞侵袭能力
与空白对照组相比,lncRNA CASC11 siRNA组侵袭细胞数明显减少(P<0.05),lncRNA CASC11 siRNA阴性对照组侵袭细胞数无显著差异(P>0.05);与lncRNA CASC11 siRNA组相比,共转染组侵袭细胞数升高(P<0.05)(图3)。

1:空白对照组;2:lncRNA CASC11 siRNA组;3:lncRNA CASC11 siRNA阴性对照组;4共转染组;A:细胞侵袭实验结果代表图;B:侵袭细胞数目;*P<0.05
2.4 lncRNA CASC11调控SW620细胞中凋亡蛋白Bcl-2、Bax表达
与空白对照组相比,lncRNA CASC11 siRNA组细胞Bax/Bcl-2比值升高(P<0.05),lncRNA CASC11 siRNA阴性对照组Bax/Bcl-2比值无显著差异(P>0.05);与lncRNA CASC11 siRNA组相比,共转染组细胞Bax/Bcl-2比值有所降低(P<0.05)(图4)。
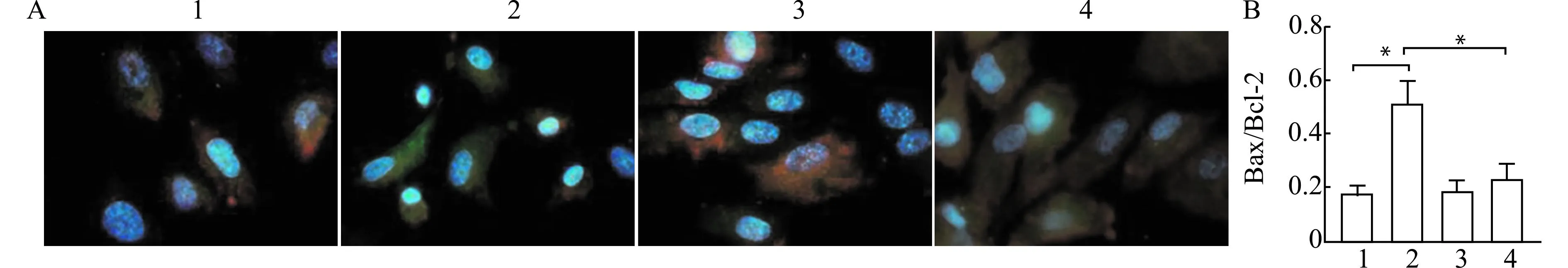
1:空白对照组;2:lncRNA CASC11 siRNA组;3:lncRNA CASC11 siRNA阴性对照组;4共转染组;A:Bax/Bcl-2免疫荧光染色代表图;B:Bax/Bcl-2荧光强度比值;*P<0.05
2.5 lncRNA CASC11调控SW620细胞中miR-146a-3p和上皮间质转化标志基因的表达
与空白对照组相比,lncRNA CASC11 siRNA组细胞Vimentin蛋白表达水平明显降低(P<0.05),miR-146a-3p及E-cadherin表达均升高(均P<0.05),而lncRNA CASC11 siRNA阴性对照组miR-146a-3p与Vimentin、E-cadherin表达无显著差异(均P>0.05);与lncRNA CASC11 siRNA组相比,共转染组细胞Vimentin表达升高(P<0.05),miR-146a-3p及E-cadherin表达均降低(P<0.05)见图5。

1:空白对照组;2:lncRNA CASC11 siRNA组;3:lncRNA CASC11 siRNA阴性对照组;4:共转染组;A:miR-146a-3p mRNA表达水平;B:E-cadherin蛋白表达水平;C:Vimentin蛋白表达水平;*P<0.05
2.6 lncRNA CASC11靶向调控SW620细胞中miR-146a-3p的表达
通过Lncbase V.2预测到lncRNA CASC11与miR-146a-3p之间可能存在结合位点(图6A)。与野生型miR-146a-3p+lncRNA CASC11空载组相比,野生型miR-146a-3p+lncRNA CASC11过表达组相对荧光素酶活性显著降低(P<0.05)(图6B);而miR-146a-3p无义序列+lncRNA CASC11空载组、miR-146a-3p无义序列+lncRNA CASC11过表达组、突变型miR-146a-3p+lncRNA CASC11空载组、突变型miR-146a-3p+lncRNA CASC11过表达组之间相对荧光素酶活性无显著差异(均P>0.05)(图6B)。

A:miR-146a-3p与CASC11结合位点;B:相对荧光素酶报告基因活性;a:miR-146a-3p无义序列+lncRNA CASC11空载组;b:miR-146a-3p无义序列+lncRNA CASC11过表达组;c:野生型miR-146a-3p+lncRNA CASC11空载组;d:野生型miR-146a-3p+lncRNA CASC11过表达组;e:突变型miR-146a-3p+lncRNA CASC11空载组;f:突变型miR-146a-3p+lncRNA CASC11过表达组;*P<0.05
2.7 lncRNA CASC11调控SW620细胞中miR-146a-3p的下游靶基因c-Met的表达
Bleau等[11]研究发现在结肠癌细胞中,c-Met是miR-146a的靶蛋白。因此,我们采用qRT-PCR和Western blot实验进一步验证lncRNA CASC11对miR-146a-3p下游靶基因c-Met的调控作用。实验结果发现,与对照组相比较,过表达lncRNA CASC11可以显著上调c-Met的mRNA和蛋白表达,反之,敲低lncRNA CASC11可以显著下调c-Met的mRNA和蛋白表达(图7)。
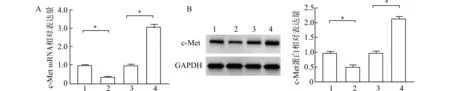
1:siRNA阴性对照组;2:lncRNA CASC11 siRNA组;3:对照组;4 lncRNA CASC11过表达组;A:c-Met的mRNA表达水平;B:c-Met的蛋白表达水平;*P<0.05
3 讨论
近年来,我国结肠癌患病人数不断增加,并且呈现年轻化趋势。手术、放疗及化疗是结肠癌诊疗指南中的常规治疗手段,但结肠癌患者死亡率仍居高不下。因此,探究结肠癌的潜在致病机制和癌细胞的生物学行为及其影响因素,对于探索新型结肠癌治疗策略的意义重大[12-13]。CASC11作为一种在多种癌症中均有过报道存在过表达的lncRNA,研究报道其对大多数类型肿瘤的生长及转移起到促进作用,敲除CASC11可抑制包括前列腺癌在内的多种癌细胞的增殖、侵袭和迁移[14-15]。另有研究证实,CASC11在结直肠癌中异常高表达[16],因此CASC11有可能成为结直肠癌的潜在治疗靶点。我们的研究结果显示,与人正常结肠黏膜上皮细胞相比,人结肠癌组织源细胞和人结肠癌细胞株HCT116、SW480、SW620中lncRNA CASC11表达明显升高。lncRNA CASC11沉默后的SW620细胞,细胞活力和EdU染色阳性率明显降低;而对Bax/Bcl-2比值及E-cadherin、Vimentin的表达及细胞侵袭能力的调控作用,表明lncRNA CASC11还能够介导结肠癌的凋亡及转移过程。Zhang等[17]研究发现lncRNA CASC11通过与miR-646及miR-381-3p结合并促进结直肠癌的恶性进展,并在机制上明确了RAB11 FIP2是miR-646和miR-381-3p的共同靶蛋白。本研究丰富了lncRNA CASC11在结直肠癌中作用的机制,我们发现lncRNA CASC11可通过抑制miR-381-3p的表达进而抑制凋亡相关蛋白的表达,并最终诱导上皮间质转化相关基因的表达,促进c-Met的mRNA和蛋白表达,从而影响结直肠癌的增殖与侵袭。
除此之外,我们知道炎症是结肠癌的重要致病因素[18]。以往有研究报道,miR-146a-3p在结肠炎患儿肠道中的表达明显下调,证实其低表达可能与结肠炎的发生有关[8];除此之外,下调miR-146a-3p还能够显著提高前列腺癌细胞的存活率及癌细胞对雄激素剥夺疗法的抵抗性[19];促进miR-146a表达可反应性升高miR-146a-3p的表达水平,可以降低肺癌、鼻咽癌的基因易感性[7,20]。而miR-146a作为一种已知的肿瘤抑制因子,不仅具有抗炎作用,还能够促进白血病病变细胞凋亡,减缓白血病进展[21],由此推测miR-146a-3p也可以作为结肠癌的潜在治疗靶点。我们通过Lncbase V.2数据库查询到lncRNA CASC11与miR-146a-3p之间有潜在的结合位点,因而推测通过敲减lncRNA CASC11表达来抑制结肠癌细胞增殖及侵袭的作用可能是通过下调下游miR-146a-3p实现的。本研究通过拯救实验对此猜想进行验证,结果证实相比lncRNA CASC11 siRNA组的SW620细胞,miR-146a-3p抑制组(共转染组)的SW620细胞活力、EdU染色阳性率、侵袭细胞数、细胞Vimentin表达均升高,而Bax/Bcl-2比值、miR-146a-3p及E-cadherin表达均降低,证实miR-146a-3p inhibitor能够减弱通过敲减CASC11对结肠癌细胞产生的增殖侵袭的抑制作用。且双荧光素酶报告基因检测证实SW620细胞中lncRNA CASC11可靶向降低miR-146a-3p的表达,提示CASC11能够通过靶向下调miR-146a-3p的表达参与结肠癌的生长和转移过程,而沉默CASC11后miR-146a-3p的表达增加,结肠癌细胞的增殖及侵袭活力降低。
综上所述,本研究证实了lncRNA CASC11在人结肠癌细胞中高表达,lncRNA CASC11可通过靶向下调miR-146a-3p调控结肠癌细胞的增殖及转移,敲低CASC11可显著降低结肠癌细胞的增殖及侵袭,促进其凋亡。本研究为寻求结肠癌新的临床诊疗手段提供了思路。
