水飞蓟宾对宫颈癌HeLa细胞增殖和侵袭能力的影响及机制研究*
2024-01-09付晴晴刘婷婷易念华
付晴晴, 刘婷婷, 易念华
湖北省妇幼保健院妇女保健科,武汉 430070
宫颈癌是仅次于乳腺癌和结直肠癌的全球第3大女性恶性肿瘤,主要由持续性人乳头瘤病毒感染引起[1]。目前宫颈癌的治疗包括化疗、手术和放疗,其中以顺铂为基础的联合治疗是晚期宫颈癌最常用的化疗方案[2]。研究发现,多种天然产物对宫颈癌具有较好的疗效,其作用机制包括诱导细胞凋亡、抑制血管生成、抑制转移、降低耐药性和调节miRNAs等,天然产物可能是新型抗癌药物的主要候选者[3]。水飞蓟宾是从菊科草本植物水飞蓟的种子中提取出来的黄酮木质素类化合物,具有抗肿瘤、抑菌、保护心血管等药理活性[4]。研究显示,水飞蓟宾对人宫颈癌细胞的增殖具有明显的抑制作用,其可诱导宫颈癌细胞凋亡,进而抑制宫颈癌裸鼠移植瘤的生长[5-6]。但关于水飞蓟宾影响宫颈癌细胞侵袭能力的作用及机制尚未完全明确。细胞外信号调节激酶(extracellular signal-regulated kinase,ERK)/丝裂原活化蛋白激酶(mitogen activated protein kinase,MAPK)信号通路参与了宫颈癌的进展[7],抑制ERK/MAPK信号通路可阻断宫颈癌细胞的迁移、自噬与上皮间质转化,促进细胞凋亡[8]。为了探究水飞蓟宾是否能通过调控ERK/MAPK信号通路影响宫颈癌细胞的侵袭能力,本研究采用不同浓度水飞蓟宾干预宫颈癌细胞,检测其增殖、侵袭能力以及ERK/MAPK信号通路蛋白表达变化,以期为宫颈癌抗癌药物研发提供一定的数据资料。
1 材料与方法
1.1 细胞与试剂
人宫颈癌细胞HeLa源自中科院细胞库。主要试剂:MEM培养液、胎牛血清购自Gibco公司(货号:c11095500bt、10270-106),PBS、0.25%胰蛋白酶、CCK-8、结晶紫染液购自Solarbio公司(货号:P1010、T1350、CA1210、C8470),水飞蓟宾购自阿拉丁公司(货号:S109808;纯度:98%),顺铂、甲醛、氯仿、异丙醇、无水乙醇购自国药集团化学试剂有限公司(货号:SP439401、10010018、10006818、80109218、10009218),ERK1/2信号抑制剂PD98059、p38 MAPK抑制剂SB202190购自美国MCE公司(货号:HY-12028、HY-10295),Matrigel胶购自BD公司(货号:354230),Trizol购自Ambion公司(货号:15596026),反转录试剂盒购自TaKaRa公司(货号:2690A),SYBR FAST qPCR Master Mix购自KAPA Biosystems公司(货号:KM4101),兔抗基质金属蛋白酶-2(matrix metalloproteinase-2,MMP-2)抗体、兔抗MMP-9抗体、兔抗ERK1/2抗体、兔抗p38抗体、兔抗GAPDH抗体购自Bioswamp公司(货号:PAB30618、PAB30102、PAB43936、PAB38871、PAB36269),兔抗p-ERK1/2抗体、兔抗p-p38抗体购自Abcom公司(货号:ab184699、ab195049)。
1.2 CCK-8法检测细胞增殖
将HeLa细胞复苏后培养于含10%胎牛血清的MEM中,调整细胞密度,接种于96孔板中,每孔3×103个细胞,100 μL,培养过夜,使细胞贴壁。采用0、25、50、100、200、400、800、1000 μmol/L水飞蓟宾处理细胞[9],继续培养24 h,取出细胞培养板,每孔加入10 μL CCK-8溶液,继续培养4 h。于酶标仪中检测450 nm处各孔的吸光度值(A),并计算细胞增殖率=(A药物孔-A空白孔)/(A对照孔-A空白孔)×100%。
1.3 细胞分组与处理
将HeLa细胞分为对照组、水飞蓟宾低剂量组(SB-L)、水飞蓟宾中剂量组(SB-M)、水飞蓟宾高剂量组(SB-H)、PD98059组、SB202190组、PD98059+SB组、SB202190+SB组和顺铂组。对照组细胞采用正常的培养液进行培养,低、中、高剂量组采用含有25、50、100 μmol/L水飞蓟宾的培养液进行培养,PD98059组采用含有30 μmol/L PD98059的培养液培养[10],SB202190组采用含有10 mmol/L PD98059的培养液培养[11],PD98059+SB组采用含有30 μmol/L PD98059和50 μmol/L水飞蓟宾的培养液培养,SB202190+SB组采用含有10 mmol/L PD98059和50 μmol/L水飞蓟宾的培养液培养,顺铂组作为阳性对照,采用含有10 μmol/L顺铂的培养液培养细胞[12],培养24 h后CCK-8检测细胞增殖。
1.4 Transwell法检测细胞侵袭
实验前24 h,对各组细胞进行血清饥饿处理,将细胞培养在不含血清的培养液中。将Transwell小室和24孔板在PBS中浸泡5 min,在Transwell小室中铺设80 μL Matrigel胶,静置30 min。收集各组细胞,采用含1%胎牛血清的培养液重悬细胞,调整细胞密度为1×105个细胞/mL,以0.5 mL细胞/小室的比例接种于Transwell小室中,在下层24孔板中加入0.75 mL含10%胎牛血清的培养液,在培养箱中培养48 h。弃去培养板中的培养液,PBS清洗,加入4%甲醛固定20 min。弃去固定液,PBS清洗,加入0.5%结晶紫溶液染色30 min。PBS清洗,晾干,擦去Transwell小室内没有侵袭的细胞,置于显微镜下观察各组细胞侵袭情况,并计数每个视野中的细胞数。
1.5 实时PCR检测MMP-2、MMP-9、ERK1/2和p38 mRNA表达水平
取1×106个细胞,加入1 mL Trizol裂解细胞,采用氯仿、异丙醇提取细胞总RNA,反转录合成cDNA。以cDNA为模板进行PCR扩增,引物序列为:MMP-2上游引物为5′-GCTTCCAGGGCACATCC-3′,下游引物为5′-TTGCGGTCATCATCGTAGTT-3′;MMP-9上游引物为5′-GTCCTCGCCCTGAACCTG-3′,下游引物为5′-GGCACAGTAGTGGCCGTAGA-3′;内参基因GAPDH上游引物为5′-GGGAAACTGTGGCGTGAT-3′,下游引物为5′-GAGTGGGTGTCGCTGTTGA-3′。以2-ΔΔCt法计算目的基因mRNA相对表达量。
1.6 Western blot检测MMP-2、MMP-9、p-ERK1/2和p-p38蛋白表达水平
取1×106个细胞,加入200 μL细胞裂解液于4 ℃中充分裂解细胞,提取细胞蛋白质。蛋白质定量后,沸水浴10 min使蛋白质变性,离心取上清,取20 μg蛋白上样,进行SDS-PAGE电泳分离。将蛋白转膜,采用5%脱脂奶粉室温封闭2 h。按比例稀释一抗(MMP-2、MMP-9、ERK1/2、p38、p-p38和GAPDH稀释比1∶1000,p-ERK1/2稀释比1∶10000),和膜室温孵育1 h。洗膜,加入二抗,室温孵育1 h。将膜转移至暗室中,滴加化学发光液,于全自动化学发光分析仪中检测,并读取蛋白条带灰度值。
1.7 统计学方法
本研究全部实验均进行3次重复,计量资料采用均数±标准差表示。采用SPSS 23.0进行统计学分析,多组间比较采用单因素方差分析,以P<0.05为差异具有统计学意义。
2 结果
2.1 水飞蓟宾抑制HeLa细胞增殖
结果见图1,随着水飞蓟宾干预浓度升高,宫颈癌HeLa细胞的增殖率逐渐降低。当水飞蓟宾浓度大于100 μmol/L时,细胞增殖率低于50%,在保证后续检测实验正常进行的前提下,并能探讨水飞蓟宾的量效关系,本研究采用25、50、100 μmol/L作为低、中、高剂量组水飞蓟宾的干预浓度。与对照组相比,其余组的细胞增殖率均显著降低(均P<0.05);与SB-M组相比,PD98059+SB组和SB202190+SB组细胞增殖率进一步降低(均P<0.05)。

A:不同浓度水飞蓟宾对HeLa细胞增殖率的影响;B:各组细胞增殖率的比较;与对照组比较,*P<0.05;与SB-M组比较,#P<0.05
2.2 水飞蓟宾抑制HeLa细胞侵袭
结果见图2,与对照组比较,其余各组的侵袭细胞数均显著减少(均P<0.05);与SB-M组相比,PD98059+SB组和SB202190+SB组侵袭细胞数进一步降低(均P<0.05)。
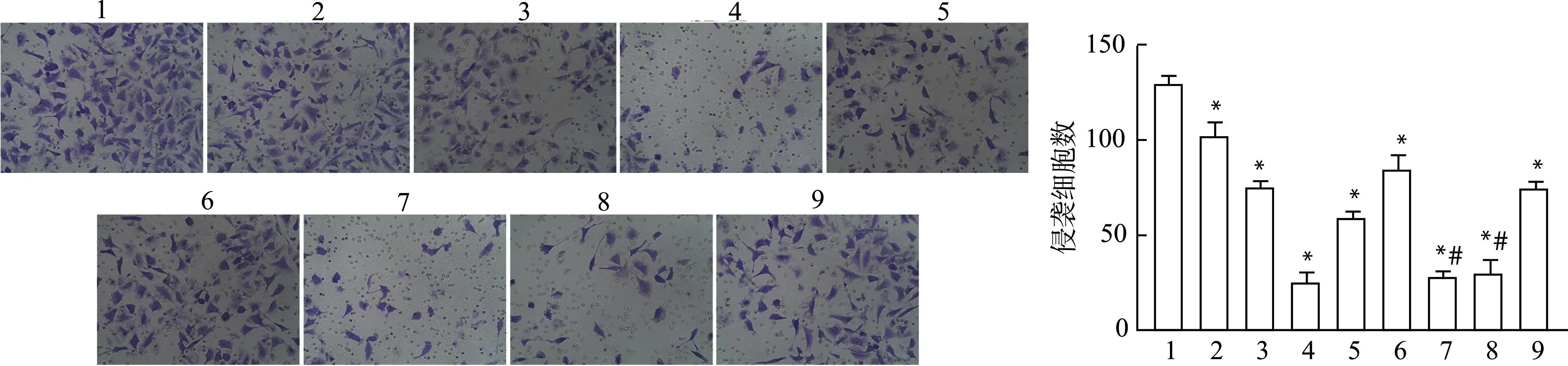
1:Control;2:SB-L;3:SB-M;4:SB-H;5:PD98059;6:SB202190;7:PD98059+SB;8:SB202190+SB;9:Cisplatin;与对照组比较,*P<0.05;与SB-M组比较,#P<0.05
2.3 水飞蓟宾抑制HeLa细胞中MMP-2、MMP-9、p-ERK1/2和p-p38 mRNA的表达
结果见图3,与对照组比较,除水飞蓟宾低剂量组外,其余各组HeLa细胞中MMP-2、MMP-9、ERK1/2和p38 mRNA表达量均显著减少(均P<0.05);与SB-M组比较,PD98059+SB组和SB202190+SB组HeLa细胞中MMP-2、MMP-9、ERK1/2和p38 mRNA表达量均显著减少(均P<0.05)。

1:Control;2:SB-L;3:SB-M;4:SB-H;5:PD98059;6:SB202190;7:PD98059+SB;8:SB202190+SB;9:Cisplatin;与对照组比较,*P<0.05;与SB-M组比较,#P<0.05
2.4 水飞蓟宾抑制HeLa细胞中MMP-2、MMP-9、p-ERK1/2和p-p38蛋白的表达
结果见图4,与对照组比较,除SB-L组外,其余各组HeLa细胞中MMP-2、MMP-9、p-ERK1/2和p-p38蛋白相对表达量均显著减少(均P<0.05);与SB-M组比较,PD98059+SB组和SB202190+SB组HeLa细胞中MMP-2、MMP-9、p-ERK1/2和p-p38蛋白相对表达量均显著减少(均P<0.05)。
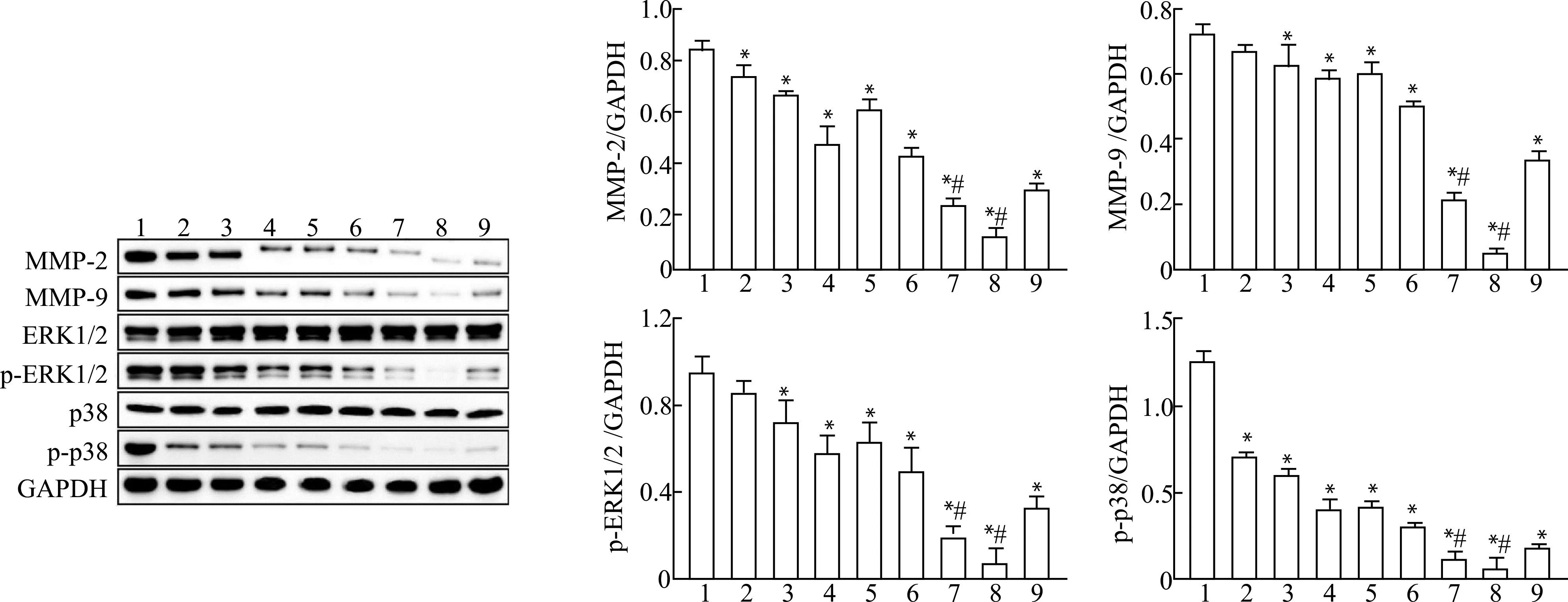
1:Control;2:SB-L;3:SB-M;4:SB-H;5:PD98059;6:SB202190;7:PD98059+SB;8:SB202190+SB;9:Cisplatin;与对照组比较,*P<0.05;与SB-M组比较,#P<0.05
3 讨论
宫颈癌是全世界范围内最常见的妇科肿瘤之一,可影响到患者的卵巢、泌尿系统和肠道功能,其治疗方法主要包括早期的手术治疗和晚期的放、化疗[13]。晚期的放、化疗对机体产生一定损伤的同时也会增加患者的痛苦,因此严重影响患者的身体健康与生活质量[14]。
西医常规治疗方法在宫颈癌治疗方面取得了较为显著的疗效,但仍存在一些毒副作用及耐药等问题,中医药在宫颈癌治疗中具有明显优势,可从整体出发,辨证论治,前景良好[14]。水飞蓟宾为水飞蓟素的主要生物活性成分[15],是一种天然黄酮类化合物,通过靶向多种分子靶点和途径,在不同的肿瘤细胞中表现出抗肿瘤作用,如非小细胞肺癌[16]、三阴性乳腺癌[17]和皮肤癌[18]等。水飞蓟宾在宫颈癌中同样也发挥着抗癌作用,体外研究表明水飞蓟宾可通过激活Caspase-3/7相关途径抑制HeLa细胞增殖,并促进凋亡[5];体内研究发现水飞蓟宾可抑制裸鼠移植瘤肿瘤组织的生长[6]。You等[19]发现水飞蓟宾能够介导线粒体裂变功能障碍的发生,诱导宫颈癌细胞G2/M细胞周期阻滞。本研究采用不同浓度的水飞蓟宾处理宫颈癌HeLa细胞,发现水飞蓟宾对HeLa细胞的增殖具有剂量依赖性的抑制作用,该实验结果与上述水飞蓟宾抗肿瘤作用一致。
肿瘤细胞转移是癌症患者死亡的主要原因之一,取决于癌细胞侵入原发性肿瘤周围的细胞外基质并进入血管的能力,MMPs在基质蛋白降解过程中发挥关键性作用,阻断MMPs活性可有效防止癌细胞的侵袭和逃逸[20]。研究发现,水飞蓟宾可通过抑制p38 MAPK信号转导途径下调MMP-2和MMP-9的表达,从而降低胃癌细胞的侵袭和迁移能力[21]。MAPK信号转导途径在癌症发生发展过程中发挥重要的促进作用[22],MAPK超家族包括ERK1/2、p38和c-Jun氨基末端激酶等,影响着肿瘤细胞的增殖、周期、凋亡及放射敏感性等[23]。研究显示,水飞蓟宾可抑制乳腺癌细胞的生长与侵袭,其机制与抑制ERK激活,降低MMP-9表达有关[24]。本研究发现水飞蓟宾对宫颈癌HeLa细胞的侵袭能力具有抑制作用,进一步通过分子实验检测,结果显示水飞蓟宾可显著抑制宫颈癌HeLa细胞中MMP-2、MMP-9的表达以及ERK1/2和p38的磷酸化水平,且随着水飞蓟宾处理浓度的升高,其抑制作用越显著,呈现出剂量依赖性,提示水飞蓟宾抑制HeLa细胞增殖和侵袭可能与ERK/p38 MAPK有关。我们又进一步检测了ERK1/2信号抑制剂PD98059和p38 MAPK抑制剂SB202190对HeLa细胞增殖和侵袭的影响,结果显示PD98059和SB202190与水飞蓟宾效果相同,均能降低MMP-2、MMP-9、p-ERK1/2和p-p38的表达,且联合作用较水飞蓟宾单独作用时的效果更显著,表明水飞蓟宾可通过抑制ERK/p38 MAPK信号通路的激活来抑制体外HeLa细胞的增殖和侵袭。
综上所述,水飞蓟宾在体外可抑制宫颈癌HeLa细胞的增殖,降低细胞侵袭能力,其作用机制可能与抑制ERK/p38 MAPK信号通路的激活,进而下调MMP-2和MMP-9的表达有关。
