肥胖与症状性颅内动脉粥样硬化压力比的关系研究
2024-01-09王安琪王安心张怡君姜勇张亚清刘丽付胜奇秦海强刘改芬
王安琪,王安心,张怡君,姜勇,张亚清,刘丽,付胜奇,秦海强,刘改芬
目的 研究肥胖与症状性颅内动脉粥样硬化狭窄(symptomatic intracranial atherosclerosis stenosis,sICAS)患者跨病变压力比(pressure ratio,PR)减低的关系。
方法 本研究数据来源于中国国家卒中登记Ⅲ数据库。纳入数据库中具有HR-MRI影像学资料的sICAS患者进行分析。采用TOF-MRA成像进行网格建立,采用有限元方法进行建模获得压力值。血管狭窄远端压力和近端压力的PR≤0.76表示狭窄后残余血流减低。按患者BMI分为低或正常体重组、超重组和肥胖组3组。校正年龄、性别、吸烟史、重度饮酒史、高血压病史、糖尿病病史、血脂异常和狭窄程度这些可能的混杂因素,采用logistic回归分析肥胖与PR减低的关系。
结果 共438例患者纳入分析,中位年龄64(57~71)岁,其中148例(33.79%)为女性。低或正常体重组、超重组和肥胖组的中位PR分别为0.90(0.78~0.96)、0.89(0.73~0.96)和0.82(0.52~0.94),3组之间差异有统计学意义(P=0.044)。多因素logistic回归分析结果显示,校正年龄、性别、吸烟史、重度饮酒史、高血压病史、糖尿病病史、血脂异常和狭窄程度,肥胖是sICAS患者PR减低的危险因素(OR 2.551,95%CI 1.328~4.902,P=0.005)。此外,根据年龄进行亚组分析,在≥65岁的患者中,校正性别、吸烟史、重度饮酒史、高血压病史、糖尿病病史、血脂异常和狭窄程度,肥胖是sICAS患者PR减低的危险因素(OR 2.913,95%CI 1.118~7.590,P=0.029);进行性别亚组分析,女性患者中,校正年龄、高血压病史、糖尿病病史、血脂异常和狭窄程度,肥胖仍是sICAS患者PR减低的危险因素(OR 3.673,95%CI 1.174~11.493,P=0.002)。
结论 肥胖可能是sICAS患者PR减低的危险因素。通过减肥是否可以改善sICAS患者PR、增加脑血流灌注需要进一步研究。
颅内动脉粥样硬化狭窄是缺血性卒中的主要原因,尤其是在亚洲、非洲人群中[1]。在华法林-阿司匹林症状性颅内疾病(warfarin aspirin symptomatic intracranial disease,WASID)研究中,症状性颅内动脉粥样硬化狭窄(symptomatic intracranial atherosclerosis stenosis,sICAS)患者1年内卒中复发和死亡的风险高达15%[2]。sICAS的血流动力学特征可能与卒中复发风险相关[3]。近年来,在关于sICAS的研究中,采用计算流体力学建模获得的压力比(pressure ratio,PR)可用于评估颅内动脉狭窄后残余血流量,并用于卒中复发的预测[4-7]。肥胖与脑血流量减低有关[8],多项研究通过不同神经影像成像技术(ASL、SPECT、TCD和CTP)测量和评估脑血流和脑灌注,结果显示肥胖与脑血流减少和脑灌注压减低有关[8-11]。基于这些研究,肥胖可能是影响颅内动脉粥样硬化血流动力学的因素,但目前尚缺乏相关证据。
本研究基于中国国家卒中登记Ⅲ(China National Stroke Registry-Ⅲ,CNSR-Ⅲ)数据库,利用有完整临床资料和HR-MRI数据的sICAS患者的资料,通过构建流体力学模型获得PR,探讨肥胖与PR减低之间的关系。
1 对象与方法
1.1 研究对象 CNSR-Ⅲ是一项前瞻性登记研究[12],包含22个省和4个直辖市的201家医院的急性缺血性卒中和TIA患者,其主要目的是为中国缺血性脑血管病病因进行分类,识别缺血性脑血管事件预后的影像和生物标志物。本研究利用CNSR-Ⅲ数据库患者的基线资料,旨在评估sICAS患者肥胖与PR减低之间的相关性。纳入标准:①近1周内出现缺血性卒中症状,且头颅MRI证实存在急性梗死病灶;②经MRA证实颅内大动脉存在50%以上的狭窄,且该病变为责任血管病变。排除标准:①sICAS患者影像资料不全;②狭窄位于特殊部位,包括狭窄部位累及分支血管或者位于血管汇合处,或狭窄部位距离流体力学建模所假设的血流入口或者血流出口处过近(距离2 cm内),或存在颅内血管串联病变,或狭窄位于非梗死部位,或狭窄血管过长;③前循环和后循环血管同时存在梗死(图1)。CNSR-Ⅲ经由首都医科大学附属北京天坛医院伦理委员会(伦理批号:KY2015-001-01)和所有参与中心批准。

图1 研究患者入组流程Figure 1 Flowchart of the study patients enrollment process
1.2 基线数据收集 由培训合格的研究协调员通过病历摘录或访谈收集基线数据,包括年龄、性别、高血压病史、糖尿病病史、血脂异常及BMI。BMI计算方法是体重(kg)/身高2(m2),根据中国肥胖问题工作组的标准,低或正常体重:BMI<24 kg/m2,超重:24~<28 kg/m2,肥胖:≥28 kg/m2[13]。基于既往研究,血脂异常是指既往有被诊断为血脂异常或者服用调脂药物史,或血清TC水平≥240 mg/dL或TG水平≥200 mg/dL,或LDL-C水平≥160 mg/dL,或HDL-C水平≤40 mg/dL[14]。
1.3 影像学评估 MRI以DICOM格式收集,基于TOF-MRA图像测量颅内动脉狭窄,包括颈内动脉颅内段、大脑中动脉和椎基底动脉。测量使用Radiant DICOM软件的测量工具,通过TOF-MRA最大信号强度投影图像测量颅内动脉狭窄管腔直径。颅内动脉狭窄程度定义:50%~69%为中度狭窄,70%~99%为重度狭窄[15]。根据以下公式测量狭窄率:狭窄率=(1-最狭窄处残余管腔直径/狭窄远端正常管腔直径)×100%,该计算公式来自WASID研究[16]。
1.4 计算流体动力学建模 用个人工作站处理TOF-MRA的源图像,进行计算流体动力学(computational fluid dynamics,CFD)血流建模[17]。在TOF-MRA图像上识别症状性颅内动脉狭窄病变的责任动脉段。然后通过Mimics软件(Materialize NV,Belgium)重建3D几何模型,然后由一名神经内科医师对重建后的几何模型进行检查以及人工修订。利用ANSYS ICEM CFD网格划分软件(ANSYS,Inc.,USA)对血管表面进行进一步处理,生成计算域(体积网格),考虑到脑动脉几何结构的复杂性,在狭窄区域附近使用更精细的网格。该模型由一台具有240个中央处理器并行的超级计算机采用Newton-Krylov-Schwarz方法求解。应用ANSYS CFX(ANSYS,Inc.,USA)14.5版有限体积法求解三维血流。
1.5 血液和边界条件设置 假设血液是黏性不可压缩的牛顿流体。血液参数定义为恒定密度ρ=1060 kg/m3和恒定动态黏度μ=3.5×10-3kg·m-1·s-1。使用超声报告提供的动脉直径作为模型入口直径。颈动脉超声测量的血流速度为入口条件。计算雷诺系数Re≈ρvd/μ,假设本研究纳入受试者的脑血流状态为层流。血流的控制方程由三维常数和不可压缩纳维-斯托克斯(Navier-Stokes)方程描述。将瞬时脉动应用于血流,并集成参数模型模拟下游效应,例如远端出口边界处血管的阻力和顺应性。上述边界条件设置的详细计算方法与以往相关研究中发表的计算方法一致[17-18]。
1.6 分数压力比的测量与定义 使用ParaView 5.5.0(64位)(Kitware Inc.,USA)在计算流体力学模型中测量和提取狭窄前和狭窄后的压力值。沿病变侧纵轴定义了2个测量点,分别位于狭窄的入口和出口,并定义为起点压力和终点压力。PR=终点压力/起点压力[17]。基于既往研究[19],以PR≤0.76为界值,PR≤0.76为PR减低组,PR>0.76为PR正常组。
2 结果
2.1 一般资料 共438例患者纳入分析。本研究中患者年龄中位数为64(57~71)岁,女性148例(33.79%)。按BMI值分为低或正常体重组、超重组和肥胖组3组后,3组间性别、吸烟史、重度饮酒史、高血压病史和糖尿病病史分布差异无统计学意义;3组间年龄、血脂异常、狭窄程度、PR≤0.76的分布和PR值差异有统计学意义(表1)。根据PR≤0.76分组后,其中132例(30.14%)PR减低,306例(69.86%)PR正常,PR减低组和PR正常组之间BMI分布和中度狭窄比例比较差异有统计学意义(表2)。

表1 患者的基线特征比较Table 1 Comparison of baseline characteristics of patients

表2 PR≤0.76组和PR>0.76组sICAS患者基线特征的比较Table 2 Comparison of baseline characteristics between groups of PR≤0.76 and PR>0.76 in sICAS patients
2.2 肥胖与压力比关系的lo g i s t ic回归分析 单因素l o g i s t i c 回归分析结果显示,肥胖是PR减低的危险因素(OR2.486,95%CI1.349~4.581,P=0.004)。在校正可能的混杂因素如年龄、性别、吸烟史、重度饮酒史、高血压病史、糖尿病病史、血脂异常和狭窄程度后,多因素logistic回归分析结果显示,肥胖仍是PR减低的危险因素(OR2.551,95%CI1.328~4.902,P=0.005)(表3)。

表3 BMI对PR减低的影响logistic回归分析Table 3 Logistic regression of the effect of BMI on reduced PR
根据年龄进行亚组分析,在校正可能的混杂因素如性别、吸烟史、重度饮酒史、高血压病史、糖尿病病史、血脂异常和狭窄程度后,多因素logistic回归分析结果显示,在≥65岁的患者中,肥胖是PR减低的危险因素(OR2.913,95%CI1.118~7.590,P=0.029)(表4);在<65岁的患者中肥胖对PR减低可能有一定的影响,但相关未达到统计学意义(OR2.177,95%CI0.863~5.492,P=0.099)(表4)。
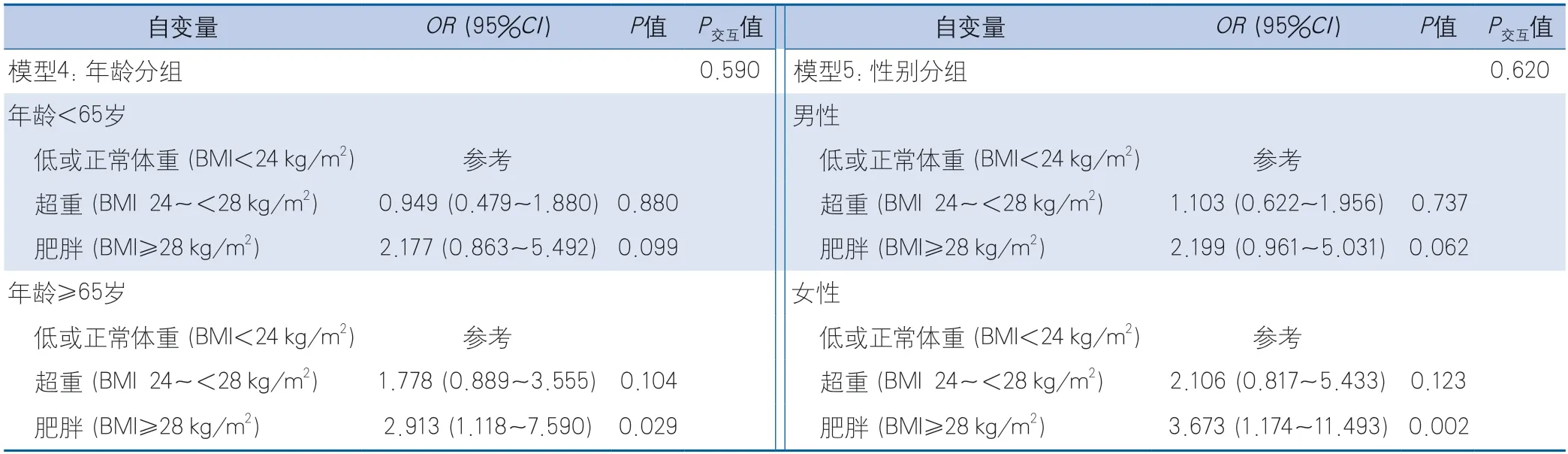
表4 BMI对PR减低的影响logistic回归亚组分析Table 4 Logistic regression subgroup analysis of the effect of BMI on PR reduction
根据性别进行亚组分析,在女性患者中,在校正可能的混杂因素如年龄、高血压病史、糖尿病病史、血脂异常和狭窄程度后,多因素logistic回归分析结果显示,肥胖是PR减低的危险因素(OR3.673,95%CI1.174~11.493,P=0.002)(表4);在男性患者中,校正可能的混杂因素如年龄、吸烟史、重度饮酒史、高血压病史、糖尿病病史、血脂异常和狭窄程度后,肥胖对PR减低可能有一定的影响,但相关未达到统计学意义(OR2.199,95%CI0.961~5.031,P=0.062)(表4)。对年龄和性别进行交互作用检验,提示无交互作用(P=0.590和P=0.620)。
3 讨论
本研究基于大规模、全国多中心卒中登记研究,发现肥胖与sICAS患者跨病变PR减低相关。因此,未来对于sICAS患者卒中复发的预防和治疗,建议肥胖(BMI≥28 kg/m2)患者减重,可能有助于改善颅内动脉粥样硬化狭窄血管的血流量。
跨病变PR这一参数最初被用于冠状动脉粥样硬化的研究,血流储备分数(fractional flow reserve,FFR)被认为是评估冠状动脉狭窄缺血的血流动力学参数[20],也是冠状动脉粥样硬化狭窄患者血流重建的“金标准”[21-23]。在颅内动脉粥样硬化患者中,顺行残余脑血流量和软脑膜侧支流量在颅内动脉粥样硬化狭窄代偿方面起到了重要作用,跨病变PR可用于评估狭窄后残余血流量,PR减低表明颅内动脉粥样硬化狭窄后血流受限显著,尤其是在大脑中动脉中度狭窄的下游脑灌注中[4]。此外,已有多项研究在颅内动脉粥样硬化患者中,探讨PR在动脉到动脉栓塞的作用,以及其与侧支循环状态的关系,并用PR预测卒中复发风险[3,6-7,24]。以PR作为评估颅内动脉狭窄后残余血流的血流动力学参数,正在被逐步认可和应用于临床研究中。因此,通过研究影响PR减低的因素,可以从血流动力学角度预防sICAS患者卒中复发。
在冠状动脉粥样硬化FFR的临床研究中,当FFR<0.75时,推荐进行血管重建,而当FFR>0.80时,则主张延迟血管重建[25]。但FFR 界值并不能直接用于颅内动脉粥样硬化研究中。在sICAS的研究中,有研究对PR≤0.70的颅内动脉粥样硬化狭窄患者给予支架置入,随访6个月后并没有出现缺血性卒中复发[26]。有研究以压力导丝测量的狭窄前后PR为参考标准,分别以PR≤0.70、PR≤0.75、PR≤0.80和PR≤0.76表示颅内动脉粥样硬化的功能性狭窄,评估计算流体建模获得PR值对于功能性狭窄的诊断准确性,结果认为界值为0.76时,计算流体建模获得的PR对颅内动脉粥样硬化功能性狭窄的诊断准确性最高,准确率为94.3%,AUC为0.987[19]。基于以上研究,本研究以PR≤0.76表示颅内动脉粥样硬化狭窄后血流受限,探讨BMI对sICAS患者血流受限的影响,提示肥胖与PR减低有关。
与本研究结果相似,既往研究通过不同的影像成像技术探讨肥胖与脑血流的关系,结果显示肥胖与脑血流速度降低、脑血管阻力增加和颅内部分区域血流减少有关。Selim等[27]的研究采用TCD技术评估大脑中动脉血流速度和阻力,结果显示BMI越高,血流速度越低,阻力越大。Willeumier等[11]使用SPECT方法观察到在健康个体中,较高的BMI与前额皮质功能脑血流量减少有关。还有研究采用ASL灌注成像的方法发现肥胖与灰质脑血流减低有关[9,28]。以上研究从血流动力学的角度支持本研究的结果,血流阻力的增加和流速的减慢可能会使颅内动脉粥样硬化狭窄后的远端血流灌注压减低,从而使得跨病灶PR减低。并且,肥胖导致的颅内部分血流量的减少,也可能是影响狭窄后血流减少的因素。
肥胖对脑血流的影响存在多种可能的病理生理学机制,既往研究显示肥胖患者的内皮功能受损[29]。内皮细胞受损后一氧化氮合成酶产生的一氧化氮减少,由一氧化氮介导的血管扩张功能减低,导致颅内血管过度收缩,脑灌注减低[30]。另外,氧化应激和慢性炎症是肥胖相关疾病的主要特征,促氧化和促炎症加剧了动脉粥样硬化的进展[31],动脉粥样硬化斑块增强等级与症状性大脑中动脉粥样硬化狭窄下游脑灌注损伤相关(r=-0.378)[32]。其次,脑自主调节是保护大脑不受外界压力干扰的重要机制,代谢综合征会干扰脑血流的自主调节能力[33]。Osmond等[34]指出,成年肥胖雄性大鼠表现出颅内血管的肌源性张力的增加和管径的减小,从而影响脑血流自主调节,使得脑血流减少和脑灌注压减低。而且,肥胖介导的长期血压升高也可能是脑血管变化的原因,且在肥胖的大鼠模型中,肥胖对大脑中动脉结构有显著影响,引起大脑中动脉广泛内向重塑,管腔直径减小[34]。这些机制可能都为肥胖与脑血流减低之间存在一定的关系提供了证据。
本研究有一些局限性。计算流体力学建模多基于DSA,MRA相对于DSA高估了颅内动脉粥样硬化狭窄程度[35],但是DSA是侵入性检查方法,存在手术风险和围手术期并发症发生风险。并且通过压力导丝测量的PR值和基于计算流体力学建模获得的PR高度相关(r=0.88)[18]。无创获得的TOF-MRA影像图像,结合后处理的CFD模型,不仅可以提供颅内动脉粥样硬化狭窄病变的解剖学信息,而且可以提供颅内动脉粥样硬化狭窄病变的血流动力学信息。并且由于TOF-MRA在临床诊治中的广泛使用,基于TOF-MRA的计算流体力学建模便于推广。另外,本研究并未排除少数伴有颅外动脉狭窄的患者,因为颅外动脉狭窄多是根据颈部超声结果判读,其准确性较低[36]。此外,肥胖与脑血流减低之间的相关性,仅在横断面研究中观察到[8],未来需要纵向研究来阐明因果关系。
4 结论
肥胖与sICAS跨病变PR减低有关,可能是PR减低的危险因素。本研究从血流动力学角度解释肥胖对sICAS患者PR的影响,未来可通过前瞻性研究来进一步探索肥胖对sICAS患者血流减低的影响,并观察是否可以通过减轻体重来逆转这一影响。
利益冲突所有作者均声明不存在利益冲突。
