以外种皮珠孔组织为外植体的胡椒体细胞胚再生研究
2024-01-08丁雅雯代金福岑怡范睿伍宝朵郝朝运胡丽松
丁雅雯 代金福 岑怡 范睿 伍宝朵 郝朝运 胡丽松

关键词:胡椒;外植体灭菌;愈伤诱导;体细胞胚胎发生
胡椒(PipernigrumL.)是胡椒科(Piperaceae)胡椒属(Piper)多年生常绿藤本植物[1],原产于印度西高止山脉(印度南部西海岸的马拉巴尔地区,现属喀拉拉邦),是世界重要的热带香辛料作物之一,有“香料之王”的美誉。在医学工业中胡椒被用作健胃剂、解热剂和支气管粘膜刺激剂等。在食品工业被用作抗氧化剂、防腐剂和保鲜剂等[2-3]。据统计,2019年世界胡椒收获面积达55.3万hm2,总产量达43.3万t。我国胡椒主要分布在海南、云南、广东等省,种植面积超过3万hm2,年产量达3.6万t,面积和产量均位居世界第五。其中,海南是我国的胡椒主产区,种植面积和产量约占全国80%[4-5]。近年来,随着我国人民生活水平的不断提高和饮食结构的变化,胡椒消费量还将大幅增加。市场需求的不断扩大给胡椒产业提供了广阔的发展前景。种苗繁育是产业推广的重要环节,目前胡椒良种繁殖以传统的扦插为主,该方法具有种苗优良性状稳定的优点,但它对苗圃规划、母株选择、苗期培育等环节有着严格的要求,成本较高,且无法满足产业快速推进需求[6-7]。因此,基于体细胞再生的高通量育苗技术是产业快速推进的迫切需求。
植物组织培养,又称为植物离体再生,一般的过程主要是离体的植物组织,在适宜的培养条件下,体细胞通过脱分化形成愈伤组织,愈伤组织进一步分化成体细胞胚,然后体细胞胚经历类似合子胚的发育过程,最终再生成完整植株,基于体细胞再生的种苗发育技术能够极大地保留种苗的优良性状。同时,在室内人工环境下进行种苗繁育,可避免遭受天气因素的干扰,生长状态相对一致,利于集中管理,降低成本。体细胞组培再生是种苗高通量、规模化、商业化生产应用最广泛的技术。例如,MATHEWS等[8]报道,以胡椒实生苗的各部位组织为外植体,仅苗端可以丛生芽方式增殖,但其他部位组织只能产生愈伤组织,而不能再生植株;BHAT等[9]以同为胡椒属的蒌叶(P.betleL.)和荜拔(P.longumL.)的各种外植体成功地培养出新植株,但对胡椒则只能在节环组织上产生不定芽,其他外植体只能诱导形成愈伤组织而无器官发生;刘进平等[10]以印尼大叶种胡椒的茎尖、合子胚、胚轴片段和子叶片段等为外植体进行了系统的组培再生研究。结果发现尽管采取了75%酒精、1%升汞和20g/L次氯酸钠组合的灭菌手段,仅成熟的种子可以建立无菌培养。在此基础上,以无菌种子苗芽尖为外植体建立了胡椒丛生芽诱导技术,由于后代变异、童期长、再生效率等问题该技术没有在产业上推广应用[11-13]。印度香料研究所用成熟的胡椒种子为外植体,在改良型无生长素的SchenkandHildebrandt(SH)培养基上暗培养,诱导出愈伤组织,进而分化出新的植株。尽管该研究提供了胡椒体细胞再生成功的技术方案,但从研究结果来看,并没有明确外植体是种子萌发出的胚状体,还是外种皮珠孔组织[14]。前人的研究从外植体选择、灭菌方法及培养条件等方面为胡椒体细胞再生研究提供了重要的参考。本研究以热引1号胡椒为研究对象,利用酒精梯度表面灭菌结合0.1%氯化汞对胡椒果实进行处理,通过无菌种子萌发获得外种皮外植体;利用对不同的植物生长调节剂种类和浓度配比,筛选出适宜的愈伤诱导培养基、体胚发生和生根壮苗培养条件,为胡椒组培苗的离体快繁技术提供理论基础。
1材料与方法
1.1材料
试验材料为我国主栽品种热引1号(P.nigrumc.v.Reyin-1)胡椒,材料种植于中国热带农业科学院香料饮料研究所内的农业农村部万宁胡椒种质资源圃。
1.2方法
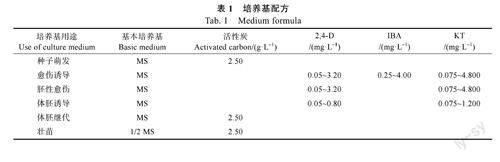
1.2.1外植体消毒灭菌与接种利用酒精和0.1%氯化汞设置不同条件组合对胡椒果实进行灭菌处理。处理1:0.1%氯化汞對外果皮直接灭菌8~10min,无菌水冲洗3~5次后去除果皮获得无菌种子;处理2:75%酒精对外果皮灭菌45s,无菌水清洗3~5次,去除果皮后用75%酒精对种子灭菌45s,无菌水清洗3~5次获得无菌种子;处理3:75%酒精表面消毒45s,无菌水清洗3~5次,去除果皮后用75%酒精对种子消毒灭菌45s,无菌水清洗3~5次,0.1%氯化汞浸泡消毒6~10min,无菌水清洗3~5次后获得无菌种子。灭菌后的种子,接种到萌发培养基上进行无菌培养,2周后统计污染率。种子萌发培养基选用MS培养基为基本培养基,添加1.5%蔗糖、0.25%活性炭和0.25%植物凝胶(表1)。种子材料接种时,每瓶培养基中接种3~4粒,29℃、黑暗条件下培养20~30d,可获得外种皮。
1.2.2愈伤组织及体细胞诱导将无菌外种皮接种在愈伤组织诱导培养基上,每瓶培养基接种3~5粒,每个组合接种6~8瓶,重复3次。每月继代转接1次,继代培养2次之后,统计愈伤组织诱导率愈伤诱导率=(愈伤组织总数-死亡愈伤组织种壳数)/接种外种皮总数×100%。挑选状态一致的愈伤组织转接在原培养基上,继续继代转接,2代之后,统计胚性愈伤组织分化率。胚性愈伤组织分化率=分化出胚性愈伤组织的外植体总数/(愈伤组织总数-死亡愈伤组织总数)×100%。愈伤组织诱导和分化培养基均选用MS培养基为基本培养基,除添加1.5%蔗糖和0.25%植物凝胶外,还附加了2,4-二氯苯氧乙酸(2,4-D,0.05、0.10、0.20、0.40、0.80、1.60、3.20mg/L)、3-吲哚丁酸(IBA,0.25、0.50、1.00、2.00、4.00mg/L)和6-糠基氨基嘌呤(KT,0.075、0.150、0.300、0.600、1.200、2.400、4.800mg/L)3种植物生长调节剂,具体培养基配方如表1所示,3种植物生长调节剂组合出12种实验组,未添加任何植物生长调节剂的MS培养基为对照组。胡椒愈伤组织诱导、增殖和分化培养所使用的培养基均未添加活性炭,诱导培养过程均在27℃,黑暗条件下进行。
愈伤每月继代培养1次,继代3次后。统计出间接体细胞胚胎诱导率,间接体胚发生诱导率=(诱导出体细胞胚的愈伤组织团数)/胚性愈伤总数×100%。发现有体胚长出时,及时转移至光下培养。体细胞胚胎诱导培养基具體成分如表1所示。待胚性愈伤分化出球形胚后,转接至MS培养基上,每月继代转接1次,记录体胚状态变化,直至分化出子叶胚,将诱导出的子叶胚转接在体胚继代培养基上,进而使其分化成完整植株。胡椒体胚继代培养基的组成成分和种子萌发培养基相同(表1),每瓶培养基中接种4粒子叶胚,接种50瓶。体细胞胚转接后排放于培养温度27℃,光照周期12h/d,光照强度2000lx的条件下进行培养。记录体胚状态变化,胚胎被认为在长出明显的主根和子叶后才叫发芽。
1.2.3壮苗培养将子叶胚继代在体胚继代培养基上,待幼苗长出2片以上新叶,苗高达3cm以上,继代在壮苗培养基上进行生根壮苗。胡椒壮苗培养基选用1/2MS培养基为基本培养基,添加1.5%蔗糖、0.25%活性炭和0.25%植物凝胶。每瓶培养基接种1~2株幼苗,接种100瓶。排放于培养温度29℃,光周期12h/d,光照强度2000lx的条件下进行培养。
2结果与分析
2.1外植体灭菌
以充分成熟、红润、饱满、无病虫害的果实为试验材料(图1),设置3种方式进行外植体灭菌处理,具体设置见材料方法。接种在不含植物生长调节剂的MS培养基中,放置于黑暗条件下培养2周统计污染率。污染率控制在10%以内。
在黑暗条件下培养约3周,种胚开始萌发,再经过1个月左右的培养,获得一棵含两片子叶和一粒种壳的胡椒实生幼苗。无菌实生幼苗再经过10~30d的培养,外种皮从子叶上脱落,获得无菌外种皮作为植物组织培养的外植体材料(图1C)。
2.2愈伤组织诱导
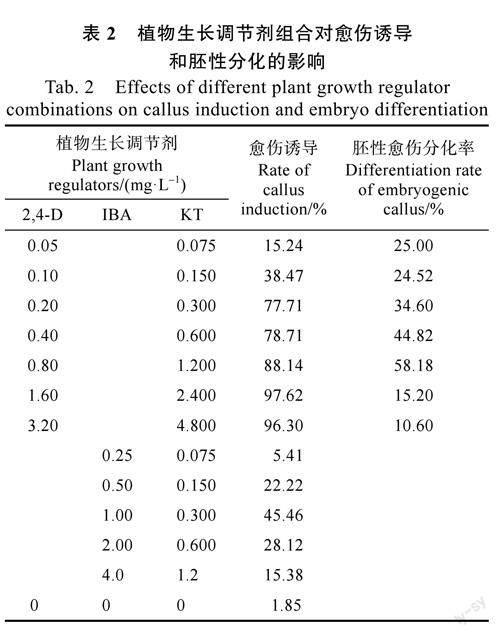
以外种皮为外植体开展愈伤组织诱导研究,以MS培养基为对照和基础培养基,设置3种植物生长调节剂浓度组合并记录愈伤诱导效果(表2)。外种皮经诱导培养后在珠孔组织处可见愈伤,生长正常的愈伤形态如图2A、图2B所示。统计结果发现,与IBA相比,2,4-D更益于诱导胡椒愈伤组织,不同浓度的2,4-D与KT植物生长调节剂组合均能促进胚性愈伤组织的分化,随着浓度的升高,愈伤组织诱导率呈上升趋势,愈伤最高诱导率达97.62%(表2)。继代1个月后,试验发现不同浓度的IBA和KT植物生长调节剂组合培养的愈伤组织逐渐死亡,IBA诱导活性不足,因此IBA不适宜作为胚性愈伤分化的植物生长调节剂。
不同浓度2,4-D和KT植物生长调节剂组合培养的愈伤组织经过2个月的继代培养,2,4-D浓度为1.6mg/L,KT浓度为2.4mg/L时,部分愈伤组织转化为增殖型愈伤(图2),增殖生长量大,继代转接2周后,增大到3倍以上,1个月后,便布满整个培养瓶,多呈乳白色,质地疏松,半透明状,表面附着白色粉状物或结晶体,却无法分化为胚性愈伤组织。
当2,4-D浓度为0.8mg/L,KT浓度为1.200mg/L时,出现灰白色或灰褐色,团粒结构,半透明状与浅黄色,颗粒状,松散的胚性愈伤组织(图2C、图2D)。胚性愈伤分化率可达58.18%(表2)。
2.3体细胞胚胎诱导及体细胞分化
胚性愈伤经过约3周的培养,转化为白色,结构松散,颗粒状的体细胞胚,出现大量球形胚,少数为心形胚和鱼雷形胚(图3A)。试验结果表明,在相对较低浓度的2,4-D(0.05、0.10mg/L)和KT(0.075、0.150mg/L)组合下,胡椒愈伤无法诱导出胚状体,当2,4-D浓度为0.40mg/L,KT浓度为0.600mg/L时,体胚诱导率最高,为13.33%(表3)。将诱导出的球形体细胞胚(图3A)继代转接在含0.40mg/L2,4-D和0.600mg/L的KTMS培养基上,经过1周左右的时间,转化为心形胚(图3B),3周后出现鱼雷形体胚和子叶胚(图3C、图3D)。将子叶胚单独转接于体细胞胚继代培养基上,继带培养约1个月,待子叶胚生长至约2cm,顶部分化出两片绿色小叶后(图3E、图3F)可进行后续生根诱导培养。
2.4生根诱导与炼苗培养
待子叶完全长成后,将幼苗转接在1/2MS培养基,添加1.5%蔗糖,0.25%活性炭和0.25%植物凝胶进行生根诱导培养。培养1个月后,叶片宽大,绿色加深,有新叶长出,2片对生新叶间长有芽点,并可见新诱导的白色根系,组培苗生长迅速,可生长至5~7cm(图4A、图4B)。待组培苗叶片转为深绿色,有光泽,叶脉清晰,主蔓出现茎节,茎粗达0.9cm,根系布满培养瓶底部(图4C、图4D)后,将组培苗移至室外培养基质中进行炼苗培养。培养基质采用草炭土、珍珠岩、蛭石混合物,比例为1∶1∶1,温室中遮荫培养2周后获得组培苗(图4E、图4F)。
3讨论
现有的文献中有关胡椒体胚发生的研究较少,基于体细胞再生组培苗繁育技术仍有很多细节需完善。前人研究表明,胡椒体胚发生,与基因型、外植体生理状态、培养基种类、植物生长调节剂种类、培养条件等诸多因素决定[15]。其中,外植体灭菌是开展组培繁育的第一步。刘进平等[10]用大田胡椒的芽、单节茎段、叶片、幼嫩花絮等材料进行外植体消毒灭菌,污染率均为100%,发现仅有成熟的胡椒种子可以建立无菌培养,但污染率仍然高达30%~60%。陈雄庭等[16]以胡椒主蔓节间切断为外植体,其污染率在45%以上。印度香料研究所的研究人员报道了以胡椒种子胚为外植体,通过体细胞再生途径获得胡椒组培苗的方法[17]。但文章中并未明确外植体是种子萌发的胚状体还是外种皮珠孔组织。本研究以成熟胡椒种子的外种皮作为外植体,通过酒精和升汞复合式灭菌处理,有效地降低了胡椒外植体污染问题,污染率控制在10%以内,建立了胡椒外植体高效的灭菌方式。同时将种子萌发的胚状体和外种皮分离后培养,明确了外种皮的珠孔组织是适宜胡椒组培再生外植体。
愈伤组织的诱导分化效率和减少褐变是影响胡椒组培成功的关键。刘进平[18]研究发现,绝大多数胡椒愈伤组织在后续继代培养中会逐渐褐化直至变黑死亡,即使加入质量分数10%PVP或0.3%活性炭也未能阻止愈伤褐变发生。本研究探究了添加植物生长调节剂组合对体胚诱导的影响,结果表明,2,4-D和KT组合是最佳的诱导植物生长调节剂组合,在2,4-D浓度为0.80mg/L和KT浓度为1.200mg/L时能促进胚性愈伤的诱导。在2,4-D浓度为0.40mg/L,KT浓度为0.600mg/L时,体胚分化率最高,为13.33%。同时发现体胚分化的过程中有次生胚发生,从胚轴下部根茎交接部位发生一丛新的次级胚胎,可实现体胚循环再生[18-20]。该次生体细胞胚胎起源于初生体细胞胚的根茎处,或是原始体细胞胚附着的胚性愈伤组织,组织发生增殖,从而产生大量次生体细胞胚胚团。为实现胚胎发生,也可以通过适当调节植物生长调节剂种类和浓度配比,或培养基中其他的有效成分等方式来实现。本研究以建立胡椒组培苗繁育技术为目标,系统研究了从外植体灭菌、愈伤诱导、体胚分化到室外炼苗的过程中的关键技术,并最终获得组培苗,研究结果为胡椒高通量种苗繁育提供了全面的技术参考,具有重要的应用价值。
