胶原/氧化葡聚糖/葡萄糖酸锌载药水凝胶的制备及性能
2024-01-08朱志勉,匡卫,田荟琳,段炼
朱 志 勉, 匡 卫, 田 荟 琳, 段 炼
( 1.齐鲁工业大学(山东省科学院) 轻工学部, 山东 济南 250353;2.齐鲁工业大学 生物基材料与绿色造纸国家重点实验室, 山东 济南 250353;3.西南大学 蚕桑纺织与生物质科学学院, 重庆 400715 )
0 引 言
基于天然高分子材料,如I型胶原[1]、葡聚糖[2]、壳聚糖[3]等,制备的水凝胶,由于其结构和组成与细胞外基质相似,生物学性能较好,广泛应用于组织工程支架[4]、药物递送载体[5]等生物医学领域。
I型胶原作为细胞外基质中重要的结构蛋白,得益于其独特的四级结构,具备其他蛋白无法媲美的优异生物相容性、生物降解性和低细胞毒性等生物学特性,已广泛应用于生物医学和化妆品等领域。在体外适宜的条件下(生理条件最佳),I型胶原分子可以通过自组装行为生成具有D周期结构的成熟胶原纤维[6],进而形成胶原水凝胶。然而纯胶原水凝胶力学性能和抗酶降解能力较差,故会限制其在生物医学领域的应用。为弥补此缺陷,可引入外源性组分对胶原进行物理或化学改性。物理改性一般有改善程度不足的缺陷;化学改性虽可显著提高纯胶原水凝胶的机械性能,但需注意改性胶原材料的生物相容性和降解性问题。因此引入无害且具备功能化的动态化学键,如席夫碱键[7]和双硫键[8]等,来制备环境刺激响应型水凝胶已成为胶原材料改性的新方向。席夫碱反应由于实验方法简单、反应迅速且具备一定的自愈性能已广泛用于制备细菌响应型水凝胶,可有效解决传统水凝胶对细菌感染环境的可控药物释放能力不足的问题。
因天然多糖来源广泛,生物学特性较优异,目前基于双醛基化多糖向胶原基生物材料中引入动态席夫碱键的研究相对较多。葡聚糖作为一种电中性多糖,可与带正电荷的胶原分子通过氢键形成均一稳定的体系,避免了由于静电相互作用产生的胶原凝聚沉降现象[9]。此外,葡聚糖的葡萄糖单元中的邻位羟基可被高碘酸盐氧化生成醛基,故醛基化葡聚糖可和胶原分子侧链的自由氨基发生席夫碱反应而显著提高胶原基生物材料的机械性能,且不会影响其生物学性能[10]。
除侧链自由氨基外,胶原分子侧链还富有可供交联的羧基基团,故可通过金属离子与胶原侧链羧基的配位改性改善胶原基生物材料的机械性能[11]。葡萄糖酸锌作为一种常见的营养强化剂,具有一定的抗菌性能和优异的生物学性能[12],故推测可利用葡萄糖酸锌中富含的Zn2+与胶原侧链的羧基配位来进一步加强胶原水凝胶的机械强度,且赋予改性胶原水凝胶抑菌性能。
本实验旨在开发一种用于递送氨基糖苷类药物的细菌响应型胶原基水凝胶。通过溶胀性、抗酶解性、动态流变和SEM测试对水凝胶的机械性能和结构进行分析,通过阿米卡星释放动力学测试研究水凝胶的细菌响应性释药性能,通过水凝胶对细菌生长的抑制效果研究其抗菌性能。
1 实 验
1.1 原料及试剂
I型胶原蛋白,实验室自制;葡聚糖T70,上海金穗生物科技有限公司;阿米卡星,北京索莱宝科技有限公司;乙二醇、无水乙醇、甲醇、醋酸,天津市富宇精细化工有限公司;磷酸二氢钠、磷酸氢二钠、氢氧化钠、氢氧化钾,国药集团化学试剂有限公司;高碘酸钠、叔丁醇、硼酸,天津市大茂化学试剂厂;I型胶原酶,北京智杰方远科技有限公司;氯化钠,天津市鼎盛鑫化工有限公司;固体LB Broth,青岛生工生物科技有限公司;葡萄糖酸锌、戊二醛、邻苯二甲醛、3-巯基乙酸,上海麦克林生化科技股份有限公司。
1.2 材料制备
1.2.1 氧化葡聚糖(ODex)的制备
称取一定量葡聚糖溶于水配制质量分数2.0%的葡聚糖溶液;根据氧化度100%(OD 100%)计算高碘酸钠用量,避光称取,用去离子水溶解后加到葡聚糖溶液中,避光搅拌反应24 h,加入2 mL乙二醇搅拌2 h终止反应[10]。透析2 d后冷冻干燥得到ODex海绵,避光密封保存。
1.2.2 胶原/氧化葡聚糖/葡萄糖酸锌水凝胶(CODZnG)的制备
冰浴条件下将冻干胶原海绵溶解于0.005 mol/L的醋酸溶液中,制得质量浓度10 mg/mL的胶原溶液;将冻干的ODex海绵溶于PBS(0.02 mol/L,pH 7.4)中,根据胶原与氧化葡聚糖质量比20∶1、10∶1、4∶1、1∶1,配制不同质量分数的OD 100% ODex溶液。
将葡萄糖酸锌水溶液加入胶原溶液中混合均匀,加入ODex溶液,涡旋下滴加NaOH溶液将样品pH调至8.5,37℃水浴中反应2 h即得CODZnG。最终水凝胶样品中胶原质量浓度为5 mg/mL,葡萄糖酸锌质量浓度为0.05 mg/mL。
根据水凝胶中ODex比例将纯胶原水凝胶和CODZnG命名为Col、CODZnG-0.05、CODZnG-0.1、CODZnG-0.25、CODZnG-1。
1.2.3 载药水凝胶(CODZnG-AMK)的制备
以CODZnG-1为载药水凝胶基质。先将阿米卡星加入ODex溶液中预交联,随后将其加入胶原/葡萄糖酸锌溶液中混合均匀,调整pH为8.5并在37℃水浴2 h成胶,记为水凝胶CODZnG-AMKI,其中胶原质量浓度为5 mg/mL,阿米卡星质量浓度为1 mg/mL。
同样操作制备阿米卡星质量浓度为2 mg/mL的载药水凝胶,记为CODZnG-AMKII。
1.3 CODZnG水凝胶性能表征
1.3.1 溶胀性能测试
CODZnG水凝胶样品真空冷冻干燥,称重,记为m0。室温下将其浸没于PBS(0.01 mol/L,pH 7.4)中,每间隔一定时间后取出,用滤纸擦拭样品表面多余液体后称重,记为m1,直至样品质量溶胀平衡。每个样品称重3次取平均值,每组3个样品。
溶胀率=[(m1-m0)/m0]×100%
式中:m0为样品初始质量,m1为样品溶胀后质量。
1.3.2 抗酶降解性能测试
将1 mL不同改性胶原水凝胶表面擦干后称重,记为m2。将其浸泡于3 mL、100 μg/mL的胶原酶溶液中,保持37 ℃水浴,于固定时间点取出样品后轻擦干表面称重,记为m3。
降解率=[(m2-m3)/m2]×100%
式中:m2为样品的初始质量,m3为样品降解后的质量。
1.3.3 机械流变测试
采用流变仪(TA,ARES-G2)对CODZnG水凝胶样品进行黏弹性能测试。使用平板模式(板直径25 mm,板间距1 mm),在动态测试中选择控制应力,分别测定弹性模量(G′)、黏性模量(G″)和损耗因子(tanδ)随剪切频率的变化。测试温度为20 ℃,应变为5%,动态频率为0.1~10 Hz。
1.3.4 抗压缩性能测试
按“1.2.2”操作制备Col和CODZnG-1。水凝胶样品直径为10 mm,高度为5 mm。采用质构仪(TA,XT Plusc)测试,压缩速率为1 mm/s,直到水凝胶被压破停止测试。
1.3.5 扫描电镜测试(SEM)
室温下将Col和CODZnG-1水凝胶样品在体积分数为2%的戊二醛水溶液中固定2 d,用乙醇溶液(30%,50%,70%,80%,90%,95%,99.5%,100%)梯度脱水,再用叔丁醇置换残余的乙醇,最后将样品冷冻干燥。
将CODZnG冻干海绵表面进行真空喷金处理后进行电镜扫描,加速电压20 kV。
1.3.6 阿米卡星释放动力学测试
采用邻苯二醛衍生化法[13]测定阿米卡星的释放量。邻苯二醛衍生化试剂配制过程:将268 mg邻苯二醛溶于10.00 mL甲醇中,再加入1.40 mL 3-巯基乙酸和38.60 mL硼酸,用KOH调节pH至10.5。
阿米卡星标准曲线实验过程:依次配制质量分数为0.2、0.4、0.6、0.8和1.0 mg/mL的阿米卡星水溶液。将1 200 μL邻苯二醛衍生液加入600 μL阿米卡星标准溶液中,补充PBS至体积3 mL。室温孵育30 min后测试333 nm处的吸光度。
标准曲线:y=-1.427 6×10-4+0.896 2x,R2=0.999。其中x为阿米卡星质量浓度,mg/mL;y为样品在333 nm处的吸光度。
阿米卡星释放动力学测试过程:室温下将2 mL CODZnG-AMK浸泡于5 mL pH 7.4或5.0的PBS中,每隔规定的时间取出600 μL样品进行测试,取样后补充600 μL对应pH的PBS以保持总体积不变。
将1 200 μL邻苯二醛衍生化液加到所取样品中,再补充对应pH的PBS至3 mL。室温孵育30 min后,测试333 nm处吸光度。根据标准曲线计算得到不同时间段的阿米卡星释放率。
1.3.7 抗菌性能测试
根据细菌生长曲线的差异来反应改性胶原水凝胶的抗菌性能。将固体LB Broth溶解为肉汤培养基,高温灭菌2 h,加入水凝胶样品和少量大肠杆菌或金黄色葡萄球菌,在恒温振荡培养箱中培养细菌。通过测定溶液于600 nm的吸光度变化来反应细菌的生长情况。
2 结果与讨论
2.1 水凝胶的溶胀性能
溶胀性能是评估水凝胶在水性体系中稳定性的一个重要指标。用于伤口敷料的水凝胶需要具备强大的溶胀性能,从而确保能在短时间内吸收大量伤口渗出液[14]。载药水凝胶则不同,过强的溶胀会导致水凝胶在进入体内释放药物前迅速膨胀[5],挤压组织的同时可能会影响药物的释放效果,故需合理控制载药水凝胶的溶胀率。
纯胶原水凝胶和CODZnG的溶胀性能见图1。由图1可知,纯胶原水凝胶的平衡溶胀率高达719%,CODZnG-0.05、CODZnG-0.1、CODZnG-0.25和CODZnG-1水凝胶平衡溶胀率依次降为606%、498%、422%和313%。所有的水凝胶样品均能在2 h内达到溶胀平衡,但样品间的平衡溶胀率差别却很大,CODZnG的平衡溶胀率随着ODex量的增加而显著降低。因胶原分子中含有大量的亲水性基团,如酰胺基、羧基、氨基等,使纯胶原水凝胶具有良好的亲水性;纯胶原纤维水凝胶网状结构稳定性较差,故其平衡溶胀率最高。ODex和葡萄糖酸锌交联改性后胶原水凝胶的平衡溶胀率大大降低,这可能是因为交联提升了CODZnG网状结构的稳定性。故推测CODZnG可满足载药水凝胶对溶胀率的需求。
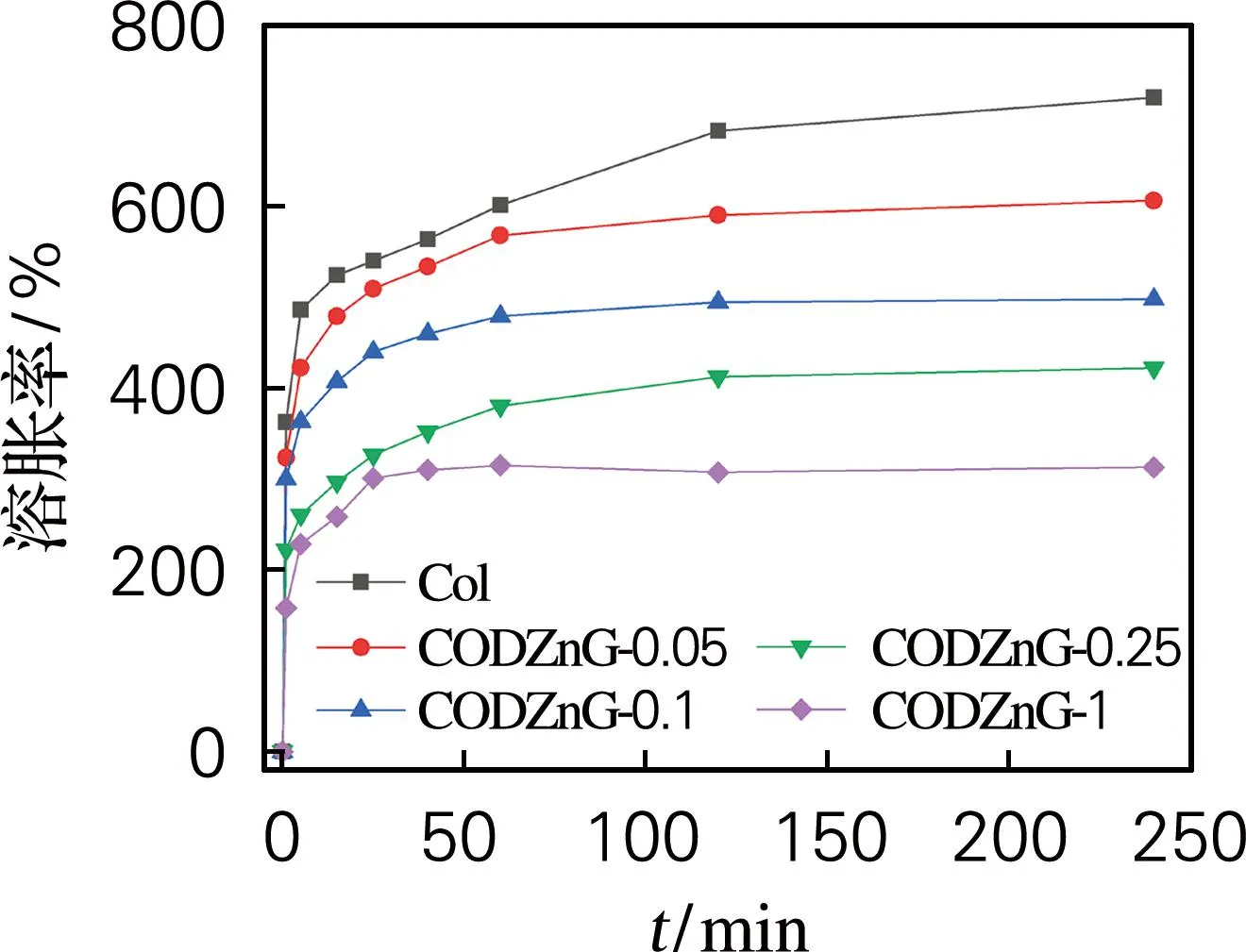
图1 纯胶原水凝胶和CODZnG的溶胀性能
2.2 水凝胶的体外酶降解性能
水凝胶的抗酶解性能对其生物学性能影响很大。纯胶原水凝胶因其网状结构稳定性较差,易被胶原酶快速降解而导致水凝胶骨架坍塌,失去其促进细胞增殖和药物缓释等优良生物学性能的持久性[15]。对胶原进行交联改性来提高其抗酶解能力是一种常见的方法。交联改性对胶原水凝胶体外酶降解性能的影响见图2。由图2可知,与纯胶原水凝胶相比,改性水凝胶的体外酶降解速率大大降低,CODZnG抗酶解性能的提升幅度与ODex量正相关。这进一步证明ODex化学交联和Zn2+配位协同作用使得CODZnG的网状结构更加稳固,与溶胀性能测试结果一致。

图2 纯胶原水凝胶和CODZnG的抗酶降解性能
2.3 CODZnG水凝胶力学性能
为进一步评估交联改性对CODZnG结构稳定性的影响,对纯胶原水凝胶CODZnG进行动态流变性能测试,结果见图3和表1。由图3可知,纯胶原水凝胶和CODZnG水凝胶均呈现出非线性黏弹性特性,即在0.1~10 Hz的剪切范围内,G′基本保持不变,且G′>G′′,表现出水凝胶典型的黏弹性行为[16]。由表1可知,与纯胶原水凝胶相比,CODZnG水凝胶的G′显著提高。CODZnG-0.05的G′从24.2 Pa升至77.9 Pa;继续增加ODex量至质量比为10∶1时,CODZnG-0.1的G′升至292.6 Pa;继续增大ODex量至胶原与ODex质量比为1∶1时,CODZnG-1的G′达到552.7 Pa,说明经过ODex化学交联和Zn2+配位协同作用,胶原分子链段之间产生了更多的缠结,因而形成了更加坚固的交联网状结构,从而提升了CODZnG水凝胶的弹性抗变形能力。此外,CODZnG-0.1、CODZnG-0.25和CODZnG-1的tanδ基本相同,表明这三种水凝胶的弹性相当。综合溶胀性能、抗酶解性能机械流变结果,且为保证制备载药水凝胶时ODex有足够的活性醛基,故考虑CODZnG-1作载药水凝胶基质。
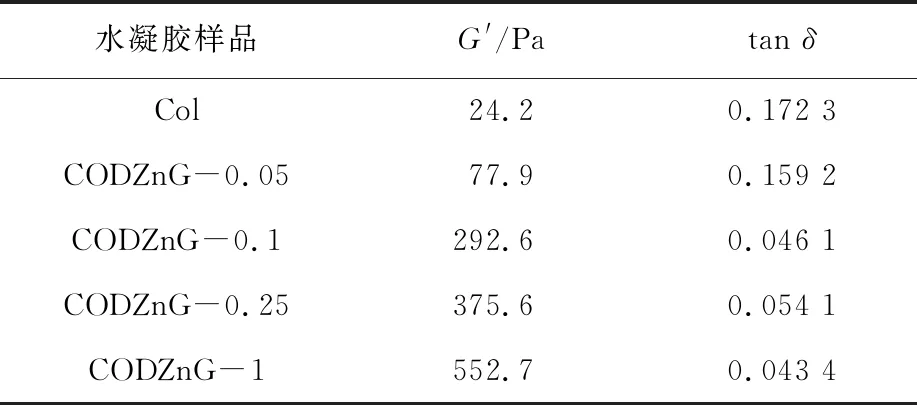
表1 水凝胶的流变性能
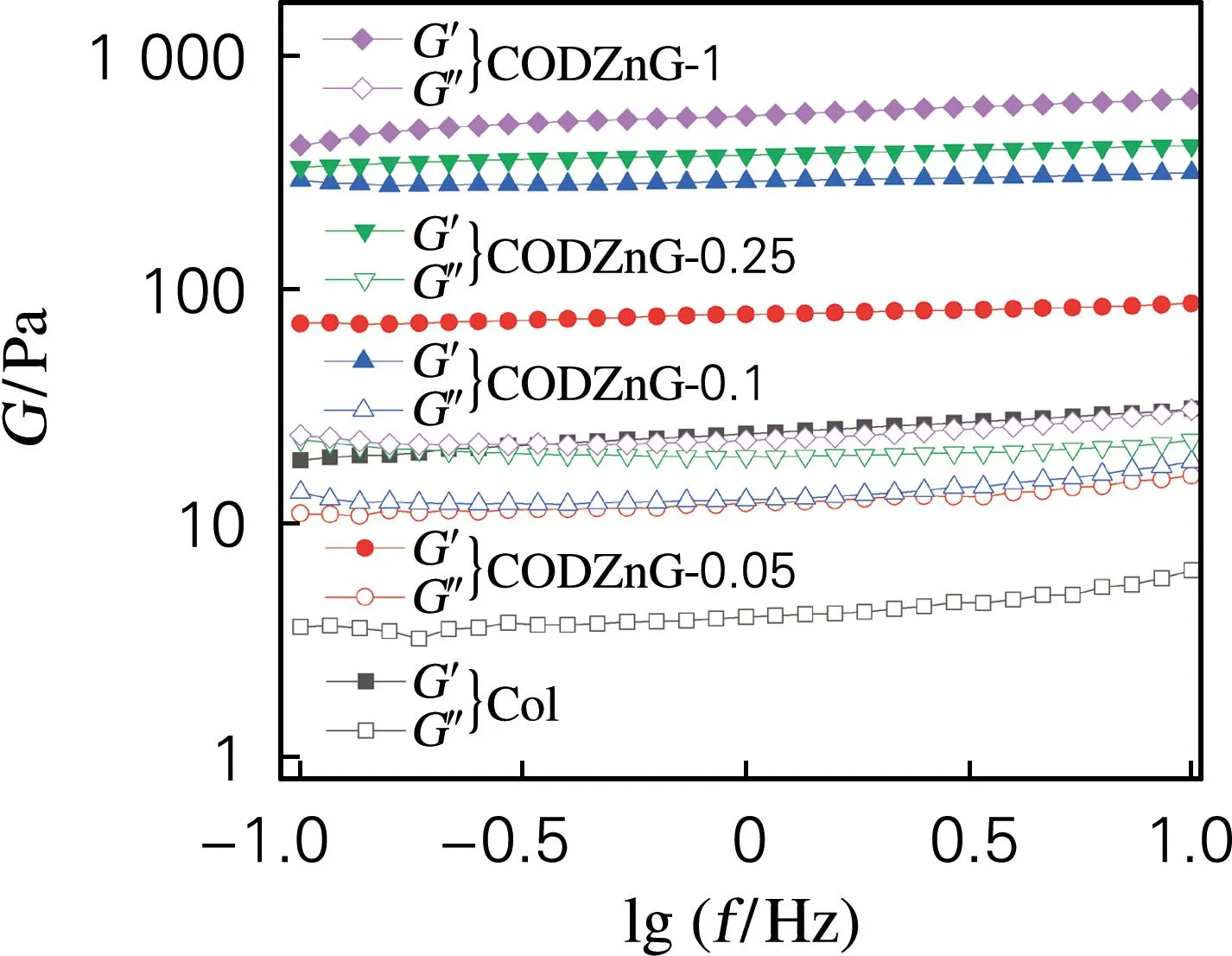
图3 CODZnG水凝胶的流变性能
由抗压测试可知,CODZnG-1的断裂抗压强度达5.21 kPa,与纯胶原水凝胶1.6 kPa的强度相比大大提升,进一步说明CODZnG-1的机械强度可满足载药水凝胶的制备要求。
2.4 SEM
纤维编织网状结构是胶原水凝胶的重要特点,该结构作为胶原水凝胶的骨架,对材料稳定性起决定性作用;用作支架材料时,网状结构可为细胞黏附、增长提供适宜的空间[17];用作伤口敷料传递药物时,网状结构可吸收组织渗出液。因此,制备水凝胶材料时需结合微观形貌观察来初步判断应用性能。
图4为纯胶原水凝胶和CODZnG-1的SEM图像。两种水凝胶均呈现出由胶原纤维编织所形成的三维网状结构,纤维与纤维编织所形成的孔径通道结构既有利于液体的储存从而带来一定的溶胀性能,作载药应用时也可以为药物提供嵌入的空间[5]。从图4(a)可以看出,纯胶原水凝胶通过自组装形成的胶原纤维纤细,纤维编织所形成的网状结构较致密。图4(b)中的改性胶原水凝胶的胶原纤维则比较粗壮,纤维与纤维间形成的横向聚集较多,网状结构的孔径相对较大。这表明ODex和葡萄糖酸锌的协同交联可能先促进胶原分子形成大的聚集态,再通过自组装形成更粗壮的成熟胶原纤维,因而赋予CODZnG-1更好的力学性能。ODex可能在成熟胶原纤维束之间交联,带入空间位阻的同时也促进胶原纤维之间的横向聚集,既改善了水凝胶的力学性能,又使网状结构的孔径增大。这意味着改性胶原水凝胶不仅可以为细胞的黏附增殖或药物储存提供更坚固的支架,还可以提供更通畅的营养运输和药物释放通道。

(a) 胶原水凝胶(×5 000)
2.5 阿米卡星的pH响应释放
细菌在呼吸和发酵过程中会产生酸性产物,如碳酸和乳酸,故生物体被细菌感染后会产生pH 5左右的弱酸环境[5]。根据这种特定的变化,利用席夫碱键来实现氨基糖苷类药物的细菌响应释放效果。阿米卡星是一种常见的氨基糖苷类抗生素,具有临床上的广谱抗菌活性,因此在本研究中选择阿米卡星作为药物模型。因高剂量的氨基糖苷类抗生素具有严重的耳毒性和肾毒性[13],低剂量则会失去良好的抗菌效果,故需一种可根据细菌感染情况按需给药的智能水凝胶。
设置pH 7.4和pH 5.0两种pH,分别对应体内健康环境和细菌感染后的环境;考虑到伤口各异所需抗菌药量不同,设置1和2 mg/mL两种阿米卡星质量浓度。由图5可知,纯胶原水凝胶在两种pH下的阿米卡星释放率差异较小,24 h时pH 7.4阿米卡星的释放率为50.9%,pH 5.0时阿米卡星的释放率为64.4%,表明纯胶原水凝胶中药物的释放可能为普通的扩散释放,对细菌感染的响应性低。而CODZnG-AMKI在两种pH下的阿米卡星释放率有明显差异,24 h时pH 7.4阿米卡星的释放率仅为15.9%,而pH 5.0时阿米卡星的释放率增大至77.0%,表明CODZnG-AMKI可减缓健康体况时阿米卡星的释放,而遭遇细菌感染则可加快阿米卡星释放,初步实现阿米卡星的可控释放。此外,CODZnG-AMKII在两种pH下的阿米卡星释放率差异更大,24 h时pH 7.4时阿米卡星的释放率仅为18.8%,而pH 5.0时阿米卡星的释放率高达83.2%,这表明增大阿米卡星浓度可使CODZnG-AMKII的细菌性响应性增强,实际应用中可根据伤患处具体情况调整阿米卡星浓度来调节其释放行为[18]。

图5 pH 5.0与pH 7.4下水凝胶的药物释放率
CODZnG-AMK中阿米卡星的结合源于其氨基与ODex的醛基间的席夫碱反应,后进一步稳固于胶原自组装和ODex与葡萄糖酸锌的协同交联所形成的网状结构中。pH 7.4时,因固定阿米卡星的席夫碱键可较稳定存在,仅未交联固定的少量阿米卡星扩散释放至水凝胶外。此外,CODZnG中水凝胶孔径较大,也利于阿米卡星未交联部分的扩散释放;因环境较健康,少量阿米卡星即可实现抗菌效果。pH降至5.0时,固定阿米卡星的席夫碱键易断裂[19],交联固定的阿米卡星开始快速大量释放,满足此时强大的抗菌需求。这表明CODZnG-AMK初步具备阿米卡星的细菌型智能响应特性。
2.6 水凝胶抗菌性能分析
蛋白质材料由于其高亲水性和其营养物质特性而易被环境微生物污染,因此需添加抗生素[13]或金属颗粒[20]改善其抗菌性。在CODZnG-AMK中,Zn2+和阿米卡星共同赋予水凝胶抗菌作用,故CODZnG-AMK在阿米卡星释放前后及释放期间均具有一定的抗菌效果。将水凝胶浸泡在菌液中,根据两种常见细菌(大肠杆菌、金黄色葡萄球菌)的生长曲线判断水凝胶对细菌生长的抑制情况,结果见图6。由图6可知,纯胶原水凝胶对大肠杆菌、金黄色葡萄球菌两种细菌的生长没有抑制作用,均可在前12 h快速增殖,其中金黄色葡萄球菌的生长速度快于大肠杆菌。与纯胶原水凝胶相比,CODZnG-1中大肠杆菌、金黄色葡萄球菌的生长速率明显减缓,最终平衡浊度值也有所降低,表明CODZnG-1中少量的葡萄糖酸锌对两种细菌的生长具有一定的抑制作用,赋予CODZnG-1一定的抑菌效果。加入阿米卡星后,水凝胶中浊度几乎没有变化,表明负载阿米卡星可显著提高抗菌性。

图6 不同凝胶浸泡液中的大肠杆菌和金黄色
3 结 论
ODex和葡萄糖酸锌协同交联作用可显著改善胶原基水凝胶溶胀性能、抗酶解性能和力学性能,改善程度与ODex量正相关。CODZnG-AMK初步具备阿米卡星的细菌响应性可控释放能力。CODZnG-1对大肠杆菌、金黄色葡萄球菌具有一定的抑菌效果。CODZnG-AMK对大肠杆菌、金黄色葡萄球菌可持续抑菌。
