索磷布韦/达拉他韦治疗的慢性丙型肝炎患者血尿酸水平变化研究*
2024-01-07唐智权李开铃
唐智权,杨 婷,李开铃
慢性丙型肝炎(CHC)是由感染丙型肝炎病毒(hepatitis C virus,HCV)引起的慢性肝脏疾病。大部分人感染HCV后早期症状十分隐匿,常常在体检或若干年后出现不适症状时才被发现,仅少部分人可自行清除病毒而获得痊愈,85%人群在感染HCV后逐渐发展成慢性肝炎。当病毒侵犯肝脏时,会引发体内一系列的免疫反应,以抵抗感染。若不予以有效的治疗则病情会发展为肝硬化,少部分患者甚至发展至肝细胞癌[1,2]。除肝脏受累外,HCV感染还可导致代谢紊乱、免疫功能失调、肾损伤和心血管疾病风险增加等。高尿酸血症或者血尿酸(serum uric acid,SUA)水平升高是常见的代谢异常。相关研究报道显示,CHC患者SUA水平显著高于普通人群。未经治疗的CHC患者SUA水平更高[3]。目前,治疗CHC患者的标准方案是聚乙二醇化干扰素-α联合利巴韦林,但其治疗效果因HCV基因型不同而有所差异。近年来,基于索磷布韦的直接抗病毒药物(direct acting agents,DAA)治疗逐渐成为治疗CHC患者的主要方案,但SUA水平与抗病毒疗效的关系仍有待研究。有些报道显示,CHC患者SUA水平在接受索磷布韦治疗结束时显著高于治疗前,也有些报道显示,应用DAA药物方案治疗结束后,CHC患者SUA水平较治疗前显著下降,高SUA血症发病率也明显下降[4]。本研究分析了索磷布韦/达拉他韦治疗CHC患者SUA水平的变化,现报道如下。
1 资料与方法
1.1 一般资料 2018年6月~2023年6月我院收治的CHC患者200例,男性78例,女性122例;年龄为30~70岁,平均年龄为(58.2±5.6)岁;诊断符合《丙型肝炎防治指南》[5]的标准,其中肝硬化67例(33.5%);治疗前存在高SUA血症(男性SUA>420 μmol/L,女性SUA>360 μmol/L)患者38例。纳入标准:血清抗-HCV阳性,且持续6个月以上,血清ALT升高,HCV RNA阳性。排除标准:失代偿期肝硬化;合并自身免疫性肝病或遗传代谢性肝病;酗酒、吸毒。
1.2 检测与检查 使用天津冠嘉医疗设备有限公司提供的LWC-360 型全自动生化分析仪检测血生化指标,并计算天冬氨酸氨基转移酶/血小板指数(aspartate aminotransferase-to-platelet ratio index,APRI);使用美国贝克曼库尔特公司生产的COBAS TaqMan48 PCR 分析仪检测血清HCV RNA(检测下限为15 U/mL);使用上海英骏生物技术有限公司提供的3730测序仪采用基因序列测定法测定HCV基因型;使用海斯凯尔医学技术有限公司生产的Fibrotouch-B型诊断仪行肝脏硬度检测(liver stiffness measurement,LSM)和肝脏脂肪受控衰减参数(controlled attenuation parameter,CAP)检测。
1.3 治疗方法 给予所有患者索磷布韦片(正大天晴药业集团股份有限公司,国药准字H20223435)400 mg口服,1次/d;盐酸达拉他韦片(南京圣和药业股份有限公司,国药准字H20223191)60 mg口服,1次/d。治疗24 w,停药后随访24 w。
1.4 疗效评价[6]快速病毒学应答 (rapid virologic response,RVR): 治疗第 4 周时血清HCV RNA 定量低于检测下线;早期病毒学应答(early virologic response,EVR):治疗第 12 周时 HCV RNA 定量低于检测下线;治疗结束病毒学应答(end treatment virologic response,ETVR):治疗第 24 周结束时 HCV RNA定量低于检测下线;持续病毒学应答(sustained virologic response,SVR):停药随访24周时血清 HCV RNA定量低于检测下线。

2 结果
2.1 两组临床资料比较 高SUA组体质指数(body mass index,BMI)显著大于正常SUA组,差异有统计学意义(P<0.05),两组其他临床资料比较无显著性统计学差异(P>0.05,表1)。
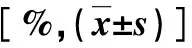
表1 两组临床资料比较
2.2 两组血生化和其他指标比较 高SUA组血清TG和CAP显著高于正常SUA组(P<0.05,表2)。
2.3 两组疗效比较 高SUA组RVR和EVR显著低于正常SUA组(P<0.05),而两组ETVR和SVR比较无显著性统计学差异(P>0.05,表3)。
2.4 两组不同性别人群SUA水平变化比较 无论男性还是女性,治疗后高尿酸组SUA水平均显著下降(P<0.05,表4)。

表2 两组临床指标比较
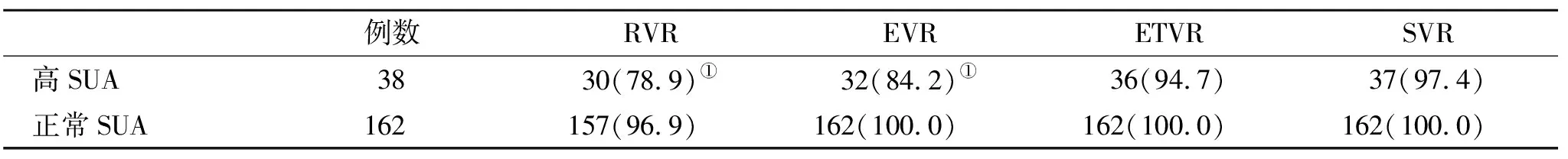
表3 两组疗效(%)比较
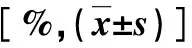
表4 不同性别高与正常尿酸组SUA水平变化比较
3 讨论
CHC不仅会对肝脏造成慢性损伤,还会引起多种肝外表现,代谢紊乱即为其中之一。CHC患者易合并代谢综合征,HCV感染者更易并发糖尿病、胰岛素抵抗和脂代谢异常等。SUA代谢异常与肝细胞脂肪变为氧化应激产物的不同表现,均属于代谢综合征的常见临床表现[7]。研究显示,SUA水平变化与多种代谢改变有关,其水平受到嘌呤代谢速率、某些疾病、饮食、药物的影响,CHC与SUA代谢异常之间联系密切[8]。同时,SUA通过肝内脂肪蓄积为HCV持续存在和复制创造有利环境,加速肝纤维化和坏死性炎症进程,从而促进肝脏疾病进展,具体体现为:高SUA水平可通过高胰岛素血症、内质网应激诱导的SREBP-1c激活、NLRP3炎症小体等多种机制引发脂质代谢障碍,也可通过线粒体氧化应激,阻断氧化磷酸化,促使更多果糖进入三酰甘油合成途径,导致肝细胞内脂质蓄积。此外,高SUA血症是痛风发生的生物化学基础,SUA水平降低可以降低痛风发作风险。SUA水平升高与心血管疾病及脂肪肝的发生密切相关。
有研究表明,有效清除HCV可以减少肝脏相关并发症。目前,CHC的药物治疗主要包括α-干扰素治疗方案和DAA治疗方案,其中高SUA血症可能影响聚乙二醇化干扰素-α联合利巴韦林抗HCV治疗的疗效。利巴韦林可导致剂量依赖的溶血性贫血和SUA生成增加,磷酸化利巴韦林在红细胞中积累,抑制肌苷-5'-单磷酸脱氢酶和三磷酸腺苷,导致SUA水平升高,而DAA可作用于HCV非结构蛋白,通过阻断HCV复制清除HCV,应用于治疗CHC患者取得了良好的效果,但关于DAA治疗后患者SUA水平是否降低并无统一的结论[9-10]。有研究发现,CHC患者接受DAA治疗后SUA水平反而高于治疗前,且数周后仍未降至治疗前水平[11],但也有研究显示,CHC患者接受DAA治疗后SUA水平明显低于治疗前,高SUA血症发生率也有所下降[12,13]。
SUA是人体内嘌呤代谢的终末产物,从在核酸代谢中产生的腺嘌呤和鸟嘌呤开始,由腺嘌呤和鸟嘌呤生成次黄嘌呤,随后经由黄嘌呤氧化酶形成黄嘌呤,在黄嘌呤氧化酶作用下分解为SUA,大约30%SUA通过胆汁和胃肠道从体内消除,剩余的70%由肾脏排出。受肾血流量、肾小球滤过和近端肾小管交换的影响,在通常情况下,人体内SUA水平升高是由于肾脏损伤,导致其对SUA的处理能力减弱,以及尿液排出SUA减少[14-15]。HCV可通过代谢紊乱、肝肾损伤等诱导SUA合成增加、排泄减少。肝脏是HCV感染的主要受损器官,也是SUA合成的场所之一。CHC患者因肝功能受损,SUA水平通常高于一般人群[16-17]。因此,CHC患者接受抗病毒治疗后肝肾功能的改变可影响SUA水平。基于索磷布韦的DAA作用于HCV后,对人体内SUA代谢的影响是不同的,但其干预SUA代谢的具体机制目前尚不清楚,有待进一步深入研究。肥胖是摄入的热量大于消耗,因摄入能量增加,嘌呤合成亢进,SUA生成增加,而消耗少使得过多脂肪沉积于皮下、腹部和内脏器官,脂肪分解的酸性代谢产物会抑制SUA排泄,间接引起SUA水平增高。GFR是临床常用的肾功能评估指标,其水平降低意味着患者可能患有急性肾损伤。HCV可直接入侵肾实质,而肾脏是SUA的主要清除器官。DAA治疗可通过影响肾功能进而影响SUA排泄[18-20]。
综上所述,CHC患者应用索磷布韦/达拉他韦治疗期间原伴有高SUA血症的CHC患者SUA水平大多降低,而继续升高的例数较少。应用DAA类药物治疗CHC患者应注意观察SUA水平变化。本组资料显示高SUA水平可能影响早期病毒学应答,但对整个治疗的影响较小。CHC患者合并高SUA水平的原因比较复杂,可能与基础肥胖、高血压和高脂血症的存在有关。针对这类患者是否需要特别应对以提高治疗疗效,还需要进一步观察。
