基于Trx2/ASK1信号通路探讨补骨颗粒对软骨细胞凋亡的调控机制
2024-01-07余光书林焱斌王松清吴春玲
余光书 林焱斌 王松清 吴春玲

【摘 要】目的:觀察补骨颗粒对软骨细胞凋亡及对Trx2/ASK1/Caspase-3表达的影响,从而探讨补骨颗粒对软骨细胞凋亡影响机制,为进一步研究补骨颗粒防治骨关节炎奠定实验基础。方法:将20只SD大鼠随机分为空白对照组,补骨颗粒低、中、高剂量组,每组5只。适应性喂养7 d,空白对照组给予蒸馏水2 mL·kg-1灌胃,补骨颗粒低、中、高剂量组给予补骨颗粒1.54 g·kg-1、3.08 g·kg-1、6.16 g·kg-1灌胃。干预14 d后,抽取血液经离心获得血清。通过酶联免疫吸附试验检测血清中Trx2、ASK1、Caspase-3表达量,采用MTT法检测血清干预后的细胞增殖活性,采用流式细胞仪检测血清干预后的软骨细胞凋亡率。结果:与空白对照组比较,补骨颗粒低、中、高剂量组Trx2、ASK1与Caspase-3含量明显减少,差异均有统计学意义(P < 0.05);与补骨颗粒中剂量组比较,补骨颗粒低剂量组和高剂量组Trx2与ASK1含量明显增多,补骨颗粒低剂量组Caspase-3含量明显增多,差异均有统计学意义(P < 0.05)。与空白对照组比较,补骨颗粒低、中、高剂量组OD值明显升高(P < 0.05);补骨颗粒低、中、高剂量组组间比较,差异无统计学意义(P > 0.05)。流式细胞仪检测发现,不加入硝普钠时(对照组1)软骨细胞的凋亡率最低为4.25%,加入硝普钠后(空白对照组1)软骨细胞的凋亡率变为46.86%,补骨颗粒低剂量组1软骨细胞的凋亡率(30.15%)高于补骨颗粒中剂量组1(27.77%)和高剂量组1(27.41%)。结论:补骨颗粒将会调控Trx2表达,并且不同剂量补骨颗粒将会通过Trx2-ASK1解离度调控Caspase-3活化程度而影响软骨细胞的凋亡,这将有助于进一步认识补骨颗粒对骨关节炎防治过程。
【关键词】 骨关节炎;补骨颗粒;Trx2/ASK1信号通路;软骨细胞;细胞凋亡;大鼠
Exploring the Regulatory Mechanism of Bugu Keli(补骨颗粒)on Chondrocyte Apoptosis Based on the Trx2/ASK1 Signaling Pathway
YU Guang-shu,LIN Yan-bin,WANG Song-qing,WU Chun-ling
【ABSTRACT】Objective:To observe the effect of Bugu Keli(补骨颗粒)on chondrocyte apoptosis and Trx2/ASK1/Caspase-3 expression,in order to explore its mechanism on chondrocyte apoptosis and lay an experimental foundation for further research on the prevention and treatment of osteoarthritis by Bugu Keli.Methods:Twenty SD rats were randomly divided into a blank control group and low,medium,and high dose groups of Bugu Keli,with 5 rats in each group.Adaptive feeding for 7 days,the blank control group was given 2 mL·kg-1 of distilled water by gavage,while the low,medium,and high dose groups were given 1.54 g·kg-1,
3.08 g·kg-1,6.16 g·kg-1 of Bugu Keli by gavage.After 14 days of intervention,blood was extracted and centrifuged to obtain serum.The expression levels of Trx2,ASK1,and Caspase-3 in serum were detected by enzyme-linked immunosorbent assay.Cell proliferation activity was detected by MTT method after serum intervention,and chondrocyte apoptosis rate was detected by flow cytometry after serum intervention.Results:Compared with the blank control group,the contents of Trx2,ASK1,and Caspase-3 in the low,medium,and high dose groups were significantly reduced,with statistical significance(P < 0.05);compared with the medium dose group,the low dose and high dose group showed a significant increase in Trx2 and ASK1 content,while the low dose group of Bugu Granules showed a significant increase in Caspase-3 content,with statistical significance(P < 0.05).Compared with the blank control group,the OD values of the low,medium,and high dose groups were significantly increased(P < 0.05);there was no statistically significant difference between the low,medium,and high dose groups(P > 0.05).Flow cytometry detection showed that the lowest apoptosis rate of chondrocytes was 4.25% in control group 1 without the addition of sodium nitroprusside.After the addition of sodium nitroprusside,the apoptosis rate of chondrocytes in blank control group 1 increased to 46.86%.The apoptosis rate of chondrocytes in the low dose group 1(30.15%)was higher than that in the medium dose group 1(27.77%)and the high dose group 1(27.41%).Conclusion:Bugu Keli will regulate the expression of Trx2,and different doses of it will affect the apoptosis of chondrocytes by regulating the degree of Caspase-3 activation through the dissociation of Trx2-ASK1.This will help to further understand the prevention and treatment process of Bugu Keli on osteoarthritis.
【Keywords】 osteoarthritis;Bugu Keli(补骨颗粒);Trx2/ASK1 signaling pathway;chondrocytes;cell apoptosis;rats
膝骨关节炎(knee osteoarthritis,KOA)是一种以膝关节软骨退行性变为主要病理特征的慢性骨关节疾病,其发生、发展是软骨细胞、细胞外基质以及软骨下骨三者降解和合成失衡的结果。目前研究表明,软骨细胞凋亡是骨关节炎(osteoarthritis,OA)发病机制中的重要环节,阻止或延缓软骨细胞凋亡是防治OA的一条有效途径[1-2]。然而,软骨细胞凋亡受外源性通路和内源性通路相互影响,具体作用机制复杂,但在激发软骨细胞凋亡中的级联反应往往相辅相成,其中经过细胞凋亡信号调节激酶途径诱导细胞凋亡发生是目前研究的方向,尤其通过中药对机体功能调控后所产生的有效成分调控软骨细胞凋亡是目前研究的热点[3]。基于既往研究發现,补骨颗粒可以通过硫氧还蛋白2/凋亡信号调节激酶1(Trx2/ASK1)信号通路抑制软骨细胞凋亡[4-5],拟进一步从补骨颗粒与软骨细胞凋亡的量效关系探讨补骨颗粒对软骨细胞凋亡调控机制,这将有助于进一步认识补骨颗粒对OA防治过程。
1 实验材料
1.1 实验动物 清洁级SD大鼠20只,体质量(160±20)g,由中南大学湘雅二医院提供,实验动物生产许可证号SCXK(湘)2019-0004,饲养温度20~25 ℃,湿度70%左右,自由进食,自由饮水,实验动物使用许可证号SYXK(湘)2017-0002,用于制备血清;大鼠关节软骨细胞由武汉普诺赛生命科技有限公司提供(批号CP-R092),通过Ⅱ型胶原蛋白行免疫荧光鉴定,红色荧光为Collagen Ⅱ阳性[5]。
1.2 实验药物 补骨颗粒(药物组成:骨碎补20 g、鹿衔草12 g、淫羊藿12 g、党参15 g、茯苓20 g、三七3 g、川牛膝9 g、当归9 g、川芎6 g、女贞子15 g、枸杞子9 g、生地黄15 g、甘草3 g),由福州市第二医院药剂科加工制备,每克颗粒药含原生药9.8 g,使用时用蒸馏水加热溶解成1 g·mL-1的水溶液。
1.3 实验试剂 MTT试剂盒(Sigma公司,批号M2128);凋亡试剂盒(江苏凯基生物技术股份有限公司,批号KGA1030);Trx2试剂盒、ASK1试剂盒(北京博奥森生物技术有限公司,批号bs-4256R、bs-3029R);半胱氨酸天冬氨酸特异性蛋白酶3(Caspase-3)(Proteintech公司,批号ab44976);硝普钠(索莱宝科技有限公司,批号HY-A0119);DMEM培养基(Sigma公司,批号D5796);胰酶消化液(Abiowell公司,批号AWC0232);胎牛血清(Gibco公司,批号10099141);双抗(青链霉素,碧云天生物科技有限公司,批号SV30010);PBS(Abiowell公司,批号AWC0409)。
1.4 实验仪器 超净工作台(北京亚泰隆仪器技术有限公司,型号YT-CJ-2NB);直热式二氧化碳培养箱(上海三腾仪器有限公司,型号DH-160I);倒置生物显微镜(北京中显恒业仪器仪表有限公司,型号DSZ2000X);低速离心机(上海知信实验仪器技术有限公司,型号SL02);台式高速冷冻离心机(湖南湘仪实验室仪器开发有限公司,型号H1650R);多功能酶标分析仪(深圳市汇松科技发展有限公司,型号MB-530);流式细胞仪(Beckman,型号A00-1-1102);电热恒温培养箱(北京市永光明医疗仪器有限公司,型号DHP-500);全自动酶标洗板机(深圳市汇松科技发展有限公司,型号PW-812)。
2 方 法
2.1 实验分组与血清制备 将20只SD大鼠按照随机数字表法分为空白对照组,补骨颗粒低、中、高剂量组,每组5只。适应性喂养7 d,空白对照组给予蒸馏水2 mL·kg-1灌胃,补骨颗粒低、中、高剂量组给予补骨颗粒1.54 g·kg-1、3.08 g·kg-1、
6.16 g·kg-1灌胃(中剂量组浓度依据临床常用量按实验动物与人体表面积折算的等效剂量比值换算[6],低剂量组浓度为中剂量组1/2,高剂量组浓度为中剂量组2倍),每日1次,连续14 d。于最后一次灌胃后2 h腹主动脉无菌取血,常温下静置60 min,离心机以2000 r·min-1离心10 min,离心半径为21 cm,后取同组血清混合,再离心1次,56 ℃灭活30 min,过滤除菌后用于进一步实验。
2.2 酶联免疫吸附试验(ELISA)法检测血清中Trx2、ASK1、Caspase-3含量 取上述4组适量血清按照ELISA检测说明书进行检测:将50 mL不同浓度的标准品或稀释5倍的蛋白质样品加入每个标准品或样品孔中;接着加入100 μL酶标试剂,用封板膜封板后于37 ℃孵育60 min。然后,小心揭掉封板膜,弃去液体后用吸水纸拍干,每孔加入洗涤液350 μL,浸泡1 min,洗板;重复5次后,每孔加入50 μL底物A和B,37 ℃避光孵育15 min。然后,在每个孔中加入50 μL终止溶液,并根据Trx2、ASK1、Caspase-3 ELISA说明书,在450 nm处依次测量每个孔的光密度(OD)值。每组样品平行重复5次。以标准品的浓度为横坐标,对应的OD值为纵坐标,绘制标准品的线性回归曲线,根据曲线方程计算各样品的浓度值。
2.3 MTT法检测细胞增殖活性 将大鼠软骨细胞培养于含体积分数为10%的胎牛血清(FBS)加质量分数为1%的双抗DMEM培养基中,置于37 ℃,体积分数为5%的CO2饱和湿度培养箱中培养。取第3代SD大鼠软骨细胞,消化计数,以5×103个细胞/孔密度接种于96孔板内,每孔100 μL,置于37 ℃,体积分数为5%的CO2恒温培养箱培养24 h贴壁。加入不含小牛血清的单纯DMEM培养基,饥饿24 h,使细胞同步化于G0或G1期。取上述4组血清分别稀释为体积分数为15%[3],然后再分别进一步培养软骨细胞,各组均设4个复孔,培养24 h后更换完全培养基100 μL,每孔加入5 mg·mL-1 MTT(每孔10 μL),37 ℃,体积分数为5%的CO2恒温培养箱继续孵育4 h。吸去含MTT和旧的培养基溶液,加入二甲基亚砜每孔150 μL,充分混匀,于Bio-Tek酶标仪分析490 nm处OD值,取均值并绘制生长曲线。
2.4 流式细胞仪检测软骨细胞凋亡率 取第3代SD大鼠软骨细胞,消化计数,以1×105个细胞种植于24孔板,于37 ℃,体积分数为5%的CO2恒温培养箱培养24 h贴壁后加入不含小牛血清的单纯DMEM培养基,饥饿24 h,使软骨细胞同步化于G0或G1期。然后,在培养体系中分别加入2 mol·L-1硝普钠及体积分数为15%的血清(分组:不加硝普钠为对照组1,加入硝普钠及空白对照组血清为空白对照组1,加入硝普钠及低剂量组血清为补骨颗粒低剂量组1,加入硝普钠及中剂量组血清为补骨颗粒中剂量组1,加入硝普钠及高剂量组血清为补骨颗粒高剂量组1)。将上述分组的软骨细胞培养24 h,然后用不含EDTA的0.25%胰酶消化收集软骨细胞。用PBS洗涤细胞2次,离心机以2000 r·min-1离心10 min,离心半径为21 cm,收集约3.2×105个细胞,加入500 μL的结合缓冲液悬浮细胞。然后,加入5 μL膜联蛋白V-APC混匀后加入5 μL碘化丙啶,混匀,室温、避光反应10 min,流式细胞仪检测软骨细胞凋亡,在488 nm处分析细胞凋亡。膜联蛋白V-FITC(激发波长Ex = 488 nm,发射波长Em = 530 nm)的绿色荧光通过FITC通道(FL1)检测;PI红色荧光(流式Ex = 488 nm,Em≥ 630 nm)通过FL2检测。
2.5 统计学方法 采用SPSS 20.0软件进行统计分析。计数资料符合正态分布以表示,多组间的成对比较(F检验)采用单因素方差分析,方差齐时使用LSD法,方差不齐时使用Tamhane's T2;
不符合正态分布采用秩和检验;采用Kruskal-Wallis方法进行多组间比较。以P < 0.05为差异有统计学意义。
3 结 果
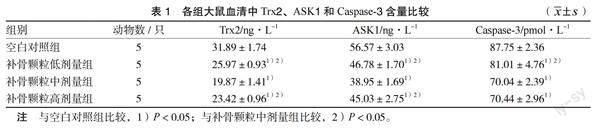
3.1 各组大鼠血清中Trx2、ASK1和Caspase-3含量比较 与空白对照组比较,补骨颗粒低、中、高剂量组Trx2、ASK1和Caspase-3含量明显减少,差异均有统计学意义(P < 0.05);与补骨颗粒中剂量组比较,补骨颗粒低剂量组和高剂量组Trx2、ASK1含量明显增多,低剂量组Caspase-3含量明显增多,差异均有统计学意义(P < 0.05)。见表1。
3.2 各组大鼠软骨细胞活性比较 与空白对照组比较,补骨颗粒低、中、高剂量组软骨细胞OD值明显升高,差异有统计学意义(P < 0.05);补骨颗粒各剂量组组间比较,差异无统计学意义(P > 0.05)。见表2。
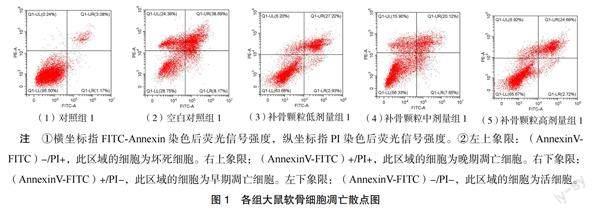
3.3 各组大鼠软骨细胞凋亡率比较 对照组1软骨细胞凋亡率最低为4.25%;空白对照组1软骨细胞凋亡率为46.86%;补骨颗粒低剂量组1软骨细胞凋亡率为30.15%,高于补骨颗粒中剂量组1的27.77%和高剂量组1的27.41%。见图1。
4 讨 论
软骨细胞的大量凋亡是导致OA发展的重要因素,抑制软骨细胞凋亡是防治OA的重要方法之一;但是,不同剂量的药物对体内经吸收代谢后出现的新成分和产物存在一定的差异,这可能对软骨细胞产生毒性作用或者无法起到有效作用[7]。因此,本研究在既往研究的基础上,进一步研究补骨颗粒含药血清对软骨细胞及Trx2/ASK1信号通路影响的量效关系[4,8]。通过不同剂量的补骨颗粒干预大鼠获得的血清培养软骨细胞后发现,补骨颗粒中剂量组与补骨颗粒高剂量组的软骨细胞活性更强且抑制软骨细胞凋亡率更好,说明过低剂量的补骨颗粒对软骨细胞的作用较弱,在使用补骨颗粒治疗OA时需要注意足够的剂量及合适的疗程。另外,研究还发现,低剂量的补骨颗粒对Trx2/ASK1/Caspase- 3蛋白表达的影响明显低于中剂量组及高剂量组,说明足够剂量的补骨颗粒将促进Trx2/ASK1信号通路发挥其对软骨细胞的影响。但是,文中未涉及足够的阳性对照,这使实验结果的分析存在一定的不足。
软骨细胞的凋亡通路主要有外源性通路和内源性通路两种,其中外源性通路主要为死亡受体介导的凋亡通路,内源性通路主要为线粒体介导的凋亡通路。既往研究发现,补骨颗粒可以通过影响线粒体的活性氧含量,从而通过Trx2/ASK1信号通路引起Caspase-3瀑布式活化和软骨细胞凋亡[4-5]。
因此,认为补骨颗粒可以通过Trx2/ASK1信号通路调控软骨细胞的凋亡。为了进一步研究补骨颗粒对软骨细胞凋亡影响的有效含量,本研究采用不同剂量的补骨颗粒对大鼠血清中Trx2/ASK1/Caspase-3表达进行比较,结果发现,补骨颗粒可以抑制Trx2/ASK1/Caspase-3表达,但是补骨颗粒中剂量对Trx2和ASK1表达的抑制作用更强,而补骨颗粒中剂量与高剂量对Caspase-3的表达无明显差异,结合补骨颗粒对软骨细胞凋亡的影响,认为中等剂量的补骨颗粒即可通过Trx2/ASK1/Caspase-3相关蛋白的表达抑制软骨细胞凋亡,过高剂量的补骨颗粒在一定程度上影响线粒体内Trx2/ASK1表达的活性,但这仍需要进一步的实验研究。另外,本研究中只使用了ELISA方法检测Trx2/ASK1/Caspase-3表达量,没有进行Western印迹法定性观察,这也使实验结果存在一定的不足。
Trx2是线粒体内膜蛋白中清除活性氧簇的主要蛋白,所以Trx2在维持细胞存活、降低氧化应激以及调节线粒体细胞凋亡信号转导过程中起重要作用[9-10]。在正常情况下,Trx2与ASK1相结合并且抑制其活性;在氧化应激情况下,ASK1将从Trx2-ASK1复合体中释放,并且激活凋亡前因子Caspase-3而触发凋亡通路[11]。通过研究发现,补骨颗粒能够抑制Trx2-ASK1复合物中Trx2的解离,进而起到抑制Caspase-3所诱导的软骨细胞凋亡,并且在中剂量与高剂量补骨颗粒干预下效果更明显。因此,认为一定剂量补骨颗粒可通过Trx2信号通路抑制软骨细胞凋亡。另外,今后还可以应用逆转录酶定量聚合酶链反应进一步检测Trx2/ASK1/Caspase-3基因表达情况探讨补骨颗粒的作用,这将更有利于探討补骨颗粒是否通过调控线粒体影响软骨细胞的凋亡。
OA屬中医学“痿证”“痹证”“骨痹”范畴,其病机是本虚标实,其中肝肾亏损是致病的内在因素,风寒湿邪外袭是外在因素,经络气血阻滞则是痹证的主要病机,这与西医学OA的病理变化是相通的。早期OA主要是关节内的炎症反应,进而出现软骨细胞凋亡、关节软骨破坏,关节炎症反应是标痹的微观表现,软骨细胞凋亡则是本痿的微观表现,而该过程受到多种细胞因子及信号通路的调控。基于既往临床上补骨颗粒治疗OA具有良好效果[9],进一步研究发现,补骨颗粒可通过Trx2信号通路抑制软骨细胞凋亡,为进一步了解OA的发病机制提供思路,为寻找补肾活血方药对OA作用靶点提供依据。
补骨颗粒由骨碎补、鹿衔草、淫羊藿、党参、茯苓、三七、川牛膝、当归、川芎、女贞子、枸杞子、生地黄等药物组成。现代药理学研究表明,骨碎补、淫羊藿、鹿衔草等补益肝肾中药可以调控蛋白质的内稳态,促进软骨细胞的增殖[12-13]。党参、茯苓等补气健脾中药可以提高抗氧化酶的活性,增强细胞的抗氧化能力[14]。三七、当归、川牛膝等活血药物可以通过调控线粒体信号通路控制细胞凋亡[15-16]。所以,补骨颗粒具有促进细胞增殖与抑制细胞凋亡的功效。结合研究发现,一定剂量的补骨颗粒能够抑制软骨细胞凋亡,补骨颗粒将会通过Trx2表达以及Trx2-ASK1解离度调控Caspase-3活化程度而影响软骨细胞的凋亡,这将有助于进一步认识补骨颗粒对OA的防治过程。
参考文献
[1] WANG BEN,SHAO ZHENXUAN,GU MINGBAO,et al.
Hydrogen sulfide protects against IL-1β-induced inflammation and mitochondrial dysfunction-related apoptosis in chondrocytes and ameliorates osteoarth-ritis[J].J Cell Physiol,2021,236(6):4369-4386.
[2] 王亮,张虎林,汪小敏,等.中药干预骨关节炎软骨细胞自噬的研究进展[J].风湿病与关节炎,2023,12(3):71-75.
[3] 谢新宇,梅阳阳,付长龙,等.乌头汤对脂多糖诱导大鼠软骨细胞炎症反应的影响[J].风湿病与关节炎,2020,9(3):1-5,11.
[4] 余光书,林焱斌,熊国胜,等.补骨颗粒含药血清对大鼠软骨细胞凋亡及Trx2信号通路的影响[J].中国骨质疏松杂志,2019,25(6):753-757.
[5] YU GUANG-SHU,LIN YAN-BIN,XU HONG-BIN,et al.Effect of Bugu Granules in a drug-containing serum on chondrocyte apoptosis and the Trx2 signaling path-way[J].Z Rheumatol,2020,79(3):304-311.
[6] 贲长恩.医学科研思路方法与程序[M].北京:人民卫生出版社,2009:162.
[7] 张灵娜,林兵,宋洪涛.中药血清药理学、血清药物化学的研究概况及展望[J].中草药,2015,46(17):2662-2666.
[8] 余光书,乐立盛,卓杰,等.补骨颗粒治疗骨关节炎慢性疼痛的机制研究[J].风湿病与关节炎,2019,8(3):33-37.
[9] CHEN CHAOFEI,CHEN HAIXUAN,ZHOU HUANJIAO JENNY,et al.Mechanistic role of thioredoxin 2 in heart failure[J].Adv Exp Med Biol,2017,982(1):265-276.
[10] SCALCON VALERIA,BINDOLI ALBERTO,RIGOBELLO MARIA PIA,et al.Significance of the mitochondrial thioredoxin reductase in cancer cells:an update on role,targets and inhibitors[J].Free Radic Biol Med,2018,127(1):62-79.
[11] YAN JD,XU J,FEI Y,et al.TrxR2 deficiencies promote chondrogenic differentiation and induce apoptosis of chondrocytes through mitochondrial reactive oxygen species[J].Exp Cell Res,2016,344(1):67-75.
[12] LI FENGBO,SUN XIAOLEI,MA JIANXIONG,et al.Naringin prevents ovariectomy-induced osteoporosis and promotes osteoclasts apoptosis through the mitochondria-mediated apoptosis pathway[J].Biochem Biophys Res Commun,2014,452(3):629-635.
[13] PAN LIANHONG,ZHANG YONGHUI,CHEN NA,et al.Icariin regulates cellular functions and gene expression of osteoarthritis patient-derived human fibroblast-like synoviocytes[J].Int J Mol Sci,2017,18(12):2656-2666.
[14] ZHENG YS,WU ZS,NI HB,et al.Codonopsis pilosula polysaccharide attenuates cecal ligation and puncture sepsis via circuiting regulatory T cells in mice[J].Shock,2014,41(3):250-255.
[15] ZHOU LINGLING,ZHOU CONG,FENG ZHE,et al.
Triptolide-induced hepatotoxicity can be alleviated when combined with Panax notoginseng saponins and Catapol[J].J Ethnopharmacol,2018,214(1):232-239.
[16] ZHUANG CHAO,XU NAN-WEI,GAO GONG-MING,et al.Polysaccharide from Angelica sinensis protects chondrocytes from H2O2-induced apoptosis through its antioxidant effects in vitro[J].Int J Biol Macromol,2016,87(1):322-328.
收稿日期:2023-07-11;修回日期:2023-08-20
