Lnc-FOXD3-AS1通过激活SMAD1/5/8促进缺铁性贫血大鼠体内Hepcidin表达
2024-01-07安媛媛安林籍雁敏热西丹阿布力海提木尼热买买提尼牙孜佐日汗艾依萨
安媛媛·安林, 籍雁敏, 热西丹·阿布力海提, 木尼热·买买提尼牙孜, 佐日汗·艾依萨
(1.新疆医科大学第七附属医院儿科, 新疆 乌鲁木齐 830000 2.新疆医科大学第二附属医院儿科, 新疆 乌鲁木齐 830000)
缺铁性贫血(IDA)是一种常见且危害性大的疾病,可引起人体血液中血红蛋白含量的显著下降,导致贫血、晕厥和易怒等病症[1-2]。研究表明,IDA与Hepcidin的缺乏有关,Hepcidin是由HAMP基因编码,由肝细胞产生的多肽激素,当Hepcidin被释放到循环系统中,可与十二指肠肠细胞和脾脏巨噬细胞相互作用,从而直接降解铁转运蛋白,从而减少铁转运蛋白表达[3]。研究表明,Hepcidin与铁蛋白、铁和血红蛋白的水平呈显著正相关,而且Hepcidin可作为IDA的生物学标志物[4]。然而,体内Hepcidin的水平受何种机制调控还不清楚。小G蛋白信号传导蛋白1/5/8(SMAD1/5/8)属于SMAD蛋白家族,是一类关键的转录因子,其在细胞凋亡、血管生成、免疫反应、组织定位以及胚胎发育过程中发挥作用[5]。最近,有关Hepcidin调节机制的研究表明,SMAD1/5/8直接参与了Hepcidin表达的调节,当激活SMAD1/5/8信号后肝细胞中的Hepcidin表达显著上调[6]。另外,SMAD1/5/8在上游受到多种长链非编码RNA(lncRNA)的调控[7]。lncRNA是一种转录长度超过200nt的非编码RNA,不仅广泛表达于IDA患者体内,而且靶向转录因子、激活因子、抑制因子等多种基因,调控基因的转录表达,参与多种疾病的发生和发展[7]。lncRNA已被多次报道调控铁的代谢,还能参与调控肝细胞的损伤,并与Hepcidin的表达密切相关[8]。叉头基因结构域同源蛋白D3长链非编码RNA1(lnc-FOXD3-AS1)是一种新报道的lncRNA,密切参与多种细胞的增殖、凋亡、炎症损伤和并调节细胞中SMAD1/5/8信号的表达。然而,目前并不清楚lnc-FOXD3-AS1对IDA和Hepcidin的调控作用。本文旨在研究lnc-FOXD3-AS1对IDA大鼠Hepcidin调控作用并探讨了潜在机制。
1 材料与方法
1.1实验动物与分组:雄性SD大鼠体重为200±15g,共50只,购自新疆医科大学实验动物中心,饲养条件为温度22±2℃,湿度60 5%,日/夜周期为12h。大鼠随机数字表法分为5组。包括对照组,IDA组,IDA大鼠经100μg/kg lnc-FOXD3-AS1过表达载体(静脉注射)治疗组(pcDNA-FOXD3-AS1+IDA组)、IDA大鼠经过表达空载体(100μg/kg静脉注射)治疗组(pcDNA-null+IDA组)、IDA大鼠经pcDNA-FOXD3-AS1联合Smad1/5/8的激活抑制剂Compound C(25mg/kg,静脉注射)治疗组(pcDNA-FOXD3-AS1+Compound C+IDA组),每组n=10。IDA组以玉米淀粉为主要成分配制一种低铁饲料喂养联合眼眶静脉重复放血建立IDA大鼠模型。低铁饲料配方:玉米淀粉99%,盐0.7%,混合维生素0.1%,微量元素0.1%,氯化胆碱约0.1%,原子吸收光谱法测定铁含量为10.1mg/kg。采用低铁饲料配合每隔1d眶静脉重复放血,连续14d,建立实验性IDA模型。大鼠从无铁装置中获得食物和蒸馏水,该装置用于防止从水中摄入外来铁。整个实验过程严格控制,避免铁污染。将正常饲料喂养的大鼠分为对照组。pcDNA-FOXD3-AS1+IDA组、pcDNA-null+IDA组、pcDNA-FOXD3-AS1+Compound C+IDA组大鼠药物干预与造模开始同步,每隔1d静脉注射1次,连续14d。14d后用含乙二胺四乙酸真空管收集各组血液,安乐死大鼠收集肝脏组织,保存6只新鲜肝脏组织用于western blot和qRT-PCR检测,剩余4只肝脏组织片制作冷冻切用于免疫荧光化学检测。
1.2酶联免疫吸附实验:取各组血清,12000rpm/min离心10min,然后在20℃下保存直至分析。根据制造商说明书(美国USCN Life公司),用酶联免疫吸附实验(ELISA)测定血清和肝脏研磨后中Hepcidin水平。并使用原子吸收光谱仪(美国VARIAN公司,AA-240 FS型)测定血清中铁含量。
1.3qRT-PCR检测Lnc-FOXD3-AS1的表达:用TRIzol regent(美国Invitrogen公司)从组织或血清中提取总RNA。通过分光光度法测定RNA的浓度和纯度,并使用PrimeScript RT逆转录酶试剂试剂盒(日本Takara公司)按照制造商的方案合成互补DNA。qRT-PCR分析使用SYBR Premix Ex Taq试剂盒(日本Takara公司)和StepOnePlus实时PCR系统(美国Applied biosystems)进行。LncRNA HAGLR表达以GAPDH为内参基因,用ΔΔCt法测定基因的相对表达量。目的基因引物由上海生工生物技术有限公司设计。引物序列如下(5’-3’):lnc-FOXD3-AS1 正向5'- ACCAGAGGAAGGAGCACGA-3';反向5'-AGAAGCACCACTGTCCATCC-3';;GAPDH 正向5'-AGAAGGCTGGGGCTCATTTG-3',反向 5'-AGGGGCCATCCACAGTCTTC-3'。相对定量使用2-ΔΔCT方法。
1.4Western blot检测肝脏组织中Hepcidin和SMAD1/5/8的表达:制备肝组织裂解物:切碎的肝脏样品在含1% NP-40、1mg/mL pepstatin、1mg/mL leupeptin、1mg/mL抑肽蛋白和100mg/mL苯基甲基磺酰的1mL TBS(pH 7.5)缓冲液中裂解。在4℃,12000g离心15min,收集上清液。蛋白浓度由Bio-Rad试剂盒(上海碧云天生物公司)进行检测。用10%十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)检测细胞总蛋白,并将其电印迹到硝化纤维膜上(英国Amersham Pharmacia Biotech公司)。将膜用5%的脱脂牛奶封闭2h,然后在4℃下与一抗孵育10h。免疫复合物用辣根过氧化物酶偶联的抗兔IgG抗体(1∶5000)孵育。最后,使用Western-Light化学发光检测系捕获蛋白信号表达。所有实验均重复3次。抗体浓度为Hepcidin(1∶1000)、SMAD1/5/8(NB100-56656,1∶800)、磷酸化的SMAD1/5/8(Ser463/465)(AB3848,p-SMAD1/5/8)(1∶500)。
1.5肝脏组织免疫荧光化学法检测Hepcidin和SMAD1/5/8的表达:对肝组织的冷冻切片进行免疫染色,在pH为6.0的柠檬酸中进行热介导抗原回收,并用10%的BSA进行封闭。将载玻片与Hepcidin的抗体孵育,并用Alexa Fluor 594偶联抗兔抗体和Fluor 488偶联抗小鼠抗体标记。用DAPI (美国Sigma公司)对细胞核进行染色,用共聚焦镜(德国蔡司公司)捕获免疫荧光信号。

2 结 果
2.1IDA大鼠体内铁含量和Hepcidin、lnc-FOXD3-AS1和SMAD1/5/8的表达变化:与对照组比,IDA组中大鼠肝脏组织和血清中铁含量明显降低(均P<0.05),而且外周血HGB含量仅为78.29±5.26g/L。见表1。表明大鼠IDA模型建立成功。与对照组比,IDA组中Hepcidin、lnc-FOXD3-AS1和SMAD1/5/8的表达水平都显著降低(均P<0.05),另外肝脏组织中SMAD1/5/8的磷酸化水平也显著降低(P<0.05),见图1和表2。
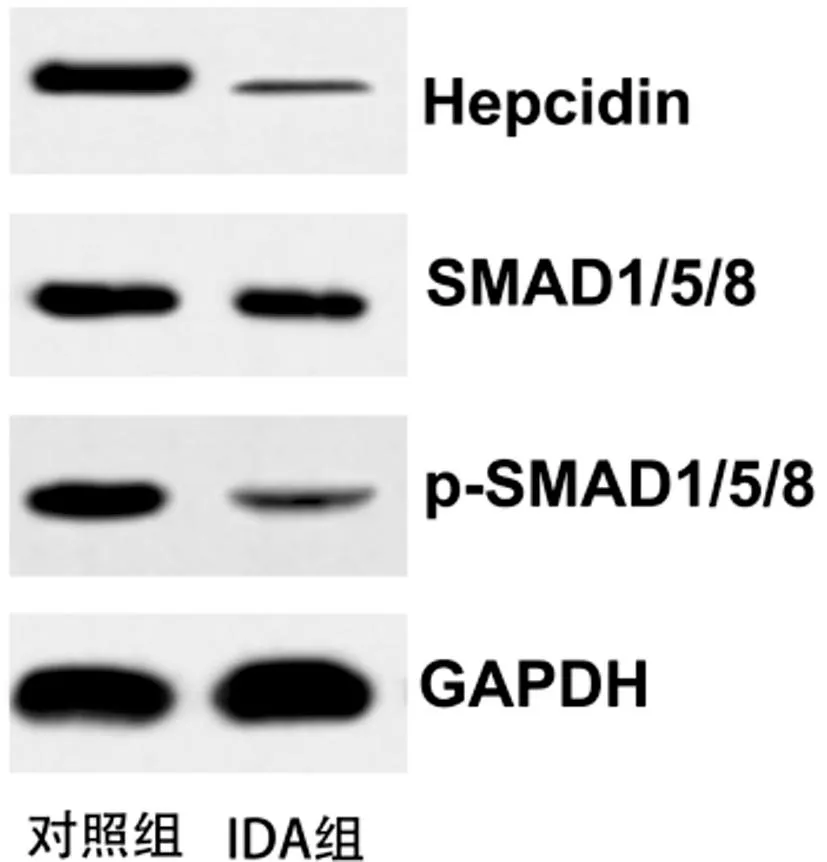
图1 大鼠肝脏中Hepcidin和SMAD1/5/8蛋白表达

表1 大鼠肝脏铁和血清铁以及血红蛋白中含量

表2 大鼠肝脏中Hepcidin lnc-FOXD3-AS1和SMAD1/5/8的相对表达
2.2过表达lnc-FOXD3-AS1增加IDA大鼠肝脏和血清中的Hepcidin表达:与pcDNA-null+IDA组比,pcDNA-FOXD3-AS1+IDA组肝脏组织和血清的lnc-FOXD3-AS1表达显著升高,而且Hepcidin蛋白表达水平也显著升高(均P<0.05)。见图2和表3。

图2 大鼠肝脏中Hepcidin的表达
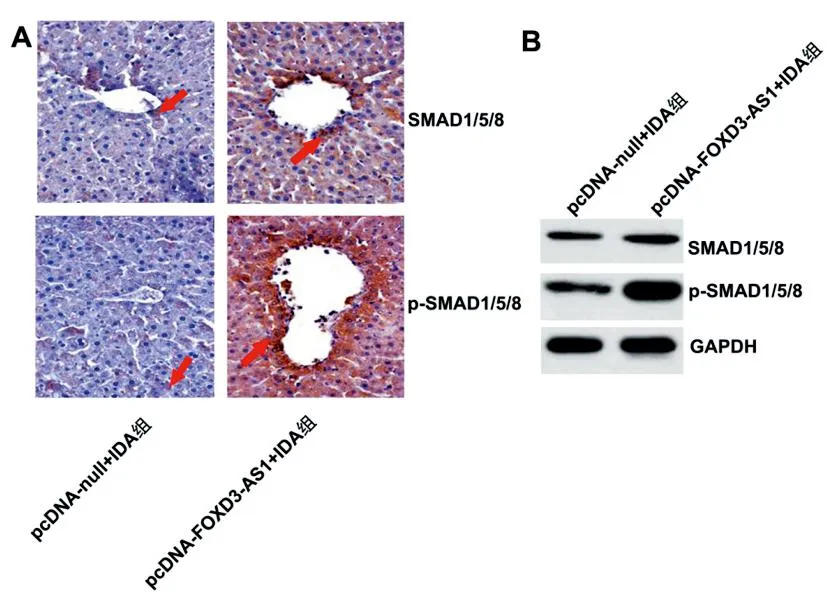
图3 大鼠肝脏中SMAD1/5/8的表达

图4 过表达lnc-FOXD3-AS1通过激活SMAD1/5/8促进体内Hepcidin表达
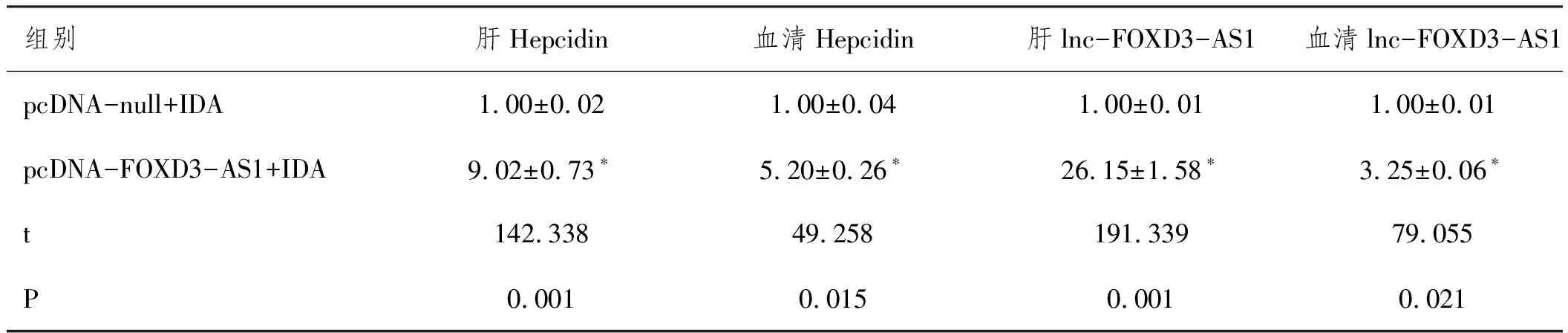
表3 大鼠肝脏和血清中Hepcidin蛋白和lnc-FOXD3-AS1的相对表达
2.3过表达lnc-FOXD3-AS1激活IDA大鼠肝脏中SMAD1/5/8的信号:与pcDNA-null+IDA组比,pcDNA-FOXD3-AS1+IDA组的肝脏组织SMAD1/5/8的表达水平显著升高(均P<0.05),而且SMAD1/5/8的磷酸化水平明显升高(P<0.05),见图3A-3B和表4。
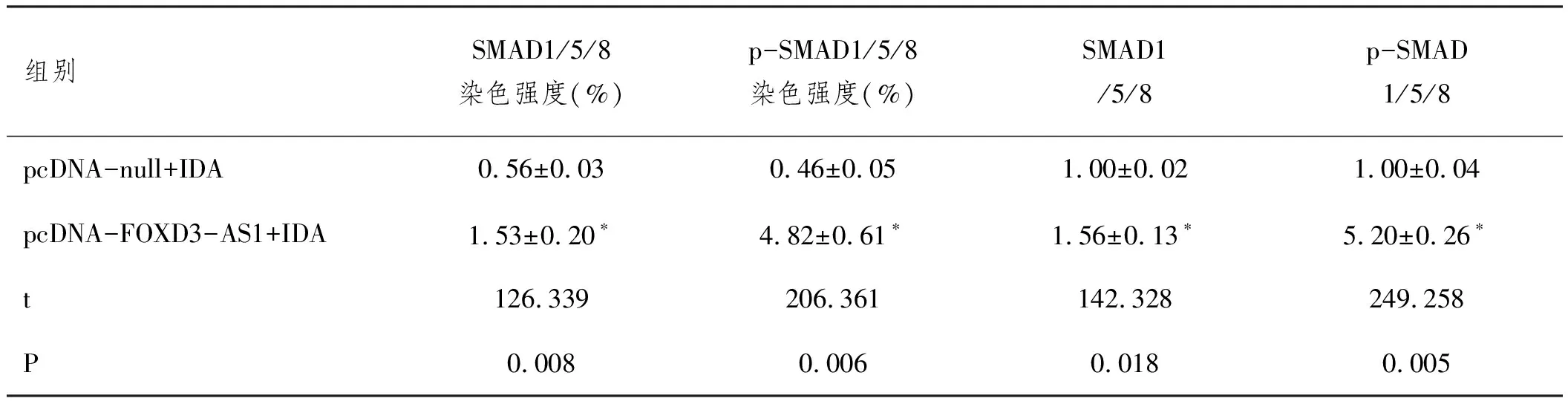
表4 大鼠肝脏组织中的SMAD1/5/8的免疫染色强度和相对表达
2.4过表达lnc-FOXD3-AS1通过激活SMAD1/5/8促进体内Hepcidin表达:与pcDNA-FOXD3-AS1+IDA组比,pcDNA-FOXD3-AS1+Compound C+IDA组的SMAD1/5/8的磷酸化水平明显降低(P<0.05),说明SMAD1/5/8的激活被抑制。同时与pcDNA-FOXD3-AS1+IDA组比,pcDNA-FOXD3-AS1+Compound C+IDA组肝脏组织和血清中Hepcidin表达量明显减少(均P<0.05)。见图4,表5和表6。

表5 大鼠肝脏组织中的SMAD1/5/8的免疫染色强度和相对表达

表6 大鼠体内Hepcidin的免疫染色强度和相对蛋白水平
3 讨 论
Hepcidin是全身铁平衡的主要调节因子,而SMAD通路是肝脏中Hepcidin表达的中心调节因子[9]。研究表明,SMAD/Hepcidin轴在调控Hepcidin对铁的反应中起关键作用,当组织铁负荷增加激活肝内皮细胞中的骨形态发生蛋白6并启动信号级联反应,从而激活转录因子SMAD1/5/8,使SMAD1/5/8转位到细胞核中进行Hepcidin的转录[9]。然而,铁缺乏调节肝脏SMAD信号通路以控制Hepcidin表达的机制尚不完全清楚。本研究发现在肝细胞中FOXD3-AS1是一种新型SMAD信号和Hepcidin表达的调节因子,从而在改善缺铁性疾病的治疗具有重要意义。
本研究利用缺铁饮食和放血诱导后,可同时显著下调肝脏中lnc-FOXD3-AS1的表达、Hepcidin和SMAD1/5/8的表达,而当过表达lnc-FOXD3-AS1后,肝组织和血清Hepcidin表达均明显上调,肝组织中SMAD1/5/8、p-SMAD1/5/8的表达也上调。表明lnc-FOXD3-AS1促进了Hepcidin介导的铁代谢并激活了SMAD1/5/8信号。已知铁代谢和非编码RNA之间有密切关系,例如lncRNA核富集的转录物1可以直接通过分子海绵作用调控血清中Hepcidin的表达[8]。另外,miRNA-122也被证实可以靶向调控SMAD信号通路从而调控肝细胞中骨形态发生蛋白6依赖的Hepcidin的转录[10]。重要的是,本研究证明了一个新的潜在候选标志物,lnc-FOXD3-AS,其在IDA大鼠体内下调,而过表达lnc-FOXD3-AS1后大鼠的铁代谢标志物Hepcidin有明显的上调,表明lnc-FOXD3-AS1在IDA治疗中具有激活SMAD1/5/8信号的作用和促进铁生成的作用。
SMAD1/5/8是SMAD蛋白家族关键高度同源的转录因子簇,SMAD1/5/8蛋白分子量一致,其功能目前尚不完全清楚,但是已知的是其在细胞生长、分化、程序性死亡、衰老以及发育过程中均扮演重要角色[5]。研究表明,当SMAD1/5/8信号被外界信号激活,可以明显促进肝细胞中Hepcidin蛋白表达[6]。另外,在甲状腺癌中SMAD1/5/8的直接上游调控因子是lnc-FOXD3-AS1以及miRNA-296-5p,从而参与调控了癌细胞的增殖、凋亡以及迁移等生物学功能。本研究在IDA大鼠肝组织中发现SMAD1/5/8活性被抑制,当给予lnc-FOXD3-AS1过表达质粒治疗后又进一步显著激活了SMAD1/5/8,包括SMAD1/5/8的蛋白表达被上调,其Ser463/465位点磷酸化水平显著性上调,此过程还伴随了铁代谢标志物Hepcidin的表达增加。
为了更进一步明确lnc-FOXD3-AS1过表达介导的SMAD1/5/8激活与Hepcidin的表达增加有关,我们在lnc-FOXD3-AS1过表达的基础上使用了SMAD活化抑制剂进行干预,结果表明Ser463/465位点的磷酸化水平被compound C显著抑制,而同时我们也观察到Hepcidin的表达受到抑制,这些结果均在lnc-FOXD3-AS1过表达的条件下实现,表明lnc-FOXD3-AS1过表达可以通过激活SMAD1/5/8促进Hepcidin的表达。已证实compound C可以有效地抑制骨形态发生蛋白6介导的SMAD1/5/8的磷酸化[11],这支持了我们的研究结果,25mg/kg compound C静脉注射能显著抑制SMAD1/5/8的激活从而抑制了Hepcidin的表达,表明compound C抑制SMAD1/5/8的激活能逆转lnc-FOXD3-AS1过表达的作用从而减少IDA的铁代谢。以上研究结果均提示lnc-FOXD3-AS1扮演了SMAD1/5/8的激活信号,从而通过促进Hepcidin的表达改善了IDA中铁代谢受限。
综上所述,本研究证明低铁饮食和放血诱导的IDA大鼠体内lnc-FOXD3-AS1发生下调,而过表达lnc-FOXD3-AS1可以通过激活SMAD1/5/8促进Hepcidin的表达。我们认为,lnc-FOXD3-AS1-SMAD1/5/8-Hepcidin途径可能是调控IDA发生的一种新型生物学网络。本研究深化了我们对IDA发生的生物学网络机制的理解,对于开发针对IDA的治疗策略具有重要意义。
