NLRC3参与的肿瘤免疫机制在子宫内膜异位症发病中的作用
2024-01-07郝梦启姬佩雲高秀娟庄新荣张桂香张雅丽
郝梦启, 姬佩雲, 高秀娟, 庄新荣, 张桂香, 张雅丽
(承德医学院附属医院妇科, 河北 承德 067000)
子宫内膜异位症是慢性炎症性良性妇科疾病,具有恶性肿瘤的特点,且EMT患者罹患癌症风险较高[1]。目前人们对这种疾病的病因解释不明确,免疫失衡现被提出以解释异位子宫内膜组织的起源[2]。NLRC3是先天免疫细胞炎症信号通路的负调控因子,发挥免疫监视作用,参与自身免疫调节及肿瘤的发生发展。目前NLRC3在EMT患者中的表达研究较少。本研究通过比较Ⅲ期、Ⅳ期EMT患者卵巢异位内膜组织和正常子宫内膜组织中NLRC3的表达水平,进一步讨论其在EMT发生发展中的作用。
1 资料与方法
1.1一般资料:收集承德医学院附属医院2020年12月至2022年4月进行手术的卵巢子宫内膜异位症患者。纳入标准:患者经组织病理学诊断为卵巢EMT,年龄26~48岁。排除标准:经性激素类药物治疗的患者,患有自身免疫性疾病、免疫缺陷性疾病、急慢性炎症、恶性肿瘤的患者。EMT患者按照美国生殖医学学会(American Society for Reproductive Medicine,ASRM)关于子宫内膜异位症的分期(rASRM分期)分为:Ⅲ 期17例,年龄24~45岁,平均(35.4±6.2)岁;Ⅳ期17例,年龄26~48岁,平均(36.2±6.4)岁。痛经NRA评分标准:0分:无痛经;1~3分:轻微痛经;4~6分:严重痛经,尚能忍受;7~10分:严重痛经,需口服止痛药物。同时收集17例因异常子宫出血行诊断性刮宫或因子宫肌瘤行子宫切除患者的子宫内膜作为对照组,经组织病理学诊断为正常子宫内膜组织,年龄25~42岁,平均(33.7±4.8)岁。三组间年龄差异无统计学意义(P>0.05)。收集的组织一部分置入4%多聚甲醛固定,剩余组织用0.9%生理盐水冲洗后置入液氮中。
1.2主要试剂:SuPerbrilliant 6min高纯RNA提取试剂盒购于中实基因科技有限公司。FastKing cDNA第一链合成试剂盒、SuperReal PreMix Plus试剂盒均购于天根生物科技有限公司。BCA蛋白浓度测定试剂盒购于北京Solarbio科技有限公司。NLRC3蛋白抗体购于美国NOVUS生物技术公司。GAPDH抗体及山羊抗兔荧光二抗来自于ABclonal生物公司。免疫组化试剂盒和DAB显色剂来自于北京中杉金桥生物技术公司。
1.3方 法
1.3.1免疫组化:所取组织经石蜡固定包埋,柠檬酸盐(pH=6.0)修复液进行抗原修复,内源性过氧化物酶阻断剂孵育10min,封闭用山羊血清工作液进行封闭,37℃孵育20min,一抗(浓度为1∶50)孵育过夜,37℃孵箱复温45min,二抗孵育20min,显色剂显色,苏木素复染1min,1%盐酸酒精分化30s,树胶封片。
1.3.2Western Blot:高效RIPA裂解液提取组织获得总蛋白,用BCA法对总蛋白进行定量检测,取等量蛋白进行SDA-PAGE,分离胶浓度(10%),浓缩胶电泳80V 20min,分离胶电泳110V,按marker和loading buffer位置停止电泳。300mA恒流转膜2.5h。5%脱脂奶粉封闭1h,加入NLRC3抗体(1∶100),4℃冰箱孵育过夜,加入二抗,室温孵育1h(GAPDH抗体,1∶5000)。使用扫描仪扫描目的条带。
1.3.3qRT-PCR:采用SuPerbrilliant 6min高纯RNA提取试剂盒提取组织中的RNA。在Nanodrop RNA定量测定仪中检测样品的OD值,要求1.8≤A260/A280≤2.0且1.8≤A260/A230≤2.3,间接计算出样品中RNA含量以进行下一步实验。根据Fastking一步法除基因组cDNA第一链合成预混试剂盒进行操作,条件:42℃ 2min,95℃ 3min。SupperRead荧光定量预混试剂按照说明进行PCR反应,反应体系:20μL。条件:95℃ 10min预变性,95℃ 15s,60℃ 1min,72℃ 30s进行45个循环。β-actin作为内参,测量每个样品的CT值,每个样品设置3个复孔,记录并统计获得的结果,计算目的基因在各组组织中相对于内参的表达量Q。Q=2-ΔΔCT,△Ct目的基因= Ct目的基因-Ct β-actin基因,△△Ct=△Ct-Ct mean值(对照组平均值)。各引物序列如下:
β-actin F:5ˊ-CACCATTGGCAATGAGCGGTTC-3ˊ
R:5ˊ-AGGTCTTTGCGGATGTCCACGT-3ˊ
NLRC3 F:5ˊ-TGGCAGTGAGAGAAAACCGCAC-3ˊ
R:5ˊ-CTAAGCTGGTGAGGCTCCTGTT-3ˊ
1.3.4免疫组化结果判读:由经验丰富的病理科医师采用双盲法对染色结果阅片。NLRC3表达的评分标准:每张切片随机观察5个高倍视野(×400),根据阳性细胞着色强度及染色面积进行评分。着色强度:无染色0分,浅黄色1分,棕黄2分,棕褐色3分。着色面积:<30%评1分,30%~60%评2分,>60%评3分。两项相加结果:0分为阴性(-),1~2分为弱阳性(±),3~4分为阳性(+),5~6分为强阳性(++)。阴性及弱阳性均视为阴性,阳性及强阳性均视为阳性进行组间比较。

2 结 果
2.1NLRC3在正常子宫内膜组、Ⅲ期EMT、Ⅳ期EMT中的表达:免疫组化结果显示,NLRC3阳性表达主要位于细胞浆,胞核及间质中无表达或较少表达。正常子宫内膜、Ⅲ期EMT、Ⅳ期EMT组中NLRC3蛋白阳性表达率分别为:76.5%(13/17)、23.5%(4/17)、29.4%(5/17),差异有统计学意义(P<0.05)。免疫组化、Western Blot、qRT-PCR结果均显示:与正常子宫内膜组相比,NLRC3表达水平在Ⅲ期、Ⅳ期EMT组中均降低,差异有统计学意义(P<0.0125)。NLRC3的表达在Ⅲ期、Ⅳ期EMT组中差异无统计学意义(P>0.05)(图1、2、3,表1、2)。

图1 免疫组化结果:NLRC3在各组中的表达(放大倍数:400×);A:正常子宫内膜;B:Ⅲ期EMT;C:Ⅳ期EMT
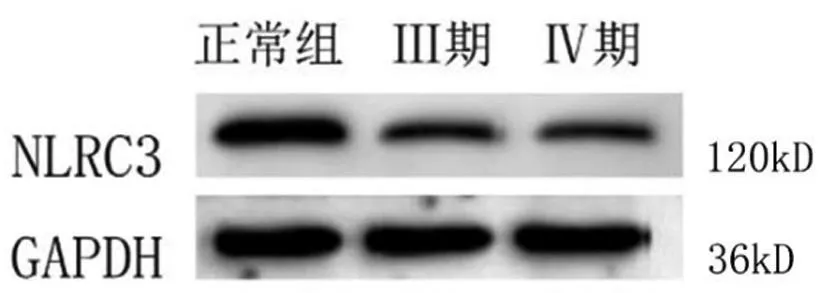
图2 Western Blot结果:各组中NLRC3的相对表达量
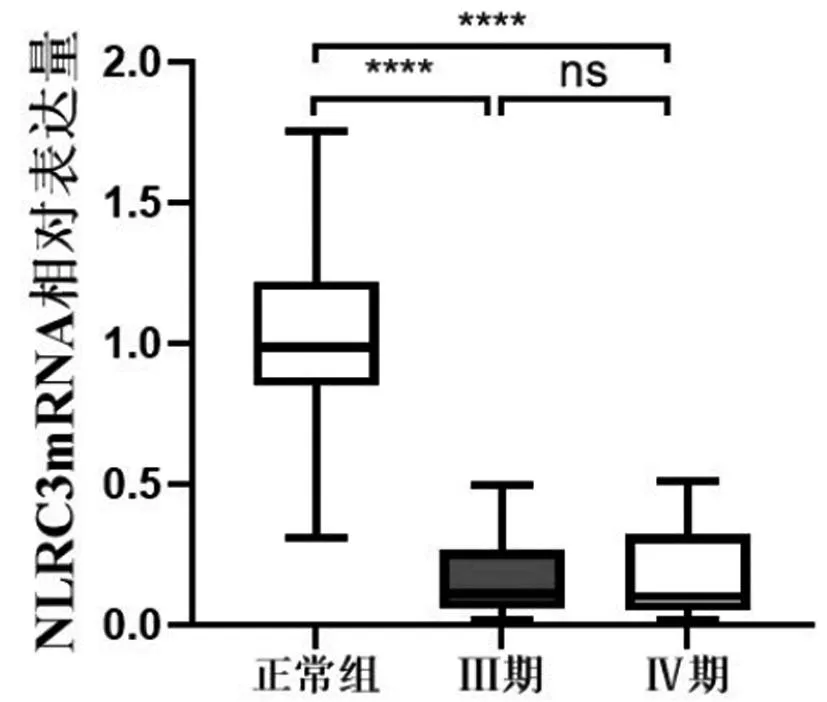
图3 各组中NLRC3mRNA的相对表达量

表1 Western Blot结果:NLRC3在各组中的相对表达量
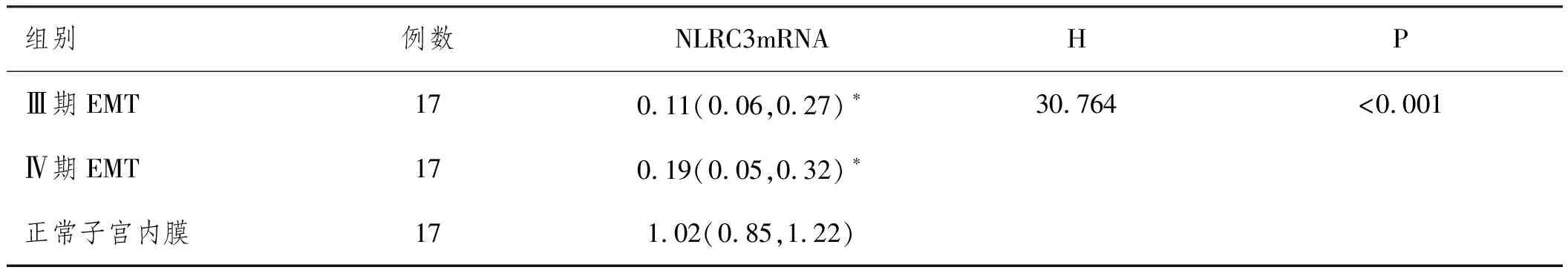
表2 各组中NLRC3mRNA的相对表达量[M(P25,P75)]
2.2NLRC3表达与EMT患者临床病理特征的关系:病理切片分析显示:不同年龄、不同分期、不同病灶大小、不同痛经程度EMT患者中NLRC3阳性表达差异无统计学意义(P>0.05);CA125水平高者NLRC3表达阳性率更低(P<0.05),见表3。

表3 NLRC3表达与临床病理特征的关系n(%)
3 讨 论
据统计,全世界约有1.76亿女性患有EMT,其被认为是免疫相关的慢性炎症性妇科良性疾病[3]。有关EMT的发病机制,已有许多学者提出相关假说,但均不能单独解释EMT的发生。研究显示,EMT患者腹腔微环境中某些免疫信号通路及免疫细胞(如巨噬细胞、调节性T细胞、辅助性T细胞1(Th1)、辅助性T细胞17(Th17)、腹膜液中多种炎症介质和生长因子等)的水平都发生了改变[4-5]。因此,EMT的发生可能与腹腔微环境免疫失衡有关。
核苷酸结合结构域和富含亮氨酸的重复性家族(NLR)蛋白是先天性免疫传感器,可识别高度保守的病原体相关分子模式(PAMPs)。NLRC3是NLR家族中新发现且特征不完全的成员,其在T淋巴细胞中高表达,负调控炎症信号通路。NLRC3在多种自身免疫性疾病及炎症相关性肿瘤中异常表达,它可能是治疗驱动自身免疫性疾病的适应性免疫反应的潜在靶标,也能通过调节某些信号通路抑制肿瘤细胞增殖、迁移和侵袭。Uchimura等[6]认为NLRC3对T淋巴细胞的抑制作用是适度的,其微调自身免疫反应,在病灶微环境中发挥免疫监视的作用。Fu等[7]发现,NLRC3降低了树突状细胞(DC)的抗原呈递功能及其激活和促进CD4+T细胞分化为Th1和Th17亚群的能力,NLRC3的缺失促进致病性Th1和Th17的反应,从而罹患自身免疫性脑脊髓炎(EAE)。因此,靶向治疗NLRC3可以作为减轻T细胞介导的炎症性疾病或自身免疫性疾病的治疗策略。Kang等[8]通过敲低NLRC3证实肝细胞癌细胞系HuH-7细胞凋亡被抑制,促进肝细胞癌细胞的增殖、迁移和侵袭。Karki等[9]在结肠炎相关结肠肿瘤小鼠模型中的研究中首次证实了NLRC3表达缺陷的小鼠易发生结肠炎症,持续存在的炎症最终导致结肠癌发生。因此,靶向治疗NLRC3可以作为抑制肿瘤细胞增殖的治疗策略。
目前关于NLRC3在EMT患者发生发展中的作用以及具体机制研究尚少。Suryawanshi等[10]报道称EMT患者的病变具有独特的免疫微环境,类似于肿瘤样炎症的特征。EMT类似肿瘤的特点,如增殖、浸润及远处转移等,也提示其与肿瘤的发生过程有一些相同特征。正常情况下,自身免疫系统发挥免疫监视作用,识别、杀伤并及时清除突变细胞。当宿主免疫监视功能低下或受到抑制时,肿瘤细胞发生免疫逃逸,促进肿瘤细胞生长和转移。卵巢异位子宫内膜的种植涉及机体炎症、免疫及类似肿瘤的过程,炎症和免疫反应可促进肿瘤的发生、生长和进展,免疫系统的抗肿瘤形成功能发挥了对肿瘤异质性的免疫监视作用[11]。因此推测NLRC3在EMT免疫失衡中发挥了重要作用。本实验检测了NLRC3在正常子宫内膜组织及Ⅲ期、Ⅳ期EMT异位内膜组织中的表达情况。免疫组化、WB、qRT-PCR结果均显示NLRC3在Ⅲ期、Ⅳ期EMT中表达水平显著低于正常子宫内膜组。进一步分析NLRC3在Ⅲ、Ⅳ期EMT组织中的表达,结果显示不同分期中NLRC3的表达差异无统计学意义。我们目前的研究仅限于Ⅲ~Ⅳ期EMT患者,收集的Ⅰ~Ⅱ期EMT患者例数不足以进入分组,而Ⅲ、Ⅳ期EMT卵巢异位子宫内膜中的免疫反应及炎性反应差异可能不明显。因此,需要增加Ⅰ期、Ⅱ期的患者标本,以进一步挖掘不同病变等级EMT和NLRC3表达之间可能存在的关系。
因此,NLRC3代表的免疫监视功能的下调可能参与了EMT腹腔微环境免疫失衡状态。人体内辅助性T细胞(Th1、Th17)和Treg细胞的平衡可以清除外来微生物,从而避免机体发生感染或病变。当患者腹腔微环境NLRC3表达减少或缺乏时,其激活和极化CD4+T细胞为Th1和Th17亚群的能力下降,使EMT腹腔微环境中辅助性T细胞(Th1、Th17)和Tregs处于免疫失衡状态,从而减少异位子宫内膜的清除,使异位子宫内膜发生免疫逃逸,进而导致EMT的发生发展。本研究发现,EMT中CA125水平高者的NLRC3表达阳性率更低,在EMT发生发展过程中,NLRC3是极具潜力的一个指标,同时,联合检测CA125和NLRC3的表达可能为预测或诊断EMT发挥良好的作用,本研究的不足之处在于仅限于检测EMT患者卵巢异位子宫内膜组织中NLRC3的表达,而缺少血清学方面的检验,需要在后续的实验中进一步完善,以评估其在临床诊断治疗中的相关潜力。
综上所述,子宫内膜异位症的发病与腹腔微环境免疫失衡有关,NLRC3代表的免疫监视功能下降或缺失可能参与EMT的发生发展,但其确切的机制有待深究。联合检测CA125和NLRC3的表达可能为预测或诊断EMT发挥良好的作用。
