PPC/PBS 引导骨再生生物膜的制备及其理化性能和生物学特征评价
2024-01-05石晓璐翟少博储顺礼
石晓璐, 田 野, 翟少博, 刘 洋, 储顺礼
(吉林大学口腔医院种植科,吉林 长春 130021)
外伤、先天畸形、肿瘤术后和废用性萎缩等原因导致的牙槽骨水平及垂直方向吸收在临床上较常见[1]。在口腔种植术中,充足的骨量可以提供良好的骨结合,从而使种植体获得足够的稳定性。引导骨再生(guided bone regeneration,GBR) 是重建牙槽骨和治疗种植体周围骨缺损最常用的方法之一[2-3],其原理是利用生物膜的物理屏障功能将病损区与周围组织隔离,创造相对封闭的组织环境,从而使特定组织的再生功能得到最大程度的发挥。因此,生物膜的应用在GBR 中起重要作用。目前市场上生物膜品牌众多,种类多样,但均存在部分缺陷,难以满足临床上包含水平和垂直等各种骨缺损条件下的骨增量需求。不可吸收性生物膜边缘易刺破黏膜造成生物膜暴露,引起软组织瓣裂开和感染,且通透性差,对血运有明显阻碍作用,不利于组织再生的营养供应[4-5];可吸收性生物膜硬度不足,无法支撑局部骨再生空间,影响骨再生效果,也存在吸收速率和屏障作用的匹配性问题。此外,可吸收性生物膜价格昂贵,品种单一,无法完全用于临床不同类型骨缺损的再生修复术等[4]。因此,研发同时具备良好的通透性、贴附可塑性、可吸收特性、支架作用和空间维持能力的复合型生物膜成为研究热点。
CO2共聚物具有良好的生物相容性和空间支撑能力,上述优点是其作为口腔生物屏障膜原材料的基础。聚碳酸1,2-丙二酯又称聚碳酸亚丙酯(poly propylene carbonate,PPC),由CO2和环氧丙烷共聚而成,属于CO2共聚物,其生物相容性好,可被微生物分解[6-7]。PPC 具有无污染、可降解、良好的生物相容性、温度记忆性和高阻隔性等优点。研究[8]将PPC 制作成支架材料,与骨髓间充质干细胞进行共培养,细胞生长入支架的三维结构中,证实PPC 材料可与骨髓间充质干细胞紧密结合,同时也具备良好的空间支架作用。聚丁二酸丁二醇酯(poly butylene succinate,PBS) 具有高度疏水的链结构,降解速率较慢,可完全生物降解且产物无毒,常作为药物缓释载体应用于生物医学领域[9-11]。PPC 和PBS 价格优廉、成品可吸收、空间支撑能力强和厚度较低,可弥补市售生物膜的部分缺陷。近年来PPC 材料逐渐应用于口腔医学领域[12],但将PPC 和PBS 应用于口腔种植领域的研究尚未见报道。
本研究将PPC 与PBS 共混,采用盐析法制备与人体骨外膜结构相仿且由致密的光滑面层和多孔状的粗糙面层组成的PPC/PBS 生物膜,评估其理化性能和生物学特征,为新型GBR 生物膜的临床研究和应用提供参考。
1 材料与方法
1.1 实验动物、主要试剂和仪器3 d 龄SD 乳鼠,实验动物生产许可证号:SCXK(吉)2008-0005;健康成年日本大耳白兔6 只,体质量2.5 kg,雌雄不限,实验动物生产合格证号:SCXK(吉)2008-0005,均购于吉林大学实验动物中心。PPC 的数均相对分子质量为43 000,由内蒙古蒙西高新技术集团公司生产,PBS 的数均相对分子质量为103 000(日本Showa 公司),氯仿为分析纯(天津新通精细化工有限公司),氘代氯仿(deuterated chloroform,DCCL3)(上海默克化工技术有限公司),DMEM细胞培养液(美国Gibco 公司),标准胎牛血清(奥地利PAA 公司),胰蛋白酶(上海化学试剂厂),BME-10X 胶原膜(福建省博特生物科技有限公司),多聚甲醛(北京化学工业集团有限责任公司),碱性磷酸酶(alkaline phosphatase,ALP)试剂盒(南京建成生物工程研究所),速眠新Ⅱ注射液(吉林省军事医学科学院兽医研究所),利多卡因(上海朝晖药业有限公司),灭菌注射用水(天津药业集团新郑股份有限公司)。磁力搅拌器(郑州南北仪器设备有限公司),场发射环境扫描电子显微镜(型号XL30,美国FEI 公司),GPC 凝胶渗透色谱仪(型号Waters/1515,美国Waters 公司),电液伺服实验系统(型号MTS 810,美国MTS 系统公司),多功能电子拉伸实验机(型号Z010,德国Zwick 公司),视频光学接触角测量仪(型号OCA20,德国Dataphysics 公司),激光共聚焦显微镜(型号OLS3000) 和倒置显微镜(日本OLYMPUS 公司), CO2细胞培养箱 (日本SANYO 公司),恒温水浴振荡器(型号SHA-CA,江苏省常州荣华仪器制造有限公司)。
1.2 PPC/PBS 生物膜制备氯仿溶液中加入PPC和PBS,采用磁力搅拌器搅拌至PPC 与PBS 完全溶解,形成混浊液,倾倒入特制的容器中。随后加入食盐,搅拌使其均匀分布于混浊液中,在空气中静置24 h,挥发去除有机溶剂形成含食盐颗粒的生物膜,置于去离子水中漂洗1 周,每12 h 更换1 次去离子水,去除食盐,常温下干燥2 周,备用。采用能谱分析法测定PPC/PBS 生物膜表面和断面的钠和氯含量以明确食盐残余量。将PPC/PBS 膜置入DCCL3配制为0.1 g·L-1溶液,置入400 MHz 核磁共振仪中进行核磁共振氢谱(1H nuclear magnetic resonance spectra,1HNMR) 检测,观察并比较PPC/PBS、PPC 和PBS1HNMR 吸收峰,分析其共混前后化学结构变化。
1.3 扫 描 电 子 显 微 镜(scanning electron microscope,SEM)观察PPC/PBS 生物膜超微形态表现对生物膜样本进行喷金处理,采用SEM 观察生物膜光滑面、粗糙面和横断面超微形态表现并记录。
1.4 PPC/PBS 生物膜理化性能采用GPC 凝胶渗透色谱仪测定生物膜样本的数均相对分子质量、重均相对分子质量和聚合物分散性指数(ploymer dispersity index,PDI),根据生物膜多孔压缩前后体积变化计算孔隙率,测定3 个样本并计算平均值。孔隙率= [初始体积(cm3) -压缩后体积(cm3)]/初始体积(cm3)×100%。将“1.2”中制备的PPC/PBS 生物膜裁剪为与孔板底部大小相同的尺寸,制成生物膜样本。采用多功能电子拉伸实验机测定室温下生物膜样本的杨氏模量、断裂强度和断裂伸长率,拉伸速率为10 mm·min-1,测定5 个样本并计算平均值。杨氏模量(E) =应力(σ)/应变(ε);断裂强度(N) 为样本断裂时所承受的最大拉伸应力;断裂伸长率=断裂时标线间距离的增加量(mm)/初始标距(mm)×100%。采用OCA20 视频光学接触角测量仪测量PPC/PBS生物膜静态接触角的度数。滴加4 μL 蒸馏水,每个样本检测4 个点,点与点间距较远,以避免相互影响,测定3 个样本并计算平均值。
1.5 原代SD 乳鼠成骨细胞分离、培养和纯化采用酶消化法由乳鼠颅骨上提取原代成骨细胞,用含89% DMEM、10%胎牛血清和1%双抗的完全培养基混悬沉淀细胞,接种于培养瓶中,37 ℃、5% CO2培养箱中培养,7 d 后换液,以后每3 d 换液1 次,观察细胞的生长状况。待细胞铺满培养瓶80%后进行成骨细胞的纯化和传代。
1.6 生物膜成骨细胞接种实验接种实验分为对照组(未加生物膜)、BME-10X 胶原膜组和PPC/PBS 生物膜组,每组4 个平行试样。各组均设 1、3、7 和14 d 共 4 个观察时间点。将经环氧乙烷熏蒸消毒后的生物膜放入48 孔细胞培养板中,每孔加入1 片生物膜,使用高温高压消毒后的不锈钢结扎丝固定,加入DMEM 培养液200 μL,置于37 ℃、5% CO2培养箱内预浸泡2 h,吸弃浸泡材料的培养基。调整骨细胞悬液浓度,按照细胞浓度为每孔2.0×104个细胞的密度接种于孔内,置于细胞培养箱内培养,每3 d 换液1 次。
1.7 SEM 观察各组成骨细胞附着和生长情况取培养的第1、3、7 和14 天的样本,生理盐水冲洗2 次,3%戊二醛固定液4 ℃过夜,1%锇酸固定液中固定2 h, 30%、 50%、 70%、 80%、 90%、95%和100%梯度酒精脱水,真空干燥,表面喷金,采用SEM 观察成骨细胞在生物膜上的附着和生长情况。
1.8 细胞计数法检测各组材料表面附着成骨细胞数量将培养第 1、3、7 和14 天的各组样本由培养液中取出,采用生理盐水冲洗2 次,置入新的细胞培养板中,加入 0.2 mL、0.25%胰蛋白酶消化液消化4~5 min,加入1 mL DMEM 培养液终止消化,取10 μL 液体计数细胞并记录,不同培养时间各组材料表面附着成骨细胞数量变化代表细胞增殖情况。实验重复 3 次并取平均值。
1.9 ALP 试剂盒检测各组成骨细胞分化情况将培养第 1、3、7 和14 天的各组标本从培养液中取出,采用生理盐水冲洗2 次,置入新细胞培养板中,加入细胞裂解液100 μL 裂解10 min,按ALP试剂盒说明书操作要求,采用紫外分光光度仪检测PPC/PBS 生物膜组、BME-10X 胶原膜组和对照组吸光度(A) 值,以A 值代表各组细胞中ALP水平。
1.10 兔背部肌肉降解实验检测PPC/PBS 生物膜体内降解性能将PPC/PBS 生物膜剪切为长15 mm 和宽8 mm 的长方形试样,75%酒精浸泡消毒干燥后称质量,记录试样的初始质量。抽取速眠新及灭菌注射用水,1∶1 混合后于兔臀部肌内注射全麻,固定于实验台上,剪去兔脊背两侧背毛,强力碘局部消毒,2%利多卡因行背部皮下浸润麻醉。背脊处正中切开皮肤,在兔脊柱两侧约2.5 cm 处钝性分离直至深层肌肉,每侧等距离选择3 个植入点,每点间隔1 cm,将称质量后各试样送入深度1 cm 的肌肉中,缝合创口。植入后的第2、4、8、12、26 和52 周,分别处死1 只兔,取出样品,计算各组材料的失重率、相对分子质量变化率、断裂强度和断裂伸长率,观察材料表面结构变化。失重率=[实验前质量(g)-实验后质量(g)]/实验前质量(g) ×100%;相对分子质量变化率=(实验前相对分子质量-实验后相对分子质量)/实验前相对分子质量×100%。
1.11 统计学分析采用SPSS 16.0 统计软件进行统计学分析。各组材料机械性能参数、附着成骨细胞数和ALP 水平均符合正态分布,以±s表示,多组间样本均数比较采用单因素方差分析,组间样本均数两两比较采用SNK-q检验。以P<0.05 为差异有统计学意义。
2 结 果
2.1 PPC/PBS 生物膜制备由盐析法制备的生物膜具有双层样结构,即为光滑面层和粗糙面层,与人体骨外膜结构相似。见图1。光滑面层较薄,厚约为0.05 mm,表面光滑平整;粗糙面层较厚,厚约为0.45 mm,表面粗糙多孔; 全层厚约为0.50 mm。能谱检测显示生物膜中各元素相对质量分数百分率为碳65.66%、氧33%、钠0.67%和氯0.68%;相对原子分数百分率为碳72.15%、氧27.22%、钠0.38%和氯0.25%,钠和氯的总相对原子分数百分率小于1.4%,证实生物膜中食盐已基本洗出。 见图2。 与PPC1HNMR 和PBS1HNMR 比较,PPC/PBS 生物膜1HNMR 显示其未发生化学性结合,仍保持PPC 和PBS 各自的结构。见图3。

图1 PPC/PBS 生物膜表面结构Fig. 1 Surface structures of PPC/PBS biofilm
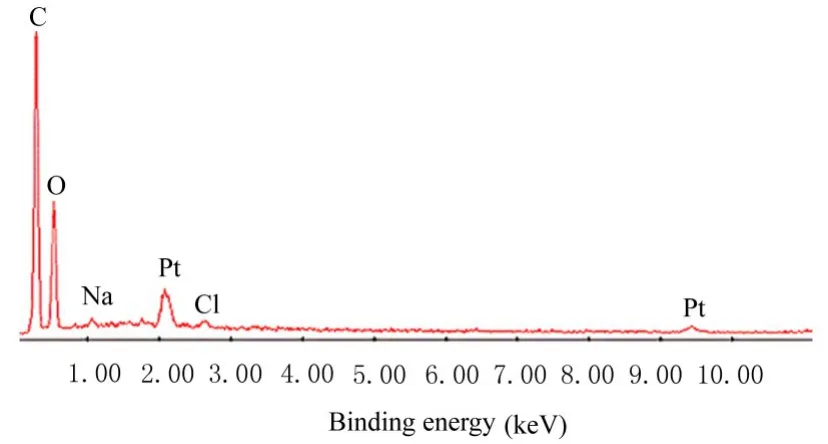
图2 PPC/PBS 生物膜能谱图Fig. 2 Energy spectrum of PPC/PBS biofilm

图3 PPC、PBS 和 PPC/PBS 生物膜的1HNMRFig. 3 1HNMR of PPC, PBS,and PPC/PBS biofilms
2.2 PPC/PBS 生物膜超微形态表现电镜下可见PPC/PBS 生物膜光滑面层表面较为光滑致密,平整,微米级孔较少见。粗糙面层呈多孔状,表面均为微米级孔所覆盖,孔大小不一,大孔孔径约为200 μm,平均孔径约为120 μm。断面呈明显的双层样结构,光滑面层较薄,粗糙面层较厚,孔与孔之间相通。见图4。
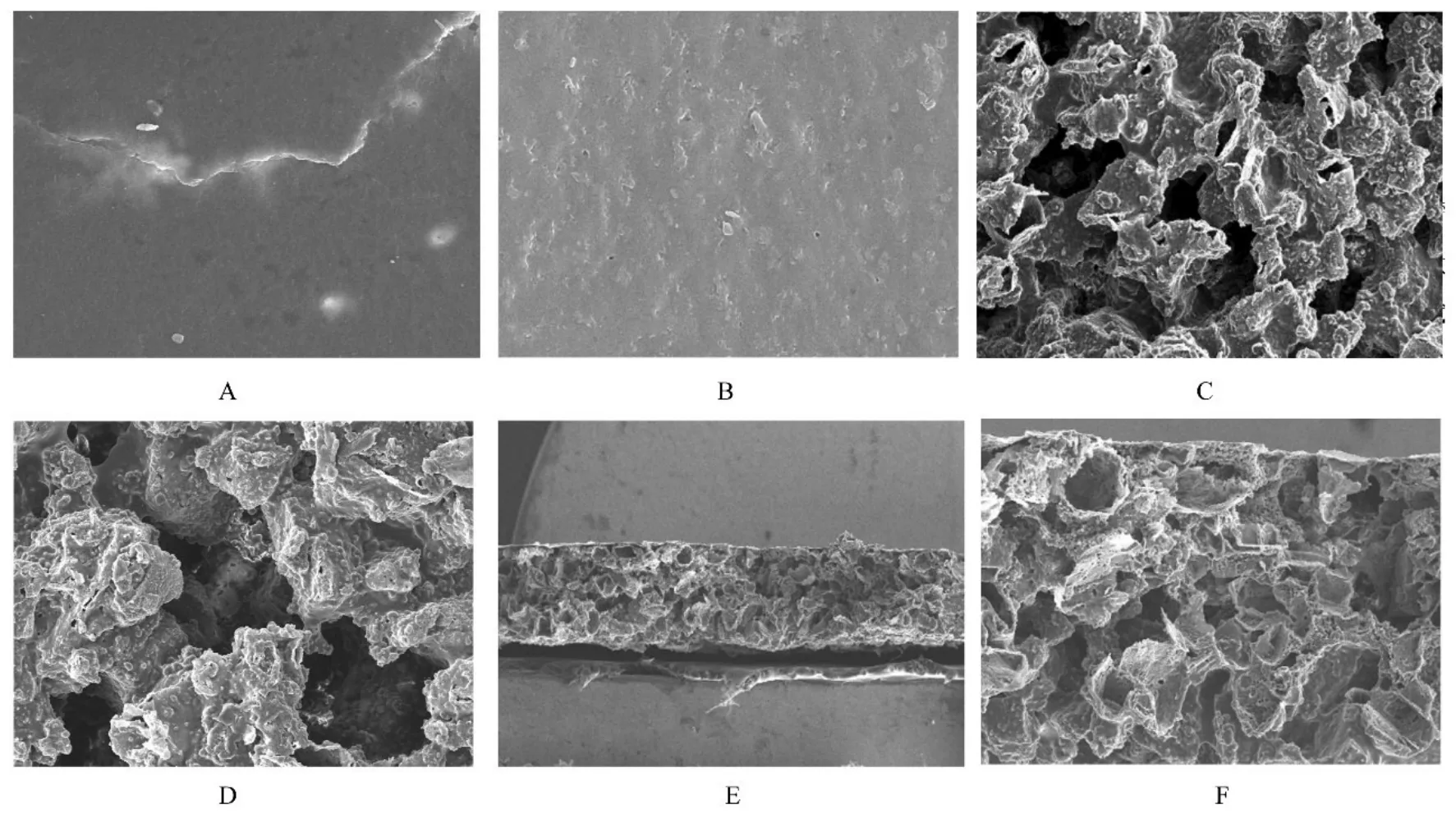
图4 SEM 观察PPC/PBS 生物膜超微形态表现Fig. 4 Ultramorphology of PPC/PBS biofilm observed by SEM
2.3 PPC/PBS 生物膜理化性能PPC/PBS 生物膜的数均相对分子质量约为45 000,重均相对分子质量约为229 000, PDI=5.13, 孔隙率约为77.4%。拉伸试验显示:PPC/PBS 生物膜的杨氏模量约为38.1 MPa,断裂强度约1.22 MPa,断裂伸长率约为7.4%。接触角检测显示其有良好的湿润性,粗糙面接触角平均85°,光滑面按触角平均57°。见图5。

图5 PPC/PBS 生物膜接触角Fig. 5 Contact angles of PPC/PBS biofilm
2.4 SEM 观察各组材料成骨细胞附着和生长情况PPC/PBS 生物膜组可见培养1 d 时,生物膜表面附着的细胞较少;培养3、7 和14 d 时,大量成骨细胞附着于生物膜表面生长,细胞伸出伪足附着于生物膜上,胞体可呈悬空样分布于孔隙中。BME-10X 胶原膜组可见培养1 和3 d 时,表面未见细胞;培养7 和14 d 时胶原膜表面有细胞生长,但其细胞数量较少。见图6。
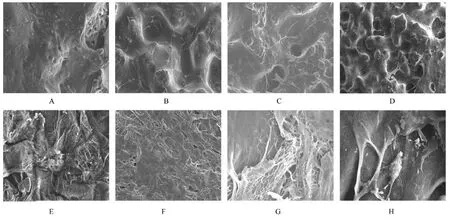
图6 SEM 观察各组成骨细胞附着和生长情况Fig. 6 Attachment and growth of osteoblasts in various groups observed by SEM
2.5 各组材料表面附着成骨细胞数量与对照组比较,培养1、3、7 和14 d 时BME-10X 胶原膜组和PPC/PBS 生物膜组材料表面附着成骨细胞数量均减少(P<0.05)。与BME-10X 胶原膜组比较,培养1、3、7 和14 d 时PPC/PBS 生物膜组材料表面附着成骨细胞数量均增加(P<0.05)。见表1。
表1 不同培养时间各组材料表面附着成骨细胞数量Tab. 1 Numbers of osteoblasts attached to surface of materials in various groups at different time points (n=3,±s,×104)

表1 不同培养时间各组材料表面附着成骨细胞数量Tab. 1 Numbers of osteoblasts attached to surface of materials in various groups at different time points (n=3,±s,×104)
*P<0.05 compared with control group; △P<0.05 compared with BME-10X collagen membrane group.
?
2.6 各组材料表面附着成骨细胞中ALP 水平与对照组比较,培养1、3、7 和14 d 时BME-10X 胶原膜组和PPC/PBS 生物膜组材料表面附着成骨细胞中ALP 水平明显降低(P<0.01)。与BME-10X胶原膜组比较,培养1 和3 d 时PPC/PBS 生物膜组材料表面附着成骨细胞中ALP 水平明显升高(P<0.01);培养7 和14 d 时,BME-10X 胶原膜组和PPC/PBS 生物膜组比较差异无统计学意义(P>0.05)。见表2。
表2 各组材料表面附着成骨细胞中ALP 水平Tab.2 ALP levels in osteoblasts attached to surface of materials in various groups(n=3,±s)

表2 各组材料表面附着成骨细胞中ALP 水平Tab.2 ALP levels in osteoblasts attached to surface of materials in various groups(n=3,±s)
*P<0.01 compared with control group; △P<0.01 compared with BME-10X collagen membrane group.
?
2.7 PPC/PBS 生物膜体内降解性能与降解0 周时比较,降解4 周时,PPC/PBS 生物膜失重率和相对分子质量变化率均逐渐升高,且呈时间依赖性(P<0.05);降解26 周时,PPC/PBS 生物膜失重率约为16.15%;降解52 周时,PPC/PBS 生物膜失重率约为49.18%。见图7。强度变化检测,与降解0 周时比较,降解4 周时,PPC/PBS 生物膜断裂强度和断裂伸长率均逐渐减小(P<0.05 或P<0.01);降解52 周时,体内生物膜已降解碎裂成较薄的小块状,无法检测其断裂强度和断裂伸长率。见表3。SEM 观察PPC/PBS 生物膜超微形态表现,自第2 周开始,PPC/PBS 生物膜粗糙面表面开始出现微孔样结构,随时间推移,粗糙面表面微孔样结构数逐渐增多,孔径为0~10 μm;至降解26 周时,PPC/PBS 生物膜粗糙面表面均匀微孔样结构均匀分布。降解4 周时,PPC/PBS 生物膜光滑面表面出现脱屑样改变,但未见有微孔样结构;降解12 周时,光滑面表面出现较少微孔样改变,孔径<5 μm;降解26 周时,光滑面表面微孔样结构数增多,孔径<10 μm。见图8 和9。
表3 不同降解时间点PPC/PBS 生物膜体内降解断裂强度和断裂伸长率Tab. 3 Fracture strengthes and elongations at break of PPC/PBS biofilm degraded in vivo at different degradation time poitns(n=5,±s)
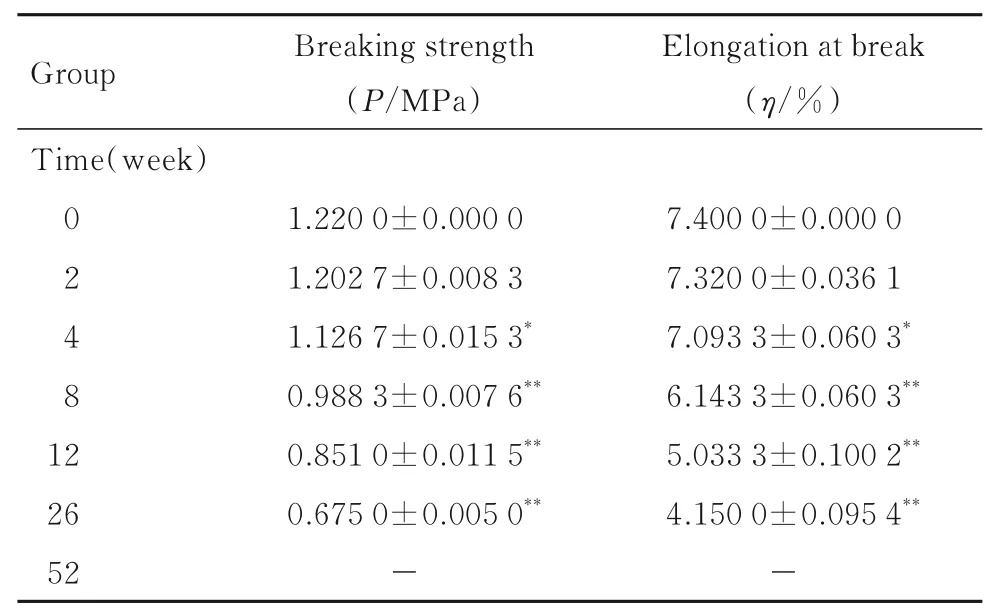
表3 不同降解时间点PPC/PBS 生物膜体内降解断裂强度和断裂伸长率Tab. 3 Fracture strengthes and elongations at break of PPC/PBS biofilm degraded in vivo at different degradation time poitns(n=5,±s)
“-”:No data.*P<0.05,**P<0.01 compared with 0 week.
?
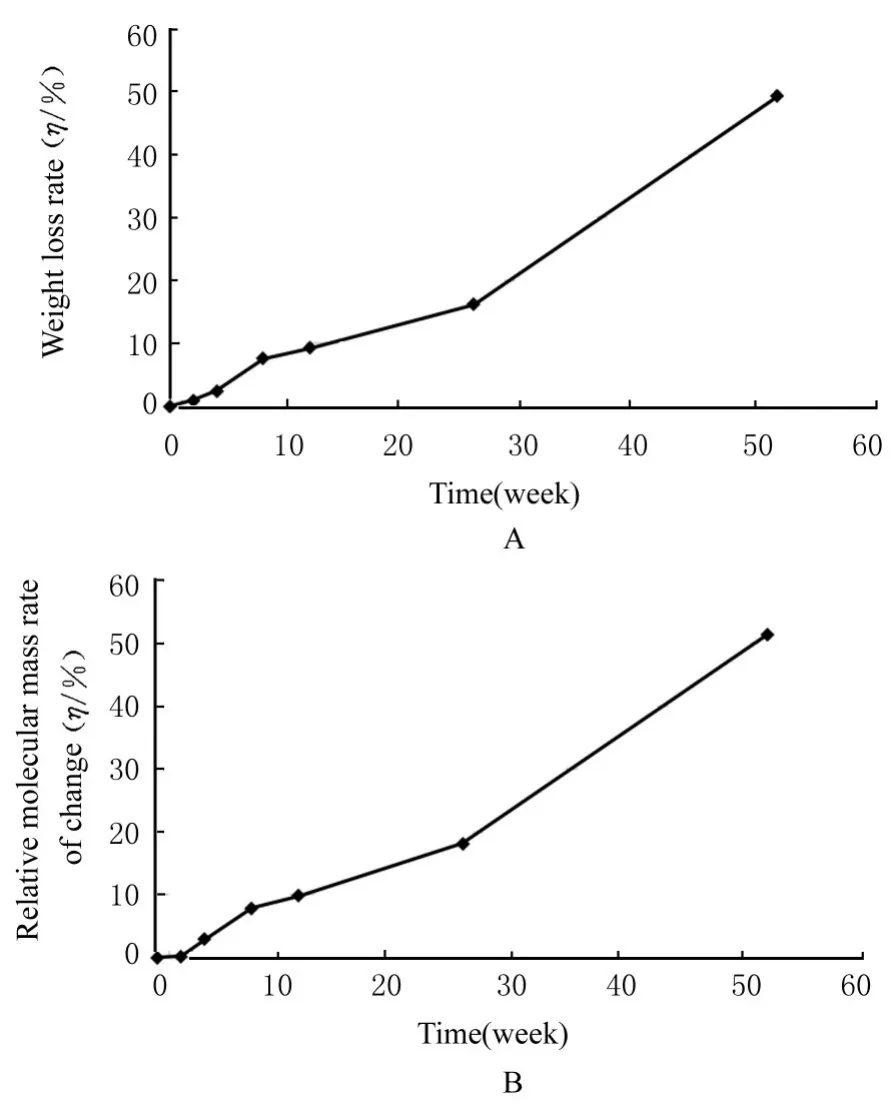
图7 不同降解时间PPC/PBS 生物膜体内降解失重率曲线和相对分子质量变化率曲线Fig. 7 Curves of weight loss rate and relative molecular mass rate of change of PPC/PBS biofilm in vivo at different time points after degradation
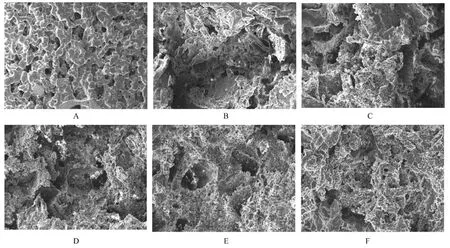
图8 不同降解时间点PPC/PBS 生物膜粗糙面超微形态表现(×200)Fig. 8 Ultramorphology of rough surface of PPC/PBS biofilms at different degradation time points (×200)
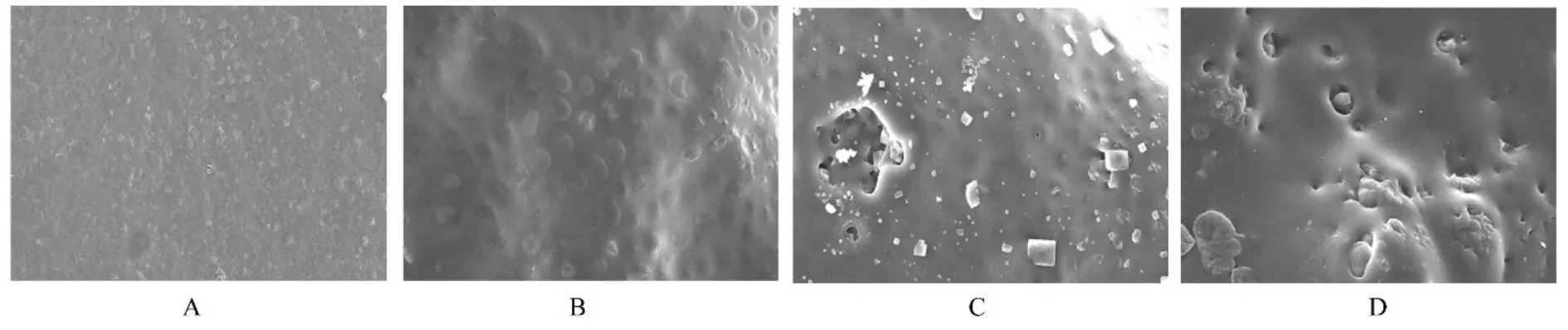
图9 不同降解时间点PPC/PBS 生物膜光滑面超微形态表现Fig. 9 Ultramorphology of smooth surface of PPC/PBS biofilms at different degradation time points
3 讨 论
随着高分子聚合物材料在医学领域应用范围的不断扩大,人们对生物可降解高分子聚合物材料的研究越来越深入,研发的类型也逐渐多样化。由于高分子聚合物材料的品种繁多,性质差异较大,因此可作为替代材料应用于人体多个组织。PPC 作为可完全生物降解的新型材料,具有较聚乙烯和聚氯乙烯更好的阻隔性和生物相容性,可应用于医用包装材料,但PPC 玻璃化转变温度较低,力学性能和耐热性能较差,且降解速度较慢[7,13-14]。PBS 具有高度疏水的链结构,但因缺少活性位点且降解速率较慢使其应用受到限制[15]。单一的均聚物常难以满足现代科学对高聚物材料日益苛刻的要求,而共混改性可将不同性能的聚合物共混,实现各共混组分性能互补,提高聚合物的性能,从而研发出综合性能优越的材料[15]。本研究将PPC/PBS 共混改性,并通过盐析法合成与人体骨外膜结构相似的双层样结构PPC/PBS 生物膜。
中国医学科学院生物医学工程研究所研制的BME-10X 医用胶原膜为目前在医学领域较常用的生物膜[16]。本研究结果显示:PPC/PBS 生物膜较薄,厚度约为0.5 mm,占据的空间较小,且具有良好的强度和弹性模量,不溶于水,在液体中不易发胀。提示PPC/PBS 生物膜具备良好的空间维持能力,可保证骨缺损区的骨再生恢复。
PPC/PBS 生物膜双层多孔样结构与人体的骨外膜相似,光滑面层与人体骨外膜的外层相似,表面较致密光滑,在一定程度上可阻止软组织生长入骨组织中,避免在骨组织中形成纤维性结构,可起到较好的屏障作用。粗糙面层大孔孔径约为200 μm,平均孔径约为120 μm,孔与孔之间相通,成骨细胞直径约为20 μm,附着时成骨细胞直径约为30 μm。提示本研究制备的PPC/PBS 生物膜粗糙面层孔径范围可容纳成骨细胞生长,可能在发挥生物膜屏障作用的同时具备骨支架材料的骨引导再生作用。
生物膜强度和孔隙率成反比,良好的强度和孔隙率是生物膜发挥屏障和骨引导双重作用的关键[17]。本研究制备的PPC/PBS 生物膜具有良好的机械强度,空间维持能力强,且孔隙率较高。较高的孔隙率可增加材料内部的体液流动和扩散,有利于改善材料内部细胞生长微环境,促进局部骨改建。本研究结果显示:PPC/PBS 生物膜接触角均小于90°,证实其具有较好的湿润性,在GBR 过程中可吸附局部循环体液和血液,为细胞的生长提供营养支持,为组织再生创建良好的微环境。
PPC/PBS 是一种可降解高分子共聚物,将其开发为口腔医学使用的GBR 生物膜材料,具有良好的细胞相容性,成骨细胞在其表面的附着功能是该材料生物有效性的最重要因素。成骨细胞紧密地黏附于生物膜上,可充分发挥其骨引导作用。本研究结果显示:培养1 d 时,PPC/PBS 生物膜组可见成骨细胞贴壁生长,培养3 d 时成骨细胞数量增加,至7 d 时成骨细胞已长满,14 d 时成骨细胞密集形成复层生长,与成骨细胞正常生长传代周期相似,提示PPC/PBS 生物膜对其周围的细胞生长繁殖无不良影响。SEM 观察结果显示:PPC/PBS 生物膜表面可见大量成骨细胞贴附生长,伸展良好,胞体可呈悬空样分布于孔隙中,细胞伸出伪足附着,这可能与本研究制备的PPC/PBS 生物膜的多孔化结构有关。研究[18]显示:支架孔隙率为75%以上,常规细胞种植技术可成功。本研究制备的PPC/PBS 生物膜平均孔径约为120 μm,孔隙率约为77.4%,可容纳成骨细胞,其多孔化结构适宜细胞生长。
GBR 对膜材料降解性能要求较高。在创口愈合早期,屏障膜需保持其结构的完整性。GBR 膜降解速度过快导致大量的降解产物快速进入机体骨缺损处,可能会妨碍骨的重建和再生;同时其材料的力学性能也会迅速降低,使骨缺损处的再生空间的维持能力下降,当膜失去支架作用后纤维组织细胞生长入骨缺损区进而形成纤维连接,影响骨重建[11]。然而,若GBR 膜降解速度过慢,材料的异物反应时间较长,可能会引起机体的不良反应。因此,推断生物膜体内存留时间于17 周后可能效果会更好,最好达9 个月甚至更长时间,以保证骨再生的质量。本研究结果显示:PPC/PBS 生物膜是一种完全生物降解性高分子材料,在体内至少可维持12 个月,保证充足的骨再生时间;其强度下降缓慢,可较长时间地保持表面的完整性,维持骨再生空间的作用可超过6 个月。PPC/PBS 生物膜体内生物相容性良好,因此PPC/PBS 生物膜在体内较长时间存在可能较为安全。
综上所述,PPC/PBS 生物膜与人体骨外膜结构相似,呈双层样结构,亲水性好,光滑面层表面较为致密,粗糙面层孔隙率高,生物相容性好,且降解缓慢,是一种理想的引导再生生物膜。
