中介体复合物亚基8在胃癌中的表达及其对临床预后和细胞周期的影响
2024-01-05王秋生张小凤葛思堂左芦根
王秋生,张 震,杨 子,张小凤,葛思堂,左芦根,
蚌埠医学院第一附属医院 1胃肠外科 2中心实验室 3炎症相关性疾病基础与转化研究安徽省重点实验室,安徽蚌埠 233000
胃癌是全球最常见的消化道恶性肿瘤之一[1]。据SEER数据库显示,2007至2021年胃癌患者的5年生存率依次为38.3%、40.6%和42.9%,呈缓慢上升趋势,且晚期胃癌患者的5年生存率仅为10%,胃癌患者的远期预后不容乐观[2]。近年来,越来越多的学者尝试从分子病理学层面寻找与胃癌预后有关的分子标志物,探究其在胃癌发生发展中发挥的生物学作用[3-4],旨在为胃癌临床诊疗提供新思路。细胞周期是多种生物学分子共同调控的结果,而细胞周期调控失衡是引起胃癌细胞恶性增殖的重要原因[5-6],可显著影响胃癌的发生发展及远期预后[7-8]。中介体复合物亚基8(mediator complex subunit 8,MED8)是一种RNA聚合酶调节因子,在mRNA转录过程中充当RNA聚合酶Ⅱ和调节蛋白之间的桥梁[9]。有研究表明,MED8在肝细胞癌组织中高表达且与预后不良相关[10],被证实是肾细胞癌的致癌基因[11]。但MED8在胃癌中的表达及对患者预后的影响相关报道较少。本研究基于公共数据库及病理组织学分析MED8在胃癌及癌旁组织中的表达,探讨MED8与胃癌患者临床病理参数及远期预后的关系,利用生物信息学预测MED8在胃癌中的生物学作用,并采用细胞学实验进行验证,旨在明确MED8作为胃癌预后评估标志物和治疗新靶点的潜在应用价值。
资料和方法
基线资料采集回顾性分析蚌埠医学院第一附属医院2012年6月至2017年7月行胃癌根治术的患者。纳入标准:依据病理学检查,明确诊断为原发性胃癌;成功施行胃癌根治术并达到肉眼及显微镜下均无肿瘤残留。排除标准:合并其他组织来源的恶性肿瘤;临床资料缺失。依据纳入及排除标准入选并采集患者相关资料:(1)基线资料:性别、年龄、术前外周血癌胚抗原、糖类抗原199、肿瘤大小、组织学分型、分化程度、TNM分期、手术病理诊断等信息;(2)生存资料:通过电话随访患者术后5年生存情况;(3)手术病理:调取癌组织及癌旁组织蜡块,并进行免疫组织化学染色。本研究获得蚌埠医学院伦理委员会批准(伦理审查编号:2019KY038)。
生物信息学分析TIMER2.0平台(http://timer.cistrome.org)分析MED8在人类常见肿瘤及胃癌中的表达情况。UALCAN平台(ualcan.path.uab.edu)分析MED8在胃癌中的表达情况。Kaplan-Meier平台(https://kmplot.com/analysis/)分析MED8(探针:213127_s_at)与胃癌患者总生存期的相关性。UCSC Xena平台(https://xena.ucsc.edu)获取GDC TCGA胃癌数据集基因表达丰度值表,共包含60 489个基因、407例组织,基迪奥生物平台(https://www.genedenovo.com)进行差异基因分析及基因集富集分析(gene set enrichment analysis,GSEA),通过DAVID Bioinformatics Resources平台(htpps://david.ncifcrf.gov)获取基因本体论(gene ontology,GO)及京都基因与基因组百科全书(Kyoto encyclopedia of genes and genomes,KEGG)基因富集列表,并采用Bioinformatics(www.bioinformatics.com.cn)在线作图工具进行富集结果可视化。
细胞培养、慢病毒转染及分组胃癌细胞系(MGC-803)购自国家生物医学实验细胞资源库,采用含10%胎牛血清的DMEM高糖培养基培养。取对数生长期细胞,使用过表达MED8载体(吉凯基因)和对照空载体(质粒GV358)、MED8干扰(小干扰RNA:TTCAAACCTTCTGGAGAAAATCA)和对照空载体(质粒GV248)对MGC-803细胞进行慢病毒转染实验,步骤简述为:调整细胞悬液密度为2×105个/ml,接种于6孔板,待细胞生长至70%,加入含有慢病毒(1×107TU/ml)和感染增强液的完全培养基进行感染,7 h后更换完全培养基,培养72 h后用含1 μg/ml嘌呤霉素完全培养基筛选稳定表达细胞株,利用免疫印迹法验证调控效果。实验分组为:正常对照组、过表达空载组、MED8过表达组、敲减空载组和MED8敲减组。
免疫组织化学染色及积分光密度值分析组织切片经脱蜡水化、抗原修复、一抗MED8(1∶200,武汉三鹰生物技术有限公司)及二抗孵育、二氨基联苯胺显色、脱水及封片等处理,Image Pro Plus软件对组织进行积分光密度值(integrated optical density,IOD)定量分析。
免疫印迹实验采用放射免疫沉淀实验裂解液与蛋白酶抑制剂提取细胞总蛋白,BCA法进行蛋白定量。聚丙烯酰胺凝胶电泳进行蛋白电泳,经转膜、封闭、一抗孵育、二抗孵育、凝胶成像,Image J软件对图像进行分析处理。一抗信息如下:MED8、细胞周期蛋白依赖性激酶4(cyclin-dependent kinase 4,Cdk4)和G1/S-特异性周期蛋白-D1(G1/S-specific cyclin-D1,CyclinD1)稀释比均为1∶1000,购自武汉三鹰生物技术有限公司。
流式细胞实验培养并收集MGC-803细胞,离心后收集细胞沉淀,预冷磷酸缓冲盐溶液洗涤后用70%冰冷乙醇4 ℃过夜固定。按照细胞周期检测试剂盒(北京索莱宝科技有限公司)说明书进行细胞周期检测,并用Flowjo10.0软件分析细胞周期不同时相的细胞比例。
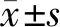
结 果
MED8在胃癌组织的表达TIMER2.0平台分析显示,与正常组织相比,MED8在包括胃癌在内的多种肿瘤组织中高表达(P均<0.05)(图1),UALCAN平台进一步分析显示,MED8在胃癌组织的表达显著高于癌旁组织,且MED8在临床1~4期、G2~3级、N0~3期的表达明显高于正常组织(P均<0.05)(图2)。免疫组织化学结果进一步显示,胃癌组织中MED8表达高于癌旁组织,且定位于癌细胞核中(t=34.670,P<0.001)(图3)。
与正常组织比较,aP<0.05,bP<0.01

图3 免疫组织化学检测MED8蛋白在胃癌及癌旁组织中的表达
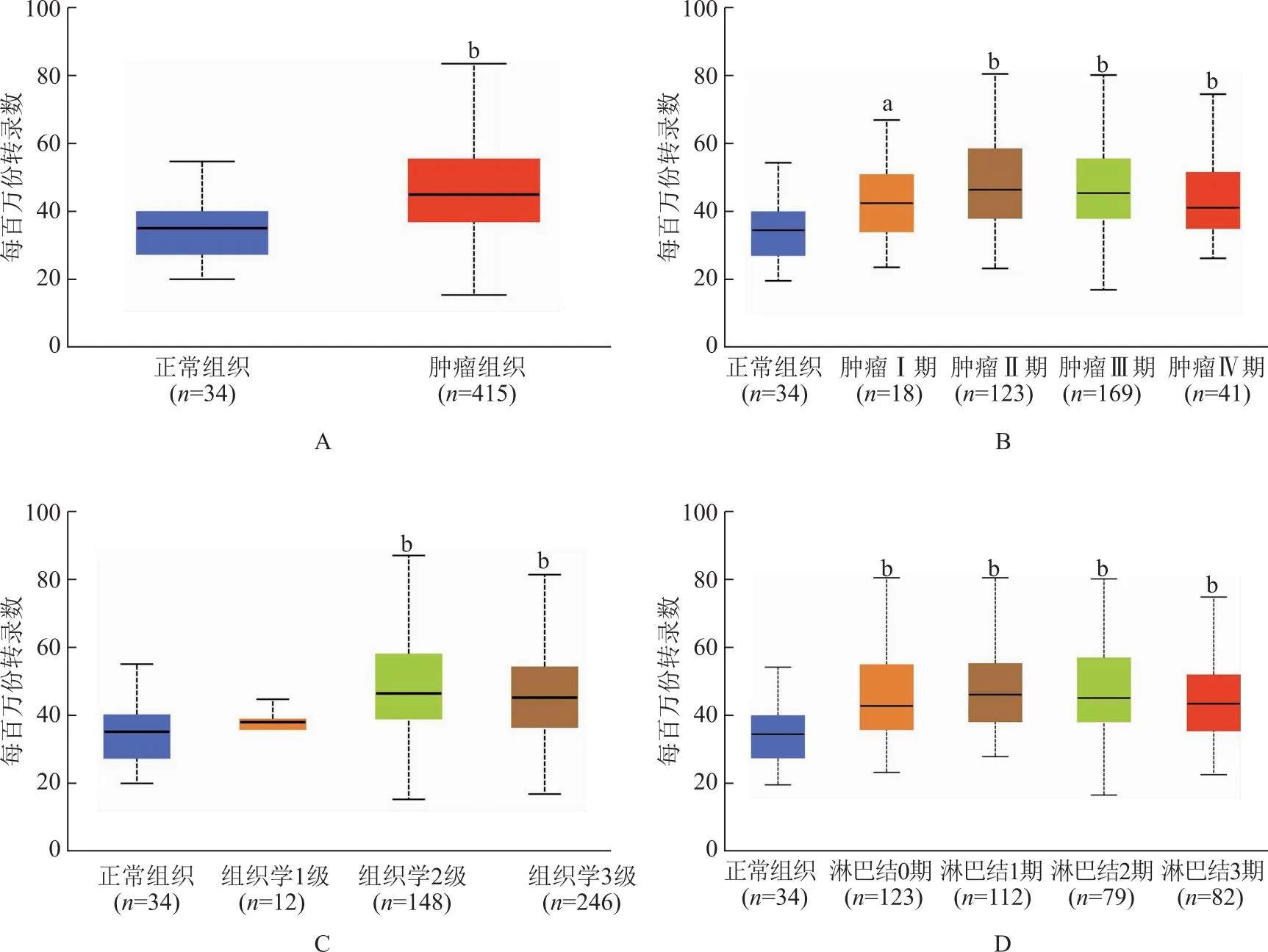
胃癌组织中MED8表达与临床病理参数的关系以胃癌组织中MED8表达相对IOD值的中位数(3.085)为界,将患者分为MED8高表达组(n=52)和MED8低表达组(n=52),并分析其与临床病理参数的关系,结果显示MED8表达水平与分化程度(P=0.029)、T分期(P=0.001)、N分期(P=0.006)及外周血癌胚抗原(P=0.048)、糖类抗原199(P=0.003)水平相关(表1)。
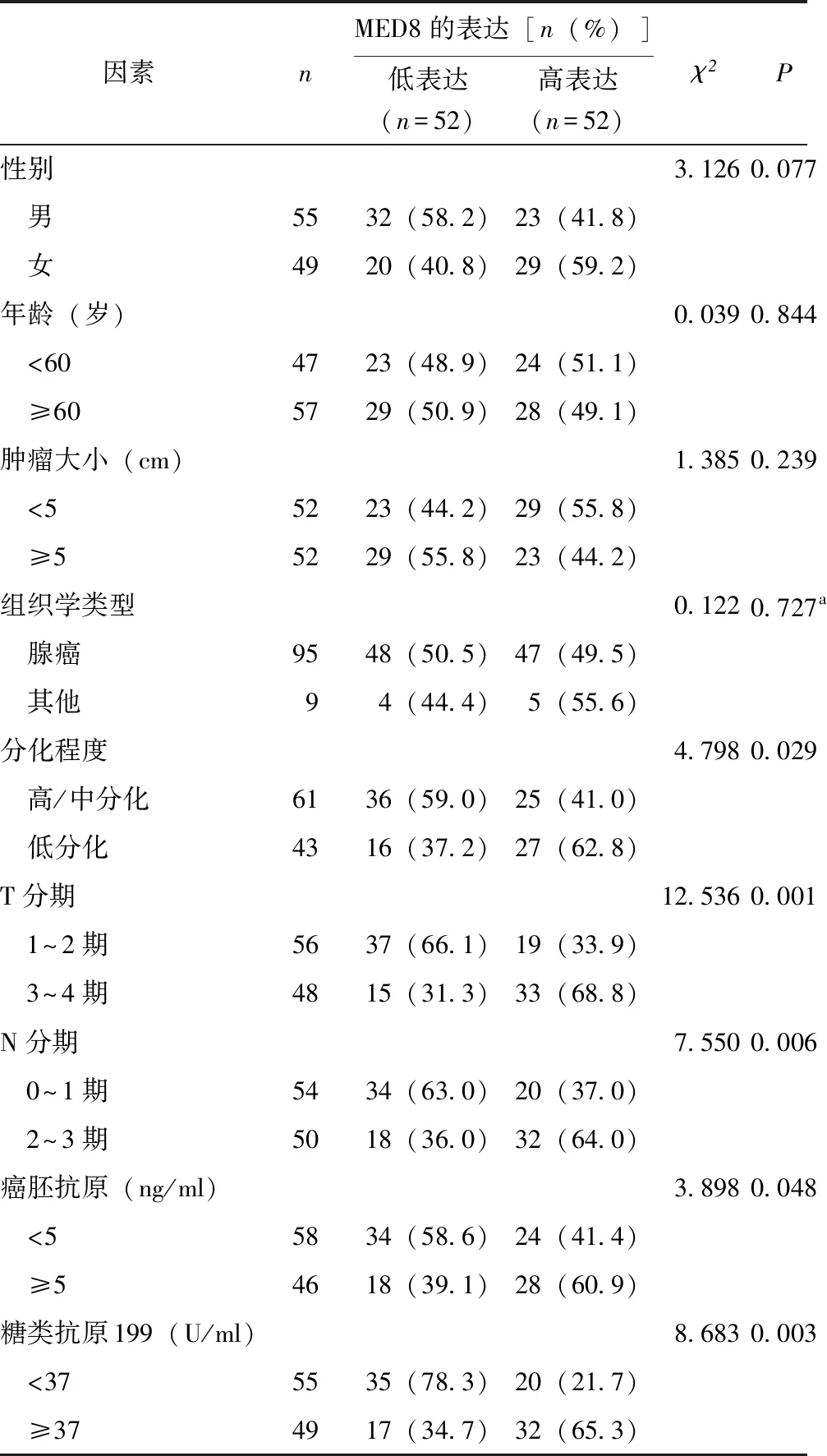
表1 胃癌组织中MED8的表达与临床及病理参数的关系
MED8表达对胃癌患者术后5年生存率的影响及危险因素分析Kaplan-Meier Plotter平台分析MED8表达对胃癌患者生存率的影响,结果显示MED8高表达组患者术后总生存期显著低于MED8低表达组(P=0.002)(图4A)。Kaplan-Meier生存分析显示,MED8高表达组患者术后5年生存率显著低于MED8低表达组[23.1%(12/52)比67.3%(35/52),χ2=21.476,P<0.001)(图4B)。单因素分析显示,性别、年龄、肿瘤大小、组织学类型与胃癌患者术后5年生存期差异均无统计学意义(P均>0.05),而MED8高表达(P<0.001)、分化程度(P=0.020)、T分期(P<0.001)、N分期(P=0.003)、癌胚抗原(P<0.001)、糖类抗原199(P<0.001)可能是影响胃癌患者术后5年生存率的危险因素(图4C~4G)。Cox回归进一步分析显示,MED8高表达(P=0.037)、肿瘤低分化(P=0.034)、T3~T4期(P=0.017)、N2~N3期(P=0.031)、癌胚抗原≥5 ng/ml(P<0.001)和糖类抗原199≥37 U/ml(P=0.012)是影响胃癌患者术后5年生存率的独立危险因素(图4H)。
CEA:癌胚抗原;CA199:糖类抗原199
MED8表达对胃癌患者远期预后的预测价值绘制时间依赖性ROC工作曲线评估MED8表达对胃癌患者术后5年生存情况的预判价值,结果显示以MED8相对表达量3.075为截断值,预判胃癌根治术后5年死亡的敏感度为71.9%,特异度为74.5%,曲线下面积为0.733(图5)。

图5 MED8表达对胃癌患者术后5年生存期的预测价值
MED8基因功能富集分析结果根据在线获取的胃癌数据集基因表达丰度表,以MED8表达丰度值的中位数为界进行分组,对60 489个基因进行差异分析,共筛选出6006个差异表达基因,其中包括4856个表达上调基因和1150个表达下调基因(图6A、6B)。对包括MED8在内的6006个差异基因进行基因富集及基因集富集分析,结果显示GO富集的生物学过程包括细胞周期、细胞分裂、凋亡等生物学过程(图6C);KEGG富集的通路包括细胞周期、p53信号通路、转化生长因子-β信号通路等(图6D);基因集富集分析结果显示,6006个差异基因在胃癌、细胞周期、DNA复制等基因集中呈现正向调控(图6E)。

GO:基因本体论;KEGG:京都基因与基因组百科全书
过表达MED8对MGC-803细胞G1/S期转化及细胞周期蛋白表达的影响慢病毒转染MGC-803细胞过表达MED8,Western blot检测MED8蛋白表达水平,结果显示转染后成功过表达MGC-803细胞MED8蛋白表达水平(P<0.001)(图7A、7B)。细胞周期流式实验分析过表达MED8对MGC-803细胞G1/S期转换的影响,结果显示与过表达空载组相比,MED8过表达组MGC-803细胞G1期细胞比例显著减少(P<0.001),S期细胞比例显著增加(P<0.001)(图7C~7F)。免疫印迹实验检测Cdk4和CyclinD1蛋白表达水平,结果显示与过表达空载组相比,MED8过表达组MGC-803细胞中的Cdk4和CyclinD1蛋白水平均显著升高(P均<0.001)(图7G、7H)。

Mr:相对分子质量;Cdk4:细胞周期蛋白依赖性激酶4;CyclinD1:G1/S-特异性周期蛋白-D1
敲减MED8对MGC-803细胞G1/S期转化及细胞周期蛋白表达的影响慢病毒转染MGC-803细胞敲减MED8,Western blot检测MED8蛋白表达水平,结果显示转染后成功敲减MGC-803细胞MED8蛋白表达(P<0.001)(图8A、8B)。细胞周期流式实验分析敲减MED8对MGC-803细胞G1/S期转换的影响,结果显示与敲减空载组相比,MED8敲减组MGC-803细胞G1期细胞比例显著增加(P<0.001),S期细胞比例显著减少(P<0.001)(图8C~8F)。免疫印迹实验检测Cdk4和CyclinD1蛋白表达水平,结果显示与敲减空载组相比,MED8敲减组MGC-803细胞中的Cdk4和CyclinD1蛋白水平均显著降低(P均<0.001)(图8G、8H)。
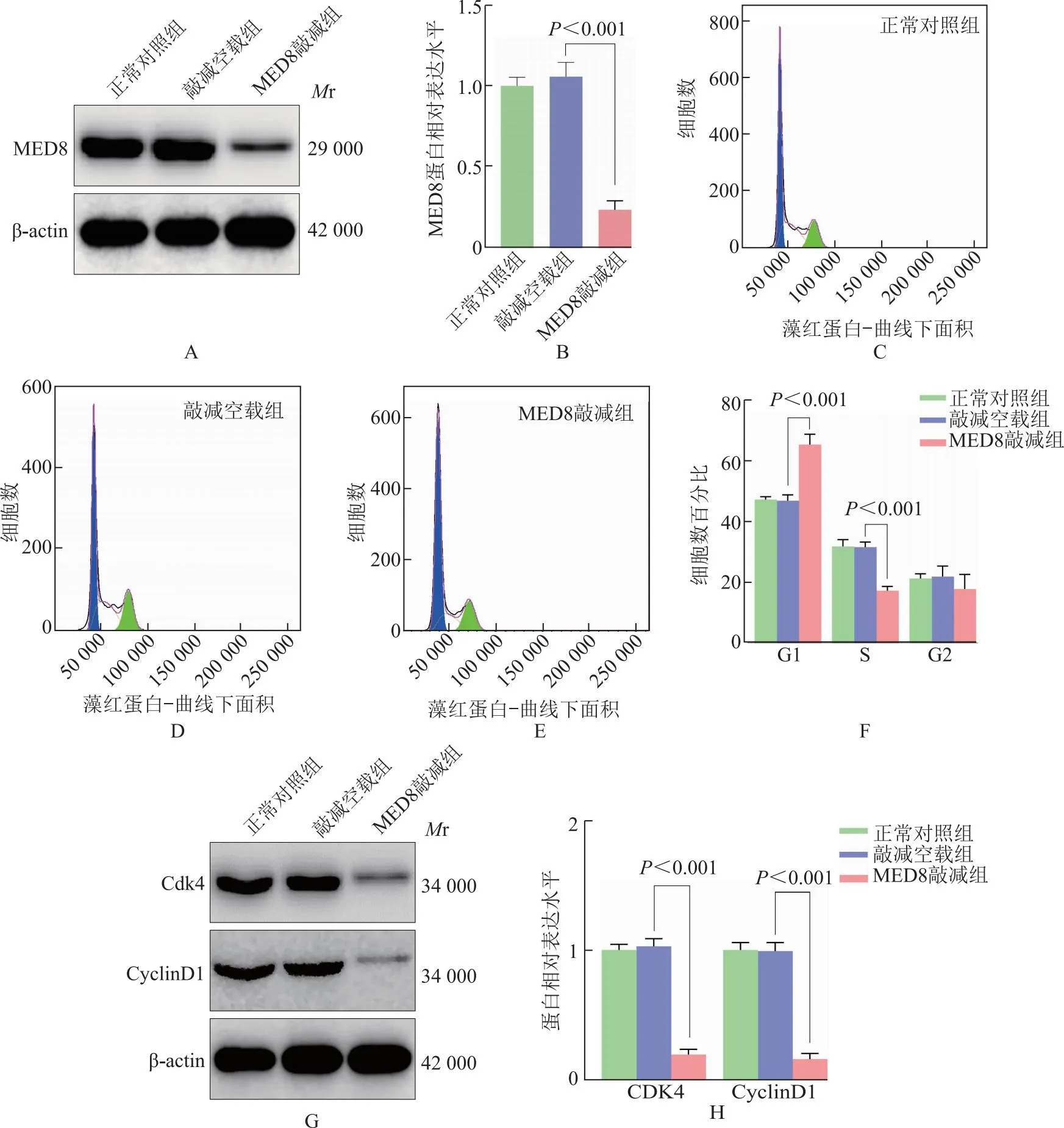
A、B.Western blot检测慢病毒转染后基因调控效果;C~F.流式细胞学分析敲减MED8对MGC-803细胞G1/S期转换的影响;G、H.Western blot检测敲减MED8对MGC-803细胞中Cdk4和CyclinD1蛋白表达的影响
讨 论
胃癌是一个全球性健康问题[12],近50年来,针对胃癌的手术治疗、全身化疗和放疗以及靶向和免疫治疗等均取得了长足进步[13],然而,胃癌仍然是全球癌症相关死亡的第3大原因[14]。寻找判断胃癌远期预后的敏感特异性标志物并探索其在胃癌中的作用,有望改善患者预后并为胃癌的治疗提供更多参考[15-16]。本研究基于公共数据库及本机构临床病例发现MED8在胃癌中高表达且对胃癌患者的远期预后具有较高的的预测价值,同时,体外细胞实验表明MED8蛋白表达水平显著影响细胞周期进程,有望成为评估胃癌患者远期预后和胃癌治疗新靶点的潜在生物学标志物。
本研究通过在线数据库挖掘发现MED8在胃癌组织中高表达,免疫组织化学实验表明MED8在胃癌组织中的表达量显著高于癌旁组织。为进一步探索MED8在评估胃癌患者远期预后的临床价值,本研究通过Kaplan-Meier Plotter数据库挖掘发现MED8高表达组患者术后总生存期显著低于MED8低表达组;结合本机构临床病例随访资料绘制Kaplan-Meier生存曲线,结果提示MED8高表达组患者有更低的5年生存率。既往研究表明,MED8在肝癌组织中高表达且与患者预后不良密切相关[9-10];MED8与透明细胞肾细胞癌的恶性进展相关并被证实是肾细胞癌的致癌基因[11],与本研究结果相似。此外,Cox回归模型分析表明,MED8高表达是影响胃癌患者术后5年生存率的独立危险因素,可作为影响胃癌发生发展的独立影响因子,同时,ROC曲线进一步提示MED8蛋白表达水平对评估胃癌患者术后5年生存率具有较高的预测价值。但MED8影响胃癌患者术后5年生存期的具体途径或机制尚不明确。
MED8位于中介体的头部[17],是mRNA转录过程所必需的一种RNA聚合酶调节因子,在mRNA转录过程中充当RNA聚合酶Ⅱ和调节蛋白之间的桥梁[9-18]。为进一步挖掘MED8影响胃癌进展及远期预后的可能途径,本研究通过TCGA公共数据库进行GO、KEGG及GSEA富集分析,结果提示MED8可能参与细胞周期、DNA复制等生物学过程。同时,流式细胞学实验及免疫印迹实验进一步表明,过表达MED8可显著促进MGC-803处于G1期细胞向S期转化,且过表达组细胞Cdk4和CyclinD1蛋白水平显著升高,敲减组则相反。提示MED8可能通过调控细胞周期进程进而影响胃癌疾病进展及远期预后。
Zeng等[19]研究指出,胃癌作为一组异质性疾病具有独特的发病机制和分子致病途径,一定程度上造成了胃癌的治疗效果欠佳及预后不良。Hume等[5]指出,G1期细胞过度活跃或加速进入S期会导致复制应激和DNA损伤,可引发并促进肿瘤进展。近年,基于精准医学的分子治疗有望改善胃癌患者的不良预后[20],Fukami等[21]进一步指出,特定生物学分子高表达引起的细胞周期改变可对胃癌的远期预后产生重要影响。本研究显示MED8在胃癌组织中高表达且与患者不良预后相关,体外细胞实验进一步发现,过表达MED8可促进MGC-803处于G1期的细胞向S期转化,加快细胞周期进程,敲减MED8则相反,提示靶向MED8基因进行肿瘤细胞周期调控并进一步抑制肿瘤细胞恶性增殖,有望成为胃癌治疗的新策略。
本研究的不足:(1)本研究是回顾性研究,存在病例选择偏倚及资料收集的局限性;(2)本研究纳入病例数有限,所得结果需要进一步扩大样本量进行验证;(3)在线数据库的分析显示不同病理分级、分期不影响MED8的表达,但本研究纳入的临床样本分析显示MED8表达水平与分化程度、T分期、N分期均有关,该问题仍需进一步扩大样本量以验证;(4)MED8对胃癌细胞其他生物学功能的影响及可能参与的分子信号通路仍需进一步探索及验证。
综上,MED8在胃癌中高表达且可能通过调控胃癌细胞周期G1/S期转换影响疾病进展,并对患者预后的评估具有潜在临床价值。
