子宫腺肌病患者子宫内膜组织中环氧合酶2 和β-连环蛋白表达水平及其与痛经的关系
2024-01-05张晓颖何源哈达王静媛宿瑞俊鲁容钶
张晓颖, 何源哈达, 王静媛, 宿瑞俊, 王 淇, 鲁容钶, 郑 博, 郑 健
(1. 内蒙古医科大学附属医院妇产科疾病研究中心,内蒙古 呼和浩特 010059;2. 内蒙古医科大学基础医学院人体解剖学教研室,内蒙古 呼和浩特 010059;3. 内蒙古医科大学基础医学院病理学教研室,内蒙古 呼和浩特 010059; 4.内蒙古医科大学附属医院临床检验中心,内蒙古 呼和浩特 010059)
子宫腺肌病(adenomyosis,AM)是指子宫内膜腺体和间质侵入子宫肌层生长产生的病变。大部分AM 患者希望保留子宫,但由于保守治疗效果较差,常因月经过多和痛经难忍被迫选择子宫切除,极大地影响患者身心健康。研究[1-2]显示:AM 患者痛经率为64.8%~77.8%。最终选择子宫切除的AM 患者均伴有不同程度的痛经,尤其重度痛经者较多。而目前痛经的发生机制尚未完全阐明,对于不同程度痛经患者的治疗存在争议。血清中CA125 水平升高对于AM 诊断具有一定的参考价值,但由于其特异度和灵敏度较差,临床诊断和监测AM 仍缺少有效的标记物[3]。研究[4-5]显示:尽管AM 为良性疾病,但其有与恶性肿瘤相似的特征,如细胞异常增殖、迁移和侵袭,目前尚无有效的临床治疗策略。研究[6-7]显示:环氧合酶2(cyclooxygenase-2,COX-2)可能在疾病的早期参与AM 的发生,其在AM 内膜间质细胞中的表达上调可能在细胞侵袭中发挥重要作用。在AM 异位子宫内膜组织中β-连环蛋白(β-catenin)表达水平明显降低,且在AM 发生过程中起重要作用,但COX-2 和β-catenin 在AM 中的具体作用机制尚未完全阐明[8-9]。本研究探讨不同程度痛经AM 患者子宫内膜组织和血清中COX-2 和β-catenin 表达水平,并分析其与痛经的关系,为指导临床AM 的诊疗提供新思路。
1 资料与方法
1.1 临床资料选取2018 年1 月—2019 年12 月于内蒙古医科大学附属医院妇产科经腹子宫切除的90 例临床和术后病理确诊AM 的痛经患者。年龄29~52 岁,平均年龄(39.3±1.6)岁,采用视觉模拟评分(visual analogue scale,VAS) 法检测AM 患者痛经程度,无痛经(-):0 分;轻度疼痛(+):1~3 分;中度疼痛(⧺):4~6 分;重度疼痛(⧻):7~10 分[10]。按其痛经程度分为轻度痛经组30 例、中度痛经组30 例和重度痛经组30 例。90 例AM 患者作为AM 组,取其在位子宫内膜和AM 病灶组织及术前血清。由于临床中行子宫切除并经病理证实的无痛经AM 患者较少,故选取同期于本院经腹子宫切除的30 例无痛经子宫肌瘤(uterinemyoma,UM)患者作为UM 组,取其正常子宫内膜组织和术前血清。UM 组患者年龄30~52 岁,平均年龄(40.7±2.3)岁,术后病理证实为UM 且为正常子宫内膜。所有研究对象经严格筛选,纳入标准:① 绝经前女性,符合AM 诊断标准[11],且经术后病理证实;②临床资料完整;③术前3 个月内未接受激素类药物治疗;④无内分泌、免疫性疾病和恶性肿瘤;⑤符合伦理学标准,受试对象均签署知情同意书。排除标准:①并发急性炎症者;②存在内分泌和免疫性疾病及恶性肿瘤者;③生殖器官发育不良者;④并发卵巢囊肿和子宫内膜异位症等雌激素依赖性子宫内膜相关性疾病者。本研究留取标本前经内蒙古医科大学附属医院医学伦理委员会批准(伦理批号:YKDFY2018097),病理切片均由内蒙古医科大学附属医院病理医师复核。
1.2 主要试剂和仪器兔抗人COX-2 抗体和β-catenin 抗体均购自北京博奥森生物技术有限公司,DAB 显色试剂盒和S-P 试剂盒购自福州迈新试剂公司,人COX-2 酶联免疫吸附试验(enzyme-linked immunosorbent assay,ELISA) 试剂盒购自上海艾博抗贸易有限公司,人β-catenin ELISA 试剂盒购自北京索莱宝科技有限公司。微波炉购自日本SANYO 公司, 双目光学显微镜购自日本OLYMPUS 公司,酶标仪购自美国Bio-Rad 公司。
1.3 免疫组织化学(immunohistochemistry,IHC)法检测2 组患者子宫内膜组织中COX-2 和β-catenin 蛋白表达水平石蜡包埋手术切除的AM 组患者病灶组织、AM 组患者在位子宫内膜组织和UM 组患者正常子宫内膜组织,制备厚4 μm 切片,IHC 法检测2 组患者子宫内膜组织中COX-2 和β-catenin 蛋白表达水平。所有标本在同一条件下按照试剂盒说明书操作。光学显微镜下观察2 组研究对象的子宫内膜组织,以细胞膜和细胞浆有黄色或棕色颗粒着色为阳性,采用Image J 软件分析阳性细胞平均灰度值。平均灰度值≥180 为阴性,平均灰度值<180 为阳性,以灰度值代表2 组研究对象子宫内膜组织中COX-2 和β-catenin 蛋白表达水平,灰度值越低,代表COX-2 和β-catenin 蛋白表达水平越高。
1.4 ELISA 法检测2 组患者血清中COX-2 和β-catenin 水平抽取AM 组和UM 组患者术前清晨空腹肘静脉血3 mL,分离血清,-80 ℃保存。ELISA 法检测2 组患者血清中COX-2 和β-catenin水平,严格按照试剂盒说明书操作。采用酶标仪检测波长450 nm 处吸光度(A)值,以A 值代表2 组患者血清中COX-2 和β-catenin 水平。
1.5 统计学分析采用 SPSS 19.0 统计软件进行统计学分析。UM 组和AM 患者正常子宫内膜组织和血清中COX-2 及β-catenin 表达水平以x±s表示。多组间样本均数比较采用Mann Whitney 秩和检验,组间样本均数两两比较采用Kruskal-Wallis 秩和检验,采用Spearman 相关系数法进行相关性分析。以P<0.05 为差异有统计学意义。
2 结 果
2.1 2 组患者子宫内膜组织中COX-2 和β-catenin蛋白表达水平COX-2 蛋白主要表达于子宫内膜组织细胞浆中,β-catenin 蛋白主要表达于子宫内膜组织细胞膜或细胞浆中。见图1。与UM 组比较,AM 组患者子宫内膜组织中COX-2 蛋白表达水平均升高(P<0.05),β-catenin 蛋白表达水平均降低(P<0.05)。与AM 组患者在位子宫内膜组织比较,AM 组患者病灶组织中COX-2 蛋白表达水平升高(P<0.05),β-catenin 蛋白表达水平差异无统计学意义(P>0.05)。见表1。与轻度痛经组比较,中度痛经组AM 组患者病灶组织和重度痛经组AM患者在位子宫内膜及病灶组织中COX-2 蛋白表达水平升高(P<0.05),中度痛经组AM 患者在位子宫内膜组织中COX-2 蛋白表达水平差异无统计学意义(P>0.05)。与中度痛经组比较,重度痛经组AM 患者在位子宫内膜和病灶组织中COX-2蛋白表达水平升高(P<0.05)。不同程度痛经组AM 患者在位子宫内膜和病灶组织中β-catenin 蛋白表达水平比较差异均无统计学意义(P>0.05)。见表2。
表1 2 组患者在位子宫内膜和病灶组织中COX-2 和β-catenin 蛋白表达水平Tab.1 Expression levels of COX-2 and β-catenin proteins in in situ endometrium tissue and lesion tissue of patients in two groups(±s)

表1 2 组患者在位子宫内膜和病灶组织中COX-2 和β-catenin 蛋白表达水平Tab.1 Expression levels of COX-2 and β-catenin proteins in in situ endometrium tissue and lesion tissue of patients in two groups(±s)
*P<0.05 compared with UM group; △P<0.05 compared with AM group in-situ endothelium tissue.
?
表2 不同程度痛经组AM 患者在位子宫内膜和病灶组织中 COX-2 及β-catenin 蛋白表达水平Tab.2 Expression levels of COX-2 and β-catenin proteins in in situ endometrium and lesion tissues of AM patients in different degrees of dysmenorrhea groups(n=30,±s)
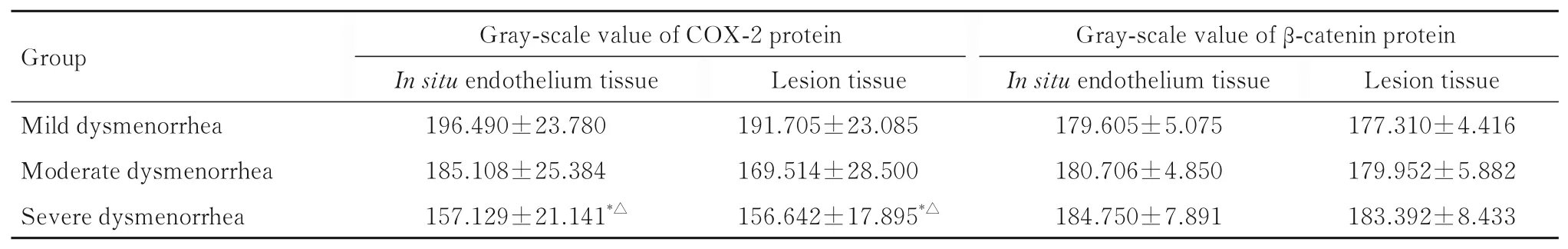
表2 不同程度痛经组AM 患者在位子宫内膜和病灶组织中 COX-2 及β-catenin 蛋白表达水平Tab.2 Expression levels of COX-2 and β-catenin proteins in in situ endometrium and lesion tissues of AM patients in different degrees of dysmenorrhea groups(n=30,±s)
*P<0.05 compared with mild dysmenorrhea group;△P<0.05 compared with moderate dysmenorrhea group.
?
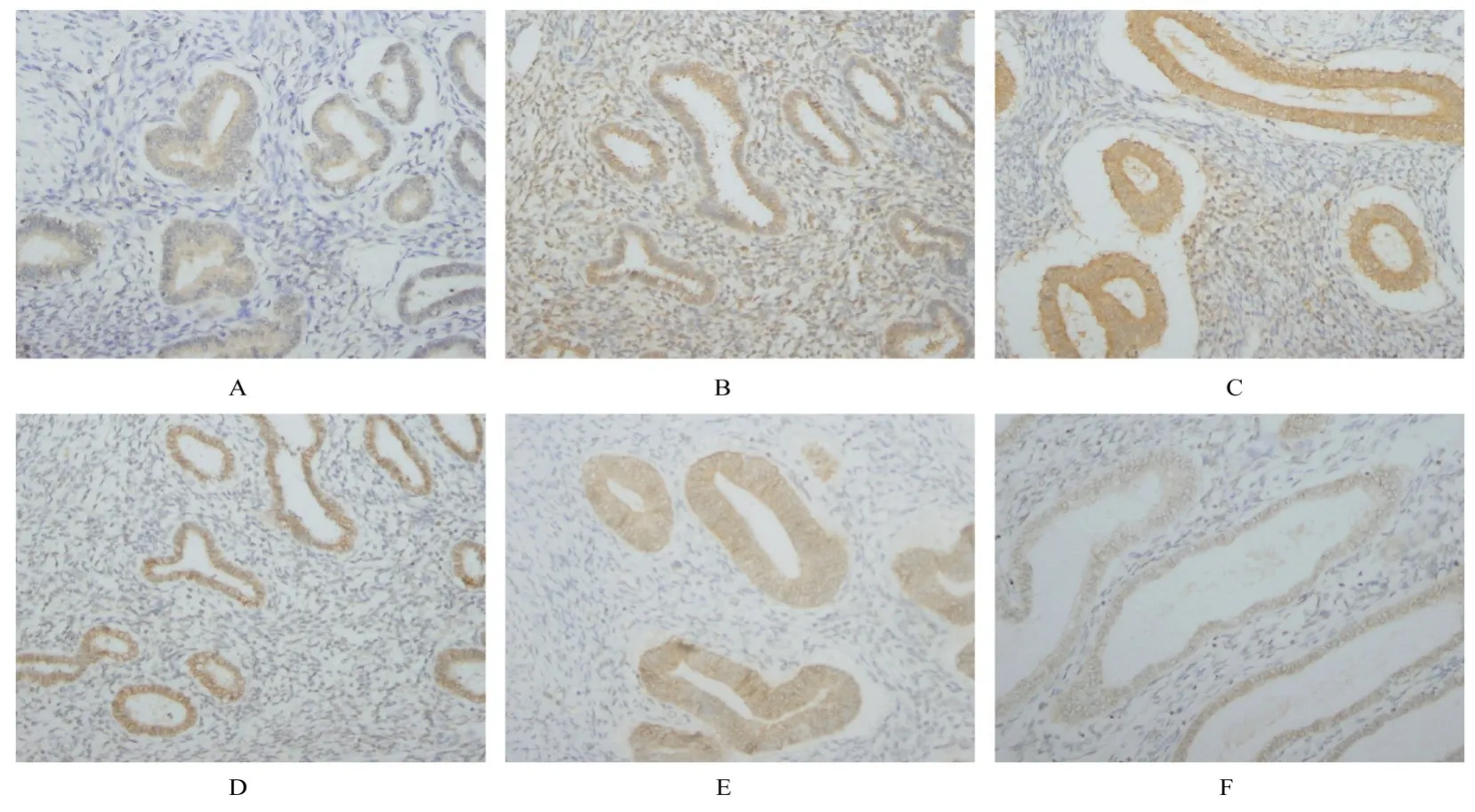
图1 2 组患者在位子宫内膜和病灶组织中COX-2 和β-catenin 蛋白表达情况(IHC,×400)Fig. 1 Expressions of COX-2 and β-catenin proteins in endometrium tissue and lesion tissue of patients in two groups(IHC,×400)
2.2 2 组患者血清中COX-2 和β-catenin 水平与UM 组比较,AM 组患者血清中COX-2 水平升高(P<0.05),β-catenin水平降低(P<0.05)。见表3。与轻度痛经组比较,中度痛经组和重度痛经组患者血清中COX-2 水平升高(P<0.05)。各不同程度痛经组患者血清中β-catenin 水平比较差异无统计学意义(P>0.05)。见表4。
表3 2 组研究对象血清中COX-2 和β-catenin 水平Tab. 3 Levels of COX-2 and β-catenin in serum of patients in two groups[±s,cB/(mg·L-1)]
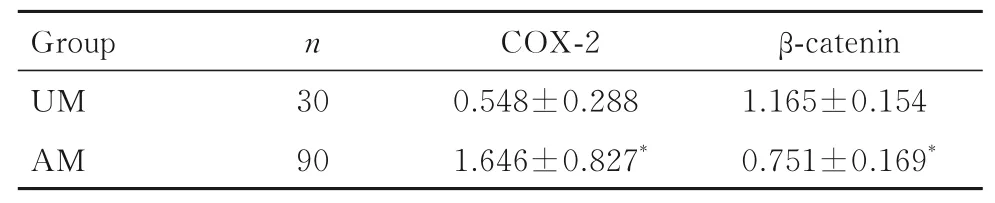
表3 2 组研究对象血清中COX-2 和β-catenin 水平Tab. 3 Levels of COX-2 and β-catenin in serum of patients in two groups[±s,cB/(mg·L-1)]
*P<0.05 compared with UM group.
?
表4 不同程度痛经组AM 患者血清中 COX-2 和β-catenin水平Tab. 4 Levels of COX-2 and β -catenin in serum of AM patients in different degrees of dysmenorrhea groups[n=30,±s,cB/(mg·L-1)]
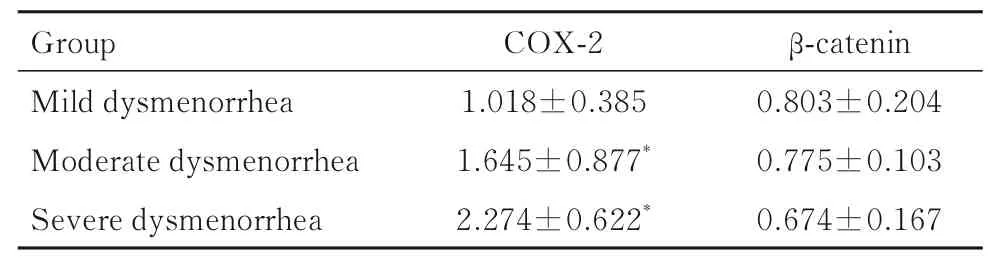
表4 不同程度痛经组AM 患者血清中 COX-2 和β-catenin水平Tab. 4 Levels of COX-2 and β -catenin in serum of AM patients in different degrees of dysmenorrhea groups[n=30,±s,cB/(mg·L-1)]
*P<0.05 compared with mild dysmenorrhea group.
?
2.3 AM 组患者在位子宫内膜和病灶组织及血清中COX-2 和β-catenin 表达水平与痛经程度的相关性AM 组患者病灶组织中COX-2 蛋白表达水平与β-catenin 蛋白表达水平呈负相关关系(r=-0.364,P<0.05),即随着COX-2 蛋白表达水平升高,β-catenin 蛋白表达水平降低。AM 组患者在位子宫内膜和病灶组织中COX-2 蛋白表达水平与患者痛经程度呈正相关关系(r=0.511,P<0.05;r=0.696,P<0.05),即随着痛经程度加重,其表达水平逐渐升高;AM 组患者在位子宫内膜和病灶组织中β-catenin 蛋白表达水平与痛经程度无相关性(P>0.05)。AM 组患者血清中COX-2 水平与β-catenin 水平呈负相关关系(r=-0.534,P<0.05);COX-2 水平与痛经程度呈正相关关系(r=0.613,P<0.05),即随着痛经程度加重,患者血清中COX-2 水平逐渐升高。
3 讨 论
上皮-间质细胞转化(epithelial-mesenchymal transition,EMT) 是AM 发病的重要因素[12]。研究[13]显示:子宫和宫腔的手术操作可使子宫内膜及子宫内膜-肌层交界区(endometrial-myometrial interface,EMI)发生损伤,从而激活组织损伤和组织修复机制及子宫内膜向内凹陷,通过EMI 逐渐侵犯子宫肌层。子宫高雌激素和高蠕动状态也可导致子宫内膜损伤内陷及组织修复,进而发生EMT[3]。EMT 是生物细胞的程序性发育,其特征为细胞黏附丧失、E-钙黏蛋白表达抑制和细胞迁移率升高[14]。子宫内膜细胞侵犯子宫肌层并于该处增生,进而引起周围肌层组织增生和肥大,导致子宫腺肌病的形成[15]。研究[16]显示:分泌期AM 在位内膜组织转化生长因子β1(transforming growth factor-β1,TGF-β1) 和Smad3 水平升高,诱导EMT 发生,促进了上述过程。EMT 与细胞E-钙黏蛋白/β-catenin 复合体的稳定性有密切关联,E-钙黏蛋白/β-catenin 复合体负责调控细胞的迁移和侵袭,诱导上皮向间质转化,这可能与AM 的发生发展有关。
研究[17]显示:β-catenin 具有双重功能,根据其在细胞中的定位调节细胞-细胞黏附和基因转录的协调。在细胞质膜上,β-catenin是E-钙黏蛋白/β-catenin 单元的组成部分,维持细胞分化和正常结构的稳定性。β-catenin 的核易位依赖于Wnt 信号通路,而核β-catenin 可以作为转录激活因子调节细胞的增殖和分化。WANG 等[18]发现:过表达Talin1通过激活Wnt/β-catenin 通路诱导EMT,增强AM在位子宫内膜和异位子宫内膜组织中上皮细胞的迁移及侵袭能力。YOO 等[19]发现:在子宫内膜增生期和分泌期,AM 在位子宫内膜和腺肌病灶组织的上皮细胞中TGF-β2 水平明显高于正常子宫内膜组织,且子宫内膜上皮细胞中β-catenin 与TGF-β2 呈显著正相关关系,证实β-catenin 激活TGF-β2 导致子宫内膜上皮细胞发生EMT,从而促进AM 的发生发展。LIU 等[20]研究显示:肿瘤坏死因子α 诱导蛋白8 样2 (tumor necrosis factor -α-induced protein -8-like 2,TIPE2) 在AM 患者在位和异位子宫内膜组织中水平降低,其主要通过靶向β-catenin 逆转EMT,有效抑制子宫内膜细胞的迁移和侵袭。本研究结果显示:与UM 组比较,AM组患者病灶和在位子宫内膜组织中β-catenin 蛋白表达水平降低,提示AM 的发生可能是由于在位子宫内膜组织细胞质膜上β-catenin 表达减少,E-钙黏蛋白/β-catenin 复合体稳定性降低,导致在位子宫内膜组织中细胞间黏附能力降低,出现细胞迁移和侵袭,诱导EMT。且AM 组患者在位子宫内膜组织与病灶组织中β-catenin 蛋白表达水平无明显差异,表明AM 病灶组织细胞与其在位子宫内膜组织细胞的来源可能是相同的,即在位子宫内膜组织中细胞发生EMT,通过EMI,逐渐侵犯子宫肌层,最终形成AM 病灶。本研究结果显示:与UM 组比较,AM 组患者血清中β -catenin 水平降低,提示β-catenin 在AM 子宫内膜组织和血清中的调控作用可能是相同的。本研究中AM 患者子宫内膜组织和血清中β-catenin 表达水平与痛经程度无相关关系,且不同程度痛经组AM 患者病灶组织中β-catenin 表达水平也无明显差异,表明β-catenin 表达水平降低可能只是参与了AM 的发生,未进一步参与AM 痛经程度的加重,这与黄先华等[21]研究结果一致。
COX-2 是花生四烯酸转化为前列腺素(prostaglandin,PG)的限速酶,PG 与痛经程度直接相关。研究[22-24]显示:COX-2 对于增强子宫内膜腺体的侵袭能力和加剧局部炎症损伤具有调控作用。上调COX-2 表达可以诱导EMT[25-26]。部分医源性操作导致EMI 破坏,引起血小板聚集和缺氧诱导因子1(hypoxia inducible factor-1,HIF-1)生成,发生组织缺氧,进而激活血管内皮生长因子(vascular endothelial growth factor, VEGF) 和COX-2 等信号通路,导致血管生成。同时COX-2高表达可能导致PGE2 生物合成释放增加,增强子宫内膜腺体的侵袭能力并增加子宫收缩能力,导致痛经[27]。研究[11]显示:正常子宫内膜、在位子宫内膜和异位子宫内膜组织中COX-2 表达与月经量和痛经程度有关。在COX-2 抑制剂塞来昔布治疗的AM 模型小鼠中可观察到EMT 逆转,子宫内膜纤维化减少,表明COX-2 表达抑制可显著诱导子宫内膜间质细胞凋亡,抑制EMT 发生[28]。本研究结果显示:与UM 组比较,AM 组患者在位子宫内膜和病灶组织中COX-2 蛋白表达水平升高,且与AM 组患者在位子宫内膜组织比较,AM 组病灶组织中COX-2 蛋白表达水平升高,提示COX-2 蛋白表达水平升高有利于AM 患者在位子宫内膜组织中细胞向AM 病灶处迁移和侵袭,促进了AM 的发生发展。与UM 组比较,AM 组患者血清中COX-2 水平升高,提示AM 子宫内膜组织和血清中COX-2起相同作用。本研究结果显示:与轻度痛经组比较,中度痛经组AM 患者病灶组织和重度痛经组AM 患者在位子宫内膜及病灶组织中COX-2 蛋白表达水平升高,且与中度痛经组比较,重度痛经组AM 患者在位子宫内膜和病灶组织中COX-2 蛋白表达水平升高,COX-2 蛋白表达水平与痛经程度呈正相关关系,提示COX-2 参与了AM 的发生发展,并对痛经有促进作用。AM 组患者子宫内膜组织和血清中COX-2 表达水平升高与β-catenin 表达水平降低有关联。β-catenin 是Wnt 信号通路的关键调控因子,由于细胞质膜中的β-catenin 向细胞核中转移导致其表达水平降低,并通过激活细胞核内的Wnt 信号靶基因COX-2、C-myc 和CyclinD1 等因子转录和相应蛋白表达增强促进细胞生长和增殖,抑制细胞凋亡,进一步加剧了EMT 的发生[9]。膜联蛋白A2 等细胞因子可能通过使细胞核外的β-catenin 表达下调并借助其介导的信号转导通路,上调细胞核中COX-2 的表达[29]。
综上所述, COX-2 表达水平升高和β-catenin表达水平降低及二者的关联性均可诱导AM 发生和子宫内膜异位侵袭,COX-2 高表达可能促进了痛经的发生发展。检测患者血清中COX-2 水平可能成为诊断和监测AM 的新的标记物,为AM 相关痛经的有效治疗靶点药物研究提供参考。
