载rhBMP-2 聚乳酸/磷酸钙支架在兔脊柱融合中的应用
2024-01-05曹雪华岳述荣刘昌胜
王 萌, 张 爽, 王 靖, 曹雪华, 岳述荣, 刘昌胜
(1.上海瑞邦生物材料有限公司, 上海 201707;2.华东理工大学材料科学与工程学院, 上海 200237)
脊柱融合术是目前治疗脊柱退变性疾病的常用手术方法[1-2],而植骨未融合等是脊柱融合术后需要二次手术的常见原因[3]。如何提高脊柱融合率、减少二次手术、减轻患者痛苦,成为急需解决的问题。通过植骨使脊柱达到骨性融合,是脊柱融合术成功的关键[4],因此提高植骨材料的骨诱导活性从而促进骨性融合具有重要意义[5]。目前自体骨移植由于其诱导成骨活性作用好,仍是骨移植材料的金标准,但由于其获取来源有限、患者痛苦增加、手术时间延长等原因,临床使用受到限制[6]。
重组人骨形态发生蛋白-2(recombinant human Bone Morphogenetic Protein-2, rhBMP-2)是一种具有骨诱导活性的生长因子,能够快速有效诱导成骨[7-8],已被广泛用于脊柱融合手术[9-12]。目前临床上可用于脊柱融合的骨形态发生蛋白-2(BMP-2)产品主要以胶原或磷酸钙盐为载体。以胶原为载体的BMP-2 产品主要为美敦力INFUSE Bone Graft,在2002 年通过美国FDA 批准用于脊柱融合,临床治疗效果良好。但其存在降解过快、植入初期rhBMP-2 突释等不足,可能导致并发症的产生[13-14]。Cho 等[15]研究了负载rhBMP-2 的羟基磷灰石(HA)用于腰椎横突间融合的安全性和有效性,研究发现,当rhBMP-2 使用剂量为0.1 mg/kg 时,患者未出现rhBMP-2 引起的并发症,且能够在3 个月时形成脊柱融合。但是单纯的无机材料作为rhBMP-2 载体存在脆性大、植入后降解慢等缺点。
本文通过有机/无机复合的思路,以临床应用广泛的医用高分子材料聚乳酸(PLA)、聚己内酯(PCL)和无机材料β-磷酸三钙(β-TCP)为主要成分制备有机/无机复合多孔支架,使材料具有合适的降解速率;并负载rhBMP-2 使该支架具有骨诱导活性,进一步通过羟丙甲基纤维素(HPMC)涂覆于支架表面使rhBMP-2 缓释,延长rhBMP-2 诱导骨修复的时间,促进新骨持续生成。通过兔脊柱融合植骨实验评价了HPMC改性的载rhBMP-2 聚乳酸/磷酸钙支架应用于脊柱融合的可行性。
1 实验部分
1.1 原料和试剂
四 水 硝 酸 钙(Ca(NO3)2·4H2O)、磷 酸 氢 二 铵( (NH4)2HPO4) 、 氨 水(NH3·H2O ) 、 无 水 乙 醇(C2H5OH):分析纯,永华化学科技(江苏)有限公司;外消旋聚乳酸(PDLLA)、PCL:医用级,山东省药学科学院中试厂;二氯甲烷(CH2Cl2)、氯化钠(NaCl,380~550 μm):分析纯,永华化学科技(江苏)有限公司;HPMC:医用级,山东聊城阿华制药有限公司;rhBMP-2:医用级,上海瑞邦生物材料有限公司。
1.2 测试与表征
pH 计:上海仪电科学仪器股份有限公司,PHS-3C 型;电子天平:上海恒平科学仪器有限公司,MP5002 型;磁力搅拌器:上海梅颖浦仪器仪表制造有限公司,H01-1A 型;马弗炉:上海钜晶精密仪器制造有限公司,SXL-1700C 型;冷冻干燥机:上海田枫实业有限公司,TF-FD-1PF 型;电导率仪:上海仪电科学仪器股份有限公司,DDS-307A 型;Micro-CT:德国Bruker 公司,SkyScan1076 型;电子万能试验机:美特斯工业系统(中国)有限公司,CMT2503 型;倒置显微镜:德国莱卡公司,DMi8 型;扫描电子显微镜:日本日立公司,S-3400N 型;X 射线衍射仪:日本理学电机,D/max2550VB/PC 型。
1.3 实验步骤
1.3.1 支架制备 通过物理混合法和氯化钠颗粒占位造孔法制备聚乳酸/磷酸钙多孔支架,将rhBMP-2 溶液吸附于支架表面,冷冻干燥得到载rhBMP-2 的支架,再将表面涂覆HPMC 涂层,得到HPMC 改性的载rhBMP-2 支架。
(1)β-TCP 粉末制备 采用液相沉淀法制备β-TCP 粉末。称取280.20 g Ca(NO3)2·4H2O 溶于2.40 L纯化水,配制得到钙溶液。称取104.30 g (NH4)2HPO4溶于1.58 L 纯化水,配制得到磷溶液。将氨水和纯化水按体积比1∶1 混合,得到氨水溶液。制备时,将钙溶液以10 mL/min 的速率滴入磷溶液中,同时滴加氨水溶液使反应体系pH 保持在7.0,待滴加完毕,室温继续反应3 h。反应结束后过滤,将滤饼用无水乙醇洗涤3 遍并烘干,800 ℃煅烧2 h,自然降温至室温后取出,得到β-TCP 粉末。采用X 射线衍射仪对β-TCP 粉末进行分析,扫描范围10°~80°,工作电压40 kV,工作电流100 mA。
(2)聚乳酸/磷酸钙多孔支架制备 将医用级外消旋聚乳酸和聚己内酯以质量比1∶1 溶解于二氯甲烷中,加入β-TCP 粉末并磁力搅拌至分散均匀,待溶剂挥发至溶液黏稠时加入NaCl 颗粒,搅拌均匀后填入聚四氟乙烯模具(25 mm×5 mm×3 mm),自然挥发24 h 后脱模。将所得样品浸泡于纯化水中,每4 h 换一次水。当浸泡样品的水溶液电导率低于20 μS/cm时,取出支架,37 ℃烘干12 h,得到聚乳酸/磷酸钙多孔支架。PDLLA、PCL、β-TCP 粉末、NaCl 颗粒的质量比为12∶12∶16∶3。通过扫描电子显微镜观察支架形貌,喷金时间40 s,工作电压10 kV。
(3)载rhBMP-2 聚乳酸/磷酸钙多孔支架制备将上述制备的多孔支架经25 kGy 辐照灭菌后,在无菌环境下将200 μL rhBMP-2 溶液 (1 mg/mL)均匀滴加在支架表面,冻干后得到载rhBMP-2 多孔支架。
(4)HPMC 改性的载rhBMP-2 聚乳酸/磷酸钙多孔支架制备 将HPMC 溶于纯化水中制备成w=2%的水溶液,并用0.22 μm 无菌过滤器过滤。在无菌环境下,将200 μL rhBMP-2 溶液(1 mg/mL)均匀滴加在支架表面,待完全吸附后,将HPMC 溶液滴在支架表面,冻干后得到HPMC 改性的载rhBMP-2 多孔支架。
1.3.2 脊 柱 融 合 实 验 本 文 拟 通 过 兔 后 外 侧L5-L6 横突间植骨融合模型[16-17],考察聚乳酸/磷酸钙多孔支架对脊柱融合的可行性。实验分为4 组,即聚乳酸/磷酸钙多孔支架组(Scaffold,S),载rhBMP-2 的聚乳酸/磷酸钙多孔支架组(Scaffold/rhBMP-2,S/B),HPMC 改性的载rhBMP-2 多孔支架组(Scaffold/rhBMP-2/HPMC,S/B/H)和自体髂骨组(Autogenous iliac crest bone graft,ICBG)。选择3 月龄普通级雄性新西兰大白兔共56 只,每组14 只,体重2.5~3.0 kg,由上海甲干生物科技有限公司提供并饲养,分别在植骨融合术后28 d、56 d 和84 d 处死取材。
(1)植入手术 实验在无菌环境下操作。植入材料分别为多孔支架(图1(a))和自体髂骨(图1(b))。取后正中入路,双侧旁开约2 cm 经椎旁肌肉间隙暴露L5 和L6 横突(图1(c)),去除横突部分皮质后植入材料(图1(d)),逐层缝合。术后连续3 d 予抗生素注射。饲养期间定期观察动物的饮食等一般情况以及切口局部情况,期间动物自由摄食。
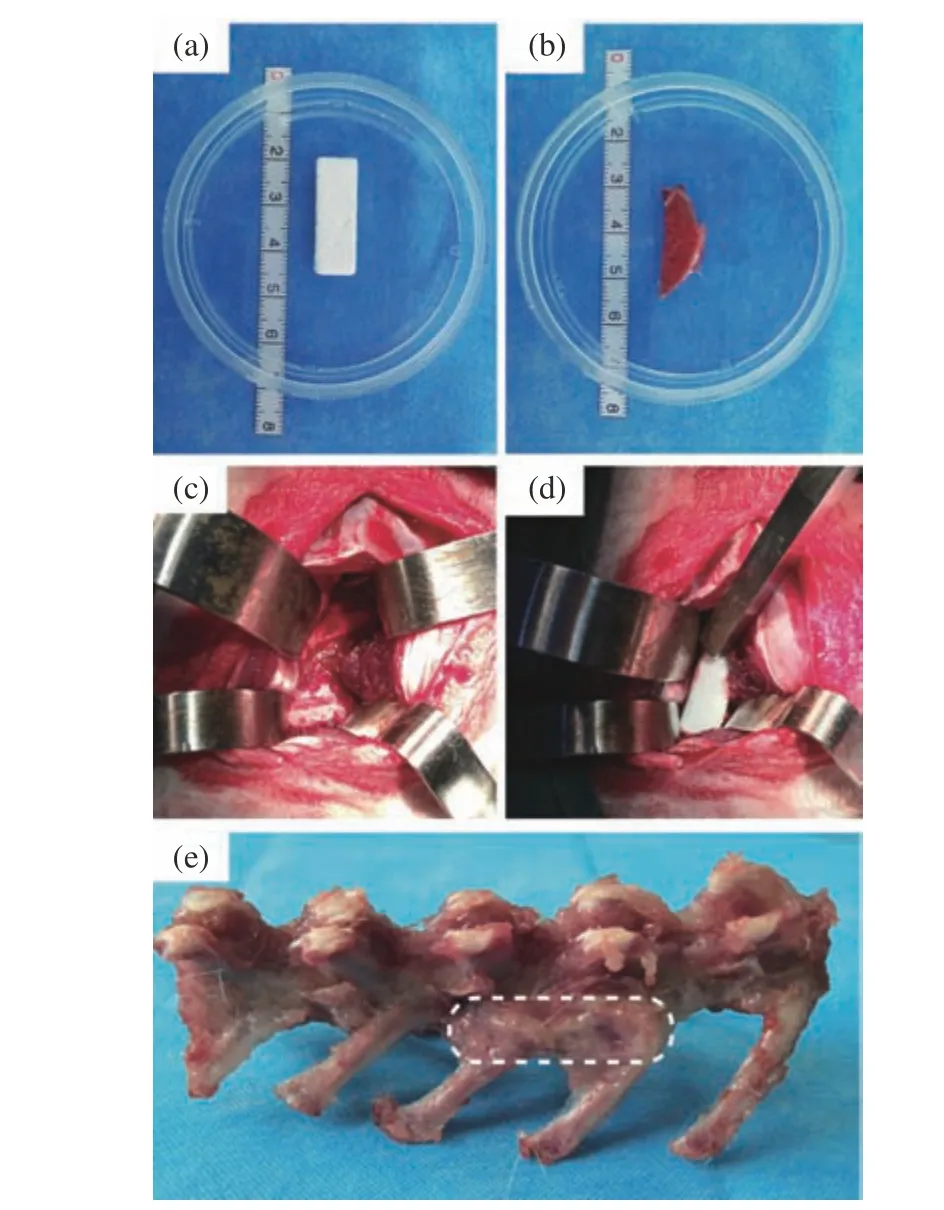
图1 兔后外侧脊柱融合植入示意图Fig.1 Illustration of rabbit posterolateral spinal fusion
(2)micro-CT 扫描观察 术后分别在28 d、56 d和84 d 处死动物,取出腰椎植骨部位(图1(e)),经w=4%多聚甲醛固定后,使用micro-CT 机对植骨区域进行扫描分析。仪器工作电压49 kV,电流200 μA,分辨率36.5 μm。通过SkyScan CTVOX 2.1 软件进行三维重建,观察新骨生成情况。
(3)Van Gieson(VG)染色 样本经w=4% 多聚甲醛固定后,甲基丙烯酸甲酯(PMMA)包埋、切片、磨片最终得到约40 μm 的切片,通过Van Gieson(VG)染色液染色,显微镜观察组织形态。
(4)生物力学 采用电子万能试验机对各组实验节段的前屈、背伸活动度进行检测,并对实验节段进行拉伸分离实验,比较各组的椎体融合情况。
进行屈伸实验前,修整脊柱标本使其前后面平整。将标本固定在电子万能试验机的固定装置上,使其处于固定装置的中央。探头移动速率设置为1 mm/min,探头最大应力达10 N 时停止测试,记录此时探头的位移量。对脊柱标本分别进行前屈、背伸测试。
进行拉伸分离实验前,去除脊柱标本的椎间盘,在椎体间分别向上、向下置入两根医用钢丝,将钢丝两端固定在万能试验机的拉伸装置上,探头移动速率设置为10 mm/min。实验过程中检测到的最大拉伸应力值即为实验节段的断裂力,并记录对应的位移量。
(5)统计学分析 所有数据采用Origin (OriginLab Corp., Northhampton, MA, USA)进行分析,数据以平均值±标准差表示。采用单因素方差分析(ANOVA)进行统计学比较,在大于95%的置信水平时,实验数据之间差异具有统计学意义(p< 0.05)。
2 结果与讨论
PLA 是一种被广泛应用的医用高分子材料,在体内可通过水解作用降解,但其不具有骨传导作用,且降解时会降低局部组织的pH,不利于骨修复[18-19]。因此,本文通过在聚乳酸中引入β-TCP 来改善因降解产生的酸性[20],并提高支架亲水性,以此赋予支架良好的骨传导能力。由于PLA 本身具有一定的刚度,添加柔韧性较好的PCL 可使多孔支架具有可塑性,避免因受力而断裂[21-22]。通过负载rhBMP-2赋予支架骨诱导性,并进一步通过表面涂覆HPMC使rhBMP-2 能够缓慢释放。前期研究表明,HPMC 表面涂层改性的载rhBMP-2 聚乳酸/磷酸钙支架具有较好的诱导成骨作用[23]。本文通过兔后外侧横突间植骨融合实验,证明了该支架用于脊柱融合可达到与自体骨相近的融合效果,可作为自体骨的替代选择。
2.1 支架表征
图2(a)为制备的β-TCP 粉末XRD 图谱,与磷酸三钙(PDF 粉末衍射卡9-169)的主要衍射峰一致。图2(b)为聚乳酸/磷酸钙多孔支架形貌图,可以观察到支架内部丰富的多孔结构,孔径范围200~500 μm。从图2(c)可以观察到,支架骨架上粒径约1 μm 的β-TCP。支架丰富的多孔结构为新骨生成提供了有利条件。

图2 聚乳酸/磷酸钙支架表征Fig.2 Characterization of polylactic acid/calcium phosphate scaffolds
2.2 micro-CT
从图3 所示的三维重建和二维截面图中可以看出,聚乳酸/磷酸钙支架(S)在植入体内后28 d 已发生降解,84 d 时横突间有少量新骨生成;载rhBMP-2 支架(S/B)和HPMC改性的载rhBMP-2支架(S/B/H)在28 d 时支架内部已有新骨生成,84 d 时横突间形成了连续的骨组织结构,表现出良好的融合效果;自体髂骨(ICBG)植入后28 d 时与横突开始融合,84 d 时L5-L6 间达到融合。
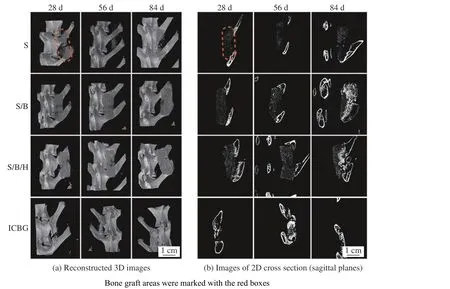
图3 材料植入后兔脊柱的Micro-CT 重建图Fig.3 Micro-CT reconstruct images of the rabbit spine post-operation
图4 所示为各组在不同时期的植骨区骨体积分数和骨密度定量分析。从图中可以看出, S/B 和S/B/H 组的骨体积分数和骨密度在不同时间点均高于S 组,说明rhBMP-2 的释放诱导了新骨快速生成。在第56 d 和84 d 时, S/B/H 组的骨体积分数与骨密度高于S/B 组,最接近ICBG 组的融合效果,说明rhBMP-2的缓慢释放进一步提高了材料的促成骨作用。
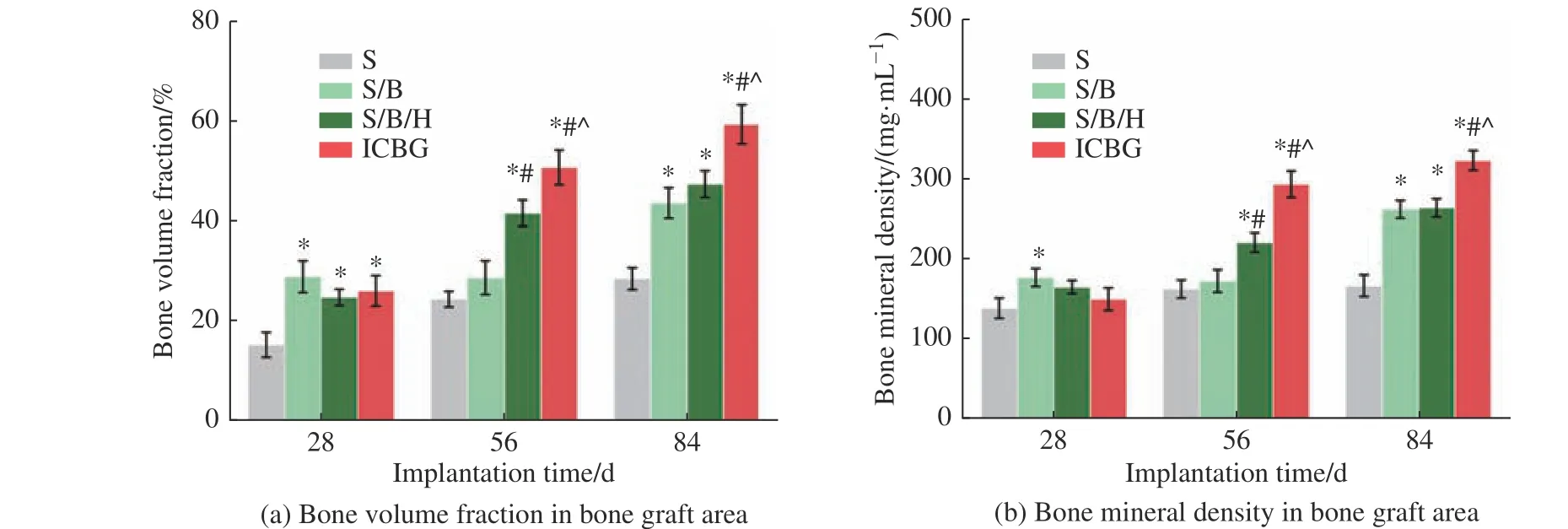
图4 Micro-CT 定量分析Fig.4 Quantitative analysis of micro-CT
2.3 VG 染色
图5 为材料植入后84 d 组织切片VG 染色图,图中黑色部分为植入材料,红色为骨组织。白色虚线上部为材料植入区域,白色虚线下部为脊柱横突骨组织。在降解方面,从图5 可见S 和S/B 组支架均发生了明显的降解,而S/B/H 组由于存在HPMC 涂层,降解较S、S/B 组慢。在成骨方面,S 组新骨生成作用有限, S/B 组在交界处可见明显新生骨组织, S/B/H组内部生成的新生骨组织最多。
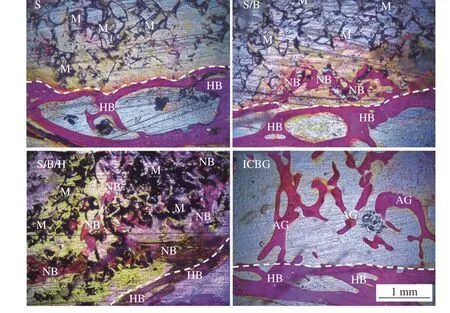
图5 材料植入84 d 时组织切片VG 染色Fig.5 VG staining of bone tissue at 84 d
2.4 生物力学
通过考察融合节段的刚度和拉伸强度来评价融合效果。图6(a)所示为材料植入84 d 后脊柱前屈和背伸的挠度,以万能试验机探头应力达到10 N 时探头的位移量表示。由图可得ICBG 组前屈和背伸的挠度最低,说明ICBG 组脊柱刚度最大,融合效果最好。在3 组支架材料中, S/B/H 组前屈和背伸的挠度最接近于ICBG组,表明S/B/H 组的融合效果最接近于自体骨。

图6 材料植入后84 d 脊柱生物力学分析Fig.6 Biomechanical evaluation of spines at 84 d post-operation
图6(b)所示为材料植入84 d 后脊柱的拉伸强度,以断裂时力与相应位移的比值表示。从图6(b)可以看出,ICBG 组的拉伸强度最高,融合效果最好。3 组支架材料中, S/B/H 组的拉伸强度高于S 组和S/B 组,且最接近ICBG 组,说明S/B/H 释放的rhBMP-2 能够有效促进横突间新骨生长而进一步提高融合效果,可作为自体骨的替代物。
从micro-CT、VG 染色和生物力学结果可以看出,单纯聚乳酸/磷酸钙支架促进成骨的作用有限;支架负载rhBMP-2 后使横突间形成了明显的骨小梁结构,成骨量显著增加;HPMC 涂层改性使支架能够缓慢释放rhBMP-2[23],延长rhBMP-2 的作用时间,持续有效的诱导成骨作用使HPMC 涂层改性的载rhBMP-2支架在生物力学方面达到了接近自体骨的融合效果,能够使椎体间形成骨性融合。
rhBMP-2 优异的诱导成骨作用已经得到了大量基础研究及临床应用的证实[12,24-26],但其安全性也越来越引起重视。据报道,rhBMP-2 相关的副作用包括炎症、破骨细胞介导的骨吸收、脂肪化等,尤其在应用于颈椎融合时,易出现颈部肿胀和吞咽、呼吸困难,但目前仍存在争议[27]。目前rhBMP-2 相关副作用的报道以胶原海绵载体为主,应用在脊柱融合时每融合节段使用剂量高达4.2~12 mg[28],且rhBMP-2在胶原海绵上主要为扩散释放模式,停留时间为5 d 左右[29]。因此,rhBMP-2 副作用的产生可能与过高的使用浓度或过快的释放速率有关[14]。Wen 等[30]总结了2003 年至2017 年rhBMP-2 应用于颈椎融合的有效性和并发症情况,发现rhBMP-2 剂量越高越易出现并发症,推荐使用剂量为每节段0.7 mg。在控制使用剂量的同时,控制释放速率也很关键。本文制备的HPMC 改性载rhBMP-2 支架中rhBMP-2 随HPMC 涂层的降解而缓慢释放,前期研究显示,7 d时rhBMP-2 体外释放量累计为50%,且始终保持较低的释放速率,而未经HPMC改性的支架7 d 时rhBMP-2 体外释放量为70%[23]。因此,以HPMC 涂层改性的聚乳酸/磷酸钙支架体系作为rhBMP-2 载体,不仅具有良好的可降解性和骨传导性,而且在发挥持续有效的骨诱导作用的同时,可避免因rhBMP-2 局部浓度过高而可能产生的不良反应。
3 结 论
(1)制备了具有可塑性的聚乳酸/磷酸钙多孔支架,并将活性因子rhBMP-2 负载于支架表面,进一步通过HPMC 涂层对支架表面进行改性。支架丰富的多孔结构为新骨生成提供了有利条件。
(2)通过兔脊柱融合实验证明了HPMC 涂层改性的载rhBMP-2 聚乳酸/磷酸钙多孔支架在促进脊柱融合方面的良好作用。Micro-CT、VG 染色和生物力学实验结果表明该支架能够诱导椎体间新骨生成,脊柱达到骨性融合,可作为替代自体骨的理想植骨材料之一。
