鸡乳酸脱氢酶A 基因突变对DF-1 细胞能量代谢和法氏囊病毒增殖的影响
2024-01-05李祥超易小萍
李祥超, 易小萍
(华东理工大学生物反应器工程国家重点实验室, 上海 200237)
DF-1 细胞来源于ELL-0(East Lansing Line)鸡胚胎,是Chicken Embryo Fibroblast(CEF)永生化的细胞系,可无限繁殖,因此具备比CEF 更大的增殖能力[1]。该细胞缺少禽白血病病毒、肉瘤病毒群病毒相关的内源片段,支持禽反转录病毒的复制,已被广泛应用于禽类病毒的增殖和疫苗的生产,例如马立克病毒[2]、禽 流 感 病 毒[3-4]、Infectious Bursal Disease Virus[5-6](IBDV)等。但DF-1 细胞的IBDV 生产能力较低,因此有效提高DF-1 细胞的IBDV 增殖能力具有重要的研究价值。
许多体外培养的哺乳动物细胞系表现出类似Warburg 效应的表型,具有增强的糖酵解通量和高乳酸积累,正如Otto Warburg 描述的癌细胞,这种表型通常不是归因于低氧环境,而是细胞诱导或自发形成以及对体外培养的适应[7]。体外培养动物细胞中的丙酮酸有很大一部分在乳酸脱氢酶的催化下还原为乳酸,一些哺乳动物细胞系中葡萄糖转化为乳酸的比率高达90%[8]。这种糖酵解方式会导致乳酸的积累,最终导致培养基的酸化,从而抑制细胞的快速生长。以病毒为最终产物的细胞培养过程中,病毒的增殖依赖于宿主细胞的物质和能量代谢,在病毒快速增殖的中后期细胞糖酵解速率下降,无法及时提供病毒大量增殖所需能量,从而限制病毒增殖[9-10]。乳酸主要是通过乳酸脱氢酶A 将葡萄糖代谢产生的丙酮酸转化而来,减少乳酸积累的常用手段是敲除或者下调乳酸脱氢酶A,这种方法能够有效减少乳酸生成,同时不损害细胞活力或生产力。
由于生物技术的快速发展,基因编辑技术CRISPR/Cas9 系统可实现对动物细胞的靶向基因快速稳定的突变。目前CRISPR/Cas9 系统已经广泛应用于病毒、细菌、酵母、霉菌[11]、植物、昆虫、鼠、鱼和人种属细胞中。基于鸡体细胞在遗传发育研究上的重要作用,Véron 等[12]首先将CRISPR/Cas9 系统应用于鸡细胞,通过CRISPR 突变Pax7基因研究动物模型中调控发育的分子机制。Abu-Bonsrah 等[13]则使用CRISPR/Cas9 系统敲除了DF-1 细胞和DT40 细胞中的6 个遗传相关基因,该研究证明利用CRISPR/Cas9 系统可对鸡细胞基因组进行精确的靶向遗传操作,并证明CRISPR/Cas9 系统在鸡细胞上的操作可行性和高效性。
本研究首先在人CRISPR 载体基础上对启动子进行优化,建立适用于DF-1 细胞的CRISPR 载体,随后应用该系统对DF-1 细胞的鸡乳酸脱氢酶(GgLDHA)基因进行定向突变,获得多株不同基因突变型的单克隆细胞株,并对这些重组细胞株的基因型、蛋白表达和乳酸脱氧酶(LDH)酶活进行分析验证;同时进一步对突变细胞株的生长、葡萄糖和乳酸代谢、能量代谢以及IBDV 增殖进行综合分析,系统研究GgLDHA基因突变对DF-1 细胞能量代谢以及IBDV增殖的影响。
1 材料和方法
1.1 LDH 同工酶分离和鉴定
(1)破碎细胞:取适量细胞重悬于磷酸盐缓冲液(PBS)中,将其置于冰上用超声破碎细胞。细胞破碎后,将样品液在4 ℃下13 000 r/min 离心10 min,取上清保存待用。(2)蛋白浓度测定:以牛血清白蛋白为对照,测定样品上清中的蛋白浓度(PierceTMBCA 蛋白测定试剂盒,Thermo Scientific)。(3)电泳和同工酶显色:制备7.5%(75 g/L,下同)非变性PAGE凝胶,预电泳20 min;每孔上样15 μg 总蛋白,在Tris-甘氨酸缓冲液(pH 8.9)体系中电泳,后对LDH 同工酶进行活性显色,最后加入脱色液终止酶反应。
1.2 GgLDHA 基因突变的DF-1 细胞株构建
1.2.1 靶向GgLDHA基因的px458-sgRNA 设计和构建 靶向GgLDHA基因的sgRNA 通过在线设计工具(Optimized CRISPR Design 和CRISPR direct)设计得到,筛选出评分较高的sgRNAs,其相关引物序列见表1 所示。sgRNA 构建参考Ran 等[14]的方法构建,其中引物(5’-TTCGCCACCTCTGACTTGA-3’)用于sgRNA 测序分析。所有引物合成和测序工作由生工生物工程公司完成,px458 质粒购自Addgene 库。

表1 靶向GgLDHA 基因的sgRNA 构建的引物序列Table 1 Primer sequences in the sgRNA construction targeting toGgLDHA gene


1.3 Western Blot 检测
用RIPA(Beyotime)裂解液提取DF-1 野生型细胞和各个突变型单克隆细胞的蛋白,使用PierceTMBCA 蛋白测定试剂盒检测其总蛋白浓度。提取的每一蛋白样品经7.5%的SDS-PAGE 电泳,电泳后的蛋白被转移到硝化纤维素膜上。转移的蛋白在QuickBlockTMWestern Blot 阻断缓冲液(Beyotime)阻断后,先后用抗LDH 抗体和辣根过氧化酶(HRP)偶联的羊抗兔免疫球蛋白(Goat anti-rabbit IgG)抗体孵育,其中甘油醛-3-磷酸脱氢酶(GAPDH)用作内参蛋白。所有抗体均购自Abcam 公司。
1.4 LDH 酶活测定
样品上清的总LDH 酶活测定按照LDH 活性检测试剂盒(Sigma-Aldrich)的操作步骤进行:收集样品上清,在4 ℃、12 000g条件下离心15 min,加入试剂盒的工作溶液后,在450 nm 处读取样品的吸光度,以相对野生型细胞的百分数表示结果。
1.5 DF-1 细胞生长、葡萄糖和乳酸代谢以及能量代谢分析
1.5.1 DF-1 细胞生长 本文所用DF-1 细胞来自于本实验室保存。将DF-1 细胞以每毫升3×105个细胞的密度接种于T25 方瓶中,置于培养箱(37 ℃,φ=5%CO2,70%湿度)中培养。细胞培养所用的培养基为含φ=5% 胎 牛 血 清(FBS)的DMEM/F12(培 养基DMEM 与F12 的体积比为1∶1,下同),培养体积为5 mL。活细胞密度和细胞活率采用血球计数板计算。当细胞汇合度达到90% 时,以每毫升6×105个活细胞密度进行细胞接种培养,每24 h 取样一次,采用血球计数板分别计算每一时间点的活细胞密度,用于绘制细胞生长曲线。每个样品重复3 个平行实验。同时收集细胞培养上清,用于检测葡萄糖和乳酸含量。
1.5.2 葡萄糖和乳酸含量测定 将上述所得的细胞培养上清,采用生物传感分析仪(济南延和生物科技有限公司)测定其葡萄糖和乳酸浓度,用于计算葡萄糖消耗速率(GCR)和乳酸生成速率(LPR)。
1.5.3 线粒体呼吸测定 细胞的线粒体呼吸采用Oxygraph-2k 呼吸检测仪(OROBOROS 公司)测定,操作步骤参考Zhao 等[15]描述:将野生型和突变型单克隆细胞正常传代,48 h 后重悬细胞至DMEM/F12培养基中,根据细胞计数结果将细胞稀释至每毫升1.0×106个细胞;然后加入至Oxygraph-2k 呼吸检测仪的测定仓中,封闭仓后测定细胞的基础氧呼吸速率ROUTINE;加入1 μL(2 μg/mL)寡霉素,记录此时氧气消耗速率LEAK;然后逐步加入羰基氰化物4-(三氟甲氧基)苯腙(FCCP)解偶联剂,氧气消耗速率逐渐升高至平稳,记录此时氧气消耗速率(ETS);最后加入抗霉素A 和鱼藤酮(Sigma 公司)来抑制电子传递链的复合物I 和III,氧气消耗速率会急剧下降至平稳,记录为ROX。
1.5.4 腺苷三磷酸(ATP)浓度测定 ATP 胞内浓度测定采用的是ADP/ATP 比率检测试剂盒(Sigma 公司)。本实验将对照细胞株的胞内ATP 水平设置为100%,由此计算得到各克隆细胞株的胞内总ATP 相对含量。
1.5.5 IBDV 滴度测定 当培养的DF-1 细胞汇合度达到90% 时,移除培养上清,加入新鲜DMEM/F12培养基,接种IBDV 病毒。当80% 左右的细胞发生病变后,结束细胞培养,反复冻融3 次,收获病毒。IBDV 病毒滴度(TCID50)参照Chen 等[16]描述:将待检测病毒样品进行梯度稀释(10-1~10-10),然后将每一稀释样品接种于96 孔板的DF-1 单层细胞中,每一梯度的病毒稀释液接种6 个复孔。在显微镜下观察细胞病变效应(CPE),其特征为细胞变圆、脱落和裂解,并使用Reed-Muench 法计算TCID50。
2 结果与讨论
2.1 LDH 同工酶鉴定和GgLDHA 基因型确认
LDH 是催化丙酮酸与乳酸相互转变的同工酶,不同类型的同工酶是由A 或B 亚基组成的四聚体,具有不同的相对分子量,通过PAGE 电泳方法可以将其分离,DF-1 细胞株的LDH 同工酶的表达分析如图1 所示。从图1 可以看出,LDH5 显色较深,而LDH5 由4 个LDHA 亚基组成,推测在DF-1 细胞中LDHA 表达占据主导地位。因此,本研究选择GgLDHA基因作为靶向基因对其进行基因突变。对本研究采用的野生型DF-1 细胞中的GgLDHA基因序列进行测序确认(NCBI Reference Sequence:NC_006092.3)。测序结果表明,GgLDHA基因的部分序列大小1 076 bp(含部分内含子、外显子exon 4 和exon 5), 与NC_006092.3 存在7 个碱基的差别,同源性为99.3%。基于基因测序结果,针对设计靶向GgLDHA基因的sgRNA 设计具体见表1 所示。
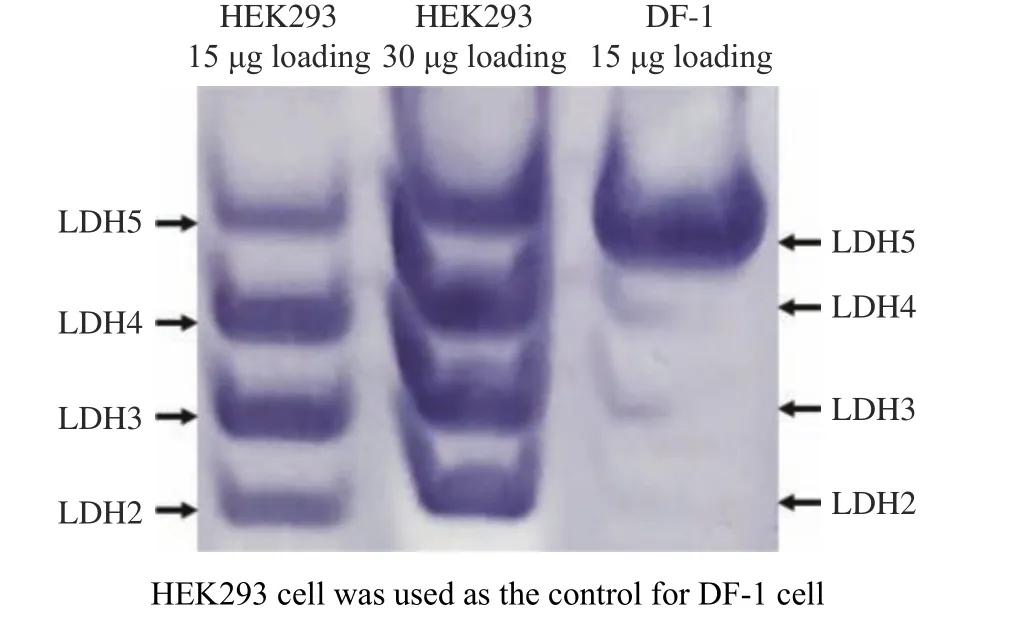
图1 DF-1 细胞株的LDH 同工酶表达分析Fig.1 LDH isoenzyme expression in DF-1 cell
2.2 CRISPR 载体优化、靶向GgLDHA 的sgRNA构建及活性验证
将px458 质粒直接转染DF-1 细胞,在荧光显微镜下未观察到任何绿色荧光蛋白(GFP)阳性细胞。推测px458 质粒载体中巨细胞病毒重组启动子(CBh)在鸡胚细胞中未能有效启动Cas9蛋白表达,而Cas9 蛋白的表达对于CRISPR系统发挥基因编辑是必须要素。因此,将CBh 启动子更换为更通用的巨细胞病毒(CMV)启动子,并将px458 质粒载体中的人U6 启动子(huU6)更换为鸡U6(chU6)启动子,具体过程如图2(a~c)所示。CMV序列和chU6 都通过PCR扩增得到,其中CMV序列是以pCI-neo 为扩增模板和同CMV 配对的引物对扩增所得。将px458 质粒载体和CMV 的PCR 片段同时用KpnI 和AgeI 内切酶处理,然后用T4 连接酶连接获得px458-CMV 载体。采用CMV 启动子替换CBh 启动子后,GFP 蛋白在DF-1 细胞中获得正常表达如图2(d)所示。由于Cas9 蛋白与GFP蛋白通过2A 肽(T2A)共用CMV 启动子,所以GFP 蛋白的高表达间接表征Cas9 蛋白在DF-1 细胞中获得了高表达。
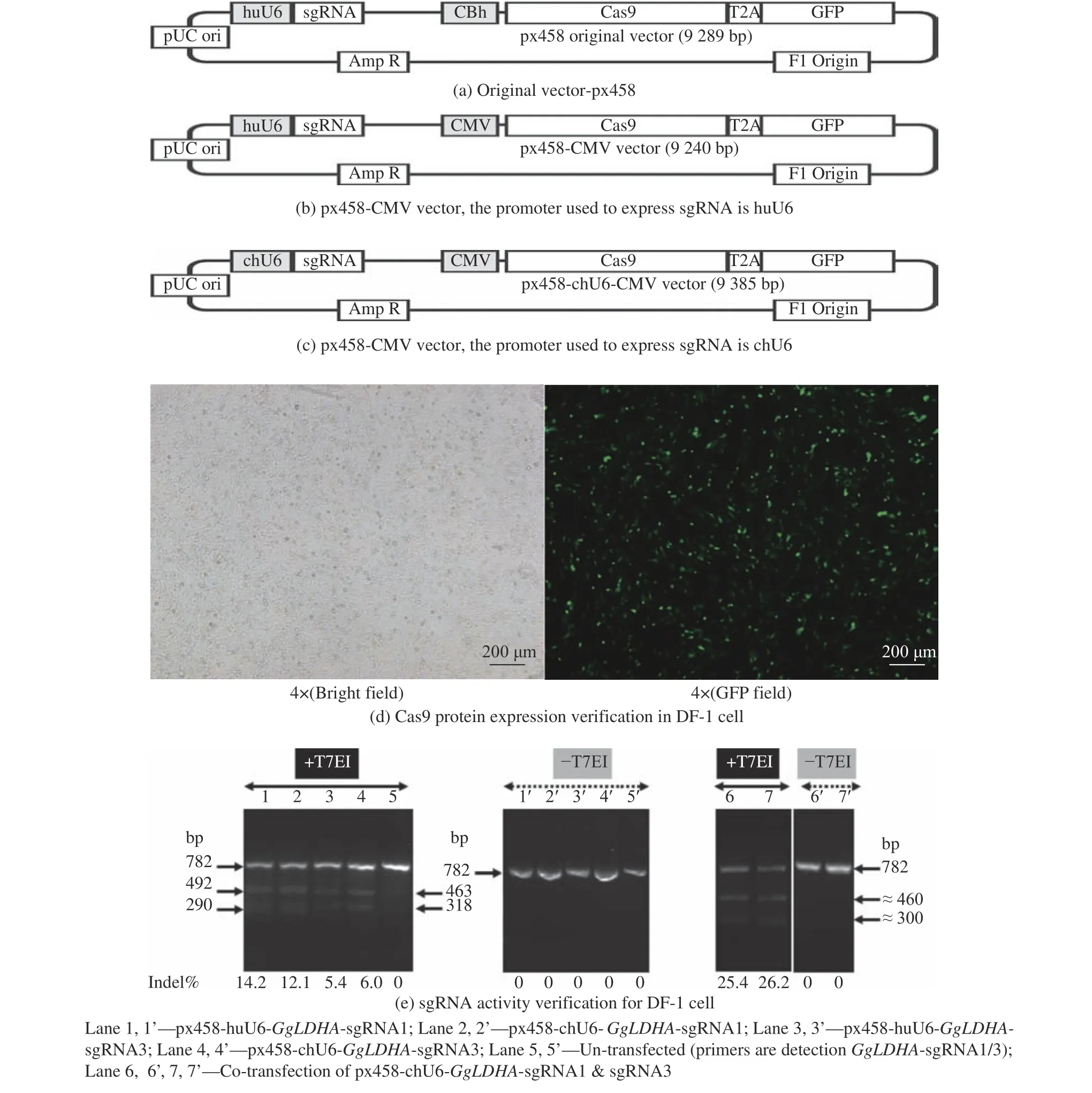
图2 适用于DF-1 细胞的CRISPR 载体构建过程和DF-1 细胞中Cas9 蛋白表达验证Fig.2 Processes of CRISPR vector construction suitable for DF-1 cell and Cas9 protein expression verification in DF-1 cell
II 型CRISPR 系统中采用人III 型RNA 聚合酶U6 启动子起始sgRNA 转录,考虑到huU6 和chU6启动子的种属差异性,且Gandhi 等[17]的研究中发现chU6 启动子能够获得比huU6 启动子高4 倍的sgRNA 表达,因此本研究尝试采用chU6 启动子替换huU6 启动子,结果表明(图2(e)),在DF-1 细胞中,huU6 和chU6 启动子具有相似的活性,推测chU6 启动子可能存在DF-1 细胞不具备的调控因子。通过T7EI 错配识别酶的切割作用,对sgRNA 活性进行评价。研究发现,单条sgRNA 转染的Indel% 很低,通过共转染sgRNA1 和sgRNA2,可将Indel% 显著提高,相较单一sgRNA 转染分别提高了2 倍和4 倍。
2.3 GgLDHA 基因突变的DF-1 单克隆细胞株鉴定
通过转染重组CRISPR 载体,结合流式细胞仪分选,共获得13 株GgLDHA基因突变的单克隆DF-1 细胞株,分别标记为MC1~MC13,基因突变株的基因型、蛋白表达和酶活分析如图3 所示。对突变序列进行基因测序鉴定发现(图3(b)),基因突变大多发生于双链断裂(DSB)附近,且造成中间29 bp 片段的删除。从13 株突变型细胞株基因型分析发现,既存在GgLDHA基因的纯合突变,也存在如MC1、MC10、MC11 的嵌合突变,存在一定的随机性。因突变发生于exon 5 编码区(图3(a),PAM 为原间隔相邻基序),且插入或删除的碱基数不是3 的倍数,因此预测基因大多发生了移码突变。值得注意的是,由于MC1 突变株发生嵌合GgLDHA基因突变,加上比其他克隆更高的Western Blot 印迹表达,因此未对其检测LDH 酶活性。MC4 和MC6 突变株后期生长不佳,推测可能发生脱靶,影响了细胞生长,未能获得蛋白和酶活数据。
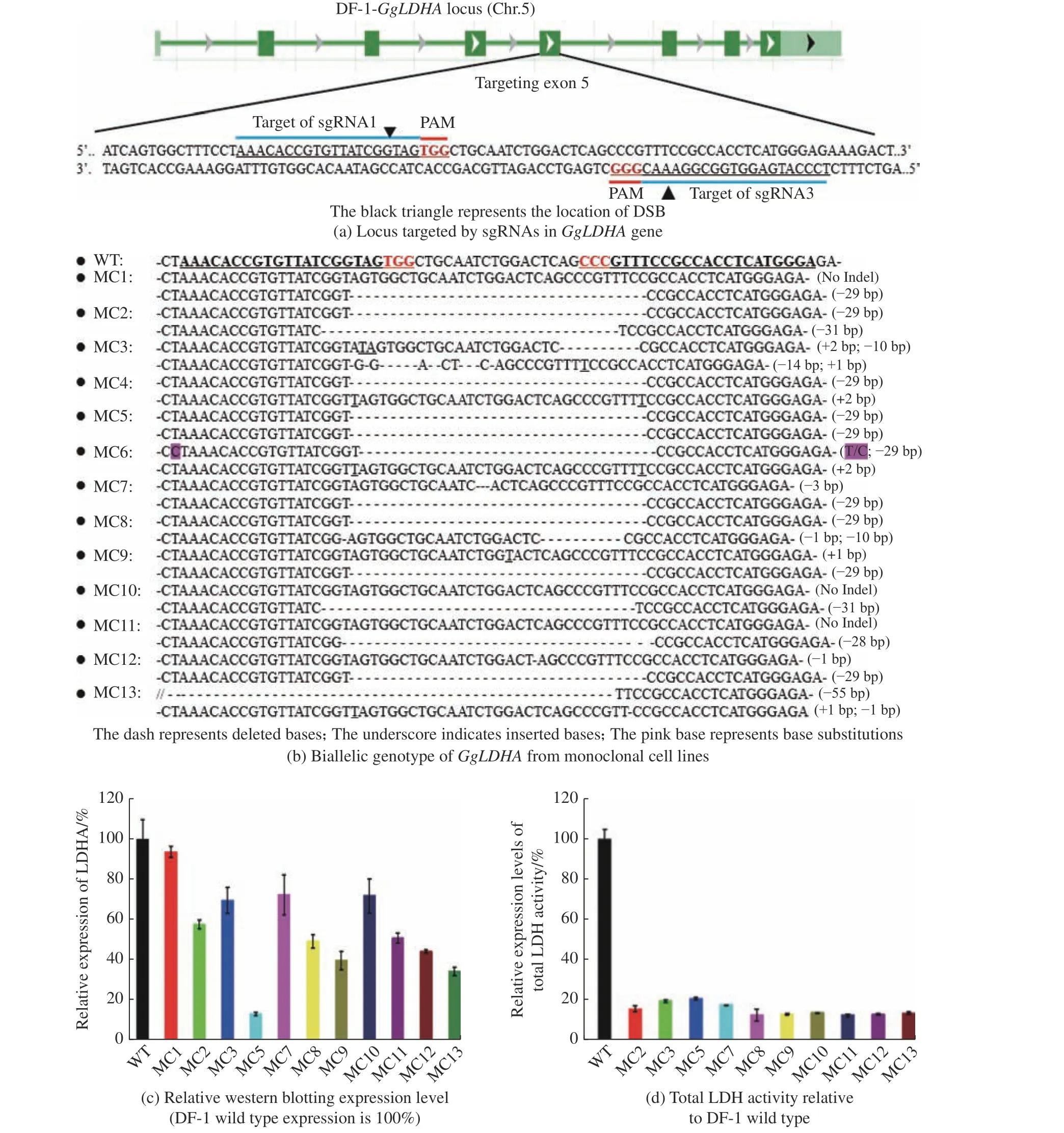
图3 GgLDHA 基因突变克隆株的基因型、蛋白表达和酶活分析Fig.3 GgLDHA mutation monoclonal genotype, protein expression and LDH activity
通过Western Blot 进一步验证基因突变对LDHA蛋白表达的影响,从图3(c)可以看出,突变细胞株的LDHA 相对表达水平出现不同程度的降低。其中MC5 的LDHA 相对表达水平只有对照细胞的14%,MC2、MC8、MC9、MC11、MC12、MC13 的LDHA 相对表达水平约为对照细胞的30%~60%。综合分析表明,不同突变形式和位置对LDHA 蛋白表达可产生不同的影响,双链DNA 中不是3 倍数的碱基数的片段缺失,可造成蛋白表达水平显著下降。
LDHA 作为LDH 的重要组成亚基,基因突变会直接减弱LDH 总酶活。将对照细胞中LDH 总相对酶活标记为100%,LDH 总酶活的测定结果(图3(d))显示,相比于对照细胞,几乎所有的突变细胞株LDH 总酶活均显著下降,只有对照细胞株的10%~20%。LDH 酶活结果与LDHA 蛋白表达,呈现不完全相同的趋势,推测可能突变部位选择的是LDHA 酶关键活性区域,突变对酶活影响显著。上述研究结果表明对GgLDHA基因进行定向突变,可显著降低DF-1 细胞的LDH 总酶活性。
2.4 GgLDHA 基因突变对DF-1 细胞生长、葡萄糖和乳酸代谢的影响
为评价GgLDHA基因突变对DF-1 细胞生长和代谢的影响,本文选取2 株突变型单克隆细胞株(MC2 和MC5)进行细胞生长、葡萄糖和乳酸代谢的探讨,结果如图4 所示。由图可见,相比于对照细胞,GgLDHA基因突变对DF-1 细胞生长无明显的影响,但整个培养过程(96 h)的平均GCR 明显下降(图4(b)),平均LPR 也显著降低(图4(c))。相比于对照细胞,突变株MC2、MC5 的平均GCR 分别下降13%和23%;平均LPR 则分别下降了24%和41%。净乳酸的产量与净葡萄糖的消耗量之比(LPR/GCR)比值可以表征葡萄糖进入乳酸生成途径的通量,从图4(d)可以发现,对照细胞LPR/GCR 达到了2.1,而突变株该比值明显降低,MC5 最低降至1.6,降低了24%。表明GgLDHA突变能在不影响细胞生长的前提下,有效降低乳酸生成速率。
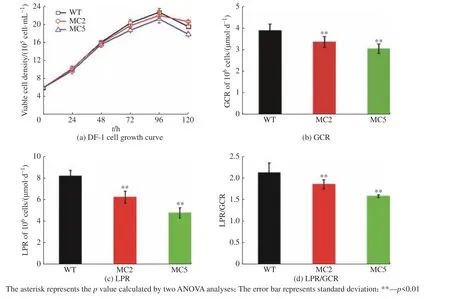
图4 野生型和突变型DF-1 细胞株的细胞生长、葡萄糖和乳酸代谢对比Fig.4 Comparison of cell growth, glucose and lactic acid metabolism between wild type and mutant DF-1 cells
2.5 GgLDHA 基因突变对DF-1 细胞能量代谢、IBDX病毒增殖的影响
为评估GgLDHA基因突变对DF-1 细胞有氧代谢速率和能量代谢效率的影响,本文采用线粒体呼吸测定仪测定氧呼吸速率,结果如图5 所示。由图可见,相比于对照细胞,两株突变细胞株的R/E 都有所增加,净呼吸比值(Net R/E)也明显增加,表明在突变细胞株中更多比例的氧气用于ATP 合成,突变细胞株的有氧呼吸速率明显加强。
图5 野生型和突变型DF-1 细胞株的的能量代谢和IBDV 病毒滴度Fig.5 Cell energy metabolism and IBDV titer of wild type and mutant DF-1 cells
胞内总ATP 浓度可以用来表征细胞的能量状态,为进一步探索GgLDHA基因突变对DF-1 细胞能量代谢的影响,对比野生型和突变株的胞内总ATP水平,结果如图5(b)所示,设对照细胞中胞内ATP浓度为100%,突变细胞株的胞内ATP 浓度明显提高,其中MC5 突变细胞株的胞内ATP 浓度增加了57%,表明在丙酮酸生成乳酸通量减少的同时,进入三羧酸(TCA)循环的通量增加,产生了更多的ATP,突变细胞株的能量代谢效率明显改善。结合代谢分析中突变细胞株葡萄糖消耗速率的明显下降,表明突变细胞株的葡萄糖利用效率得到明显提高。
DF-1 细胞是IBDV 的良好宿主细胞,IBDV 病毒的复制、增殖严格依赖于宿主细胞为其提供物质和能量。对照细胞的相对IBDV 滴度为1,与对照细胞相比,突变细胞株MC2 和MC5 的相对IBDV 滴度分别提高了2 倍和5 倍(见图5(c))。突变细胞株的IBDV 滴度显著增加,突变细胞株的IBDV 增殖能力明显增强。表明DF-1 细胞能量代谢状态的改善有效促进了IBDV增殖。
3 结 论
本研究采用CRISPR/Cas9 系统对DF-1 细胞的GgLDHA基因进行了定向突变。首先对原适用于人的CRISPR 载体px458 进行了改造,用CMV 启动子替换CBh 启动子,同时用chU6 启动子替换huU6 启动子,最终获得了能够适用于DF-1 细胞的CRISPR载体px458-chU6-CMV。采取共转靶向同一基因的2 条sgRNA,通过造成中间大片段的删除,有效提高了Indel%。基因鉴定结果显示,多株突变细胞中GgLDHA基因发生29 bp 的删除,这有可能是共转靶向GgLDHA基因的2 条sgRNA 靶向位置相距适中,可以为Cas9 蛋白造成DSB 提供空间位阻,从而造成中间大片段的删除。基因型鉴定结果表明大部分突变型细胞株的GgLDHA基因突变发生于sgRNA1 和sgRNA2 引起的DSB 处,但也存在例外,如MC3 细胞株的一条染色体GgLDHA基因型发生2 bp 的插入和10 bp 的删除,而另外一条染色体的等位基因处发生1 bp 的插入和14 bp 的删除。MC13细胞株的一条染色体中GgLDHA基因发生55 bp 的删除,而另外一条染色体的等位点发生1 bp 的插入和1 bp 的删除。综合分析基因型鉴定结果表明,CRISPR/Cas9 系统实施的靶向基因突变存在部分随机性,移码突变是造成靶向蛋白LDHA 酶活下降的主要原因。采取共转靶向同一基因2 条sgRNA 的方法,能够有效获得大片段移码突变。
在DF-1 细胞中,乳酸代谢与细胞的能量代谢密切相关。本文中在野生型DF-1 细胞快速生长阶段(0~96 h),其乳酸分泌速率高达约8.2 μmol/(106cell·d),而葡萄糖消耗速率约为3.9 μmol/(106cell·d),乳酸对葡萄糖的得率为2.1,表明在野生型DF-1 细胞中绝大部分葡萄糖进入了乳酸生成的代谢途径。在氧化磷酸化过程中,每分子葡萄糖能够获得36 个ATP,而在糖酵解过程中,每分子葡萄糖只能获得2 个ATP,是一种较为低效的能量代谢过程。显然,野生型DF-1细胞更倾向于采用糖酵解这种低效但快速产能的代谢方式,可为DF-1 细胞的病毒增殖提供有效的能量补充。Xie 等[18]通过多基因来调控丙酮酸相关代谢,通过减少丙酮酸到乳酸的通量,增加丙酮酸进入TCA 循环的通量,有效提高了HEK 293 细胞的腺病毒产量。
GgLDHA基因的突变对DF-1 细胞生长无明显影响,却能够改善葡萄糖的利用效率。有研究[19]证明LDHA 和LDHB 基因丢失,不会损害细胞生长而且还会促进线粒体能量代谢。然而,乳酸代谢使得细胞的体外培养通过糖酵解能够自给自足,烟酰胺腺嘌呤是维持糖酵解运行的关键物质,其在丙酮酸转化为乳酸的过程中生成,所以葡萄糖供给充足时,糖酵解就由细胞快速完成产能。TCA 循环和氧化磷酸化涉及众多酶和底物,制约因素较多,糖酵解的独立性摆脱了后续众多因素的制约,保障了细胞能量供给的稳定性和安全性。与氧化磷酸化相比,虽然糖酵解产生ATP 效率低,但速率得到提升,单位时间内产能增加,当糖酵解快速进行时,其ATP 产量很容易超越氧化磷酸化,Pfeiffer 等[20]认为这种低效高产的能量形成方式在能量竞争中更具有生长优势。这种能量代谢模式在细胞快速生长时保证了快速和稳定的能量供应,然而在病毒增殖期,葡萄糖的这种代谢模式明显下降,不能及时供给病毒大量增殖所需的能量需求。本文发现在DF-1 细胞中,GgLDHA基因突变可在不影响DF-1 细胞生长的情况下明显改善DF-1 细胞代谢状态,促进葡萄糖的利用效率。突变细胞株MC2 乳酸分泌速率降至6.3 μmol/(106cell·d),而葡萄糖消耗速率约为3.4 μmol/(106cell·d),乳酸对葡萄糖的得率降为1.8,乳酸的分泌速率和乳酸对葡萄糖的得率都得到明显改善;而MC5 的乳酸分泌速率则进一步降低至4.8 μmol/(106cell·d),葡萄糖消耗速率也降低至3.0 μmol/(106cell·d),乳酸对葡萄糖的得率进一步降为1.6,其对葡萄糖利用效果的改善更为明显。
病毒复制需要来源于宿主细胞提供能量和大分子前体。Munger 等[21]采用HCMV 病毒感染人成纤维细胞,发现细胞的糖酵解和TCA 循环的代谢物水平增加,同时相关酶的转录水平也发生了上调,这两个代谢途径不仅能够提供多种大分子代谢物的合成前体,同时也提供能量,说明病毒的增殖与细胞的能量状态密切相关。DF-1细胞作为IBDV 的宿主细胞,IBDV 增殖严格依赖于宿主细胞的物质和能量代谢。为了深入探索GgLDHA基因突变对DF-1 细胞有氧代谢速率的影响,本文探讨了GgLDHA基因突变对DF-1 细胞有氧呼吸代谢和能量代谢的影响。研究发现,相比于对照细胞株,突变细胞株的R/E、Net R/E 均有所增加,显示更多比例的氧气用于后续ATP 的合成。进一步分析胞内ATP 浓度表明,相比于对照细胞,MC5 和MC2 突变细胞株的胞内ATP 浓度较对照细胞分别增加了57%和40%,推测葡萄糖酵解生成的丙酮酸更多进入TCA 循环中生成乙酰,通过有氧代谢产生更多的ATP,有效提高了能量代谢效率。突变株和对照细胞株的IBDV 病毒感染研究表明,MC2 和MC5 突变细胞株的IBDV 增殖能力明显增强,病毒滴度较对照细胞显著增加,相比于对照细胞株,MC5 和MC2 突变细胞株的相对病毒滴度分别提高了5 倍和2 倍。由以上可见,促进DF-1 细胞的能量代谢,有利于促进IBDV 在DF-1 中的增殖。
总之,针对DF-1 细胞,本研究重新优化构建了适用于DF-1 细胞的CRISPR 载体,发现chU6 和huU6启动子具有相似的活性,CMV 启动子和Cas9 蛋白在DF-1 细胞中具有良好的转录和表达活性。同时还发现共转染2 条sgRNA 的方法,可以显著提高Indel%。采用优化的CRISPR 载体成功获得了13 株GgLDHA基因突变型单克隆细胞株,对突变株细胞生长、物质、能量代谢以及病毒增殖综合分析表明,发生GgLDHA基因型突变不会影响细胞正常生长,可有效减少乳酸生成,提高葡萄糖的利用效率,明显改善DF-1 细胞能量代谢效率,显著提高IBDV 病毒滴度。本研究为提高IBDV 疫苗的生产能力提供了一种新思路。
