DCN通过VEGF因子抑制乳腺癌MCF-7细胞增殖的实验研究
2024-01-04鞠文博鞠欣达刘岩峰北华大学基础医学院吉林吉林132013
鞠文博,鞠欣达,刘岩峰 (北华大学基础医学院,吉林 吉林 132013)
乳腺癌是最常见的恶性肿瘤之一,对女性的健康构成极大的威胁。因此乳腺癌新治疗手段的研究一直是医学研究领域的热点。当前早期乳腺癌的临床治疗方法是以手术治疗为主,然后辅以放化疗,预后差、复发率高。最理想的治疗方法就是靶点的基因治疗[1]。
核心蛋白聚糖(decorin,DCN)是小分子蛋白多糖,含有丰富的亮氨酸,含有1 个44 kD 左右的核心蛋白和1 条硫酸皮肤素侧链[2],是国际生物医学科研的一个热点。而研究最广泛的是DCN 对癌症细胞的抑制性作用。利用DCN 作为有效的抑癌元素,通过病毒介导的方式开发有效的、有临床应用潜力的基因治疗手段[3]。DCN 是细胞外基质的重要成分,其主要作用有:促进细胞增殖与分化、维持细胞外基质蛋白的生物活性、防止组织器官纤维化等重要作用[4]。DCN 在生物体微环境中分布广泛,也广泛分布于正常组织和肿瘤组织内,因此有其抗肿瘤作用。其主要通过调控受体功能来影响肿瘤细胞的生物活性,这些受体与细胞生长、细胞存活有一定相关性[5]。
血管内皮生长因子(vascular endothelial growth factor,VEGF)与血管的生成有关[6]。肿瘤的转移以及在转移部位的生长主要依赖于肿瘤血管的形成;肿瘤内新生血管是肿瘤细胞早期侵袭的目标,也是肿瘤转移的主要途径。VEGF 能够促进肿瘤内血管生成,使微血管的通透性增加,加强诱导血管及淋巴管内皮细胞的有丝分裂,诱导形成新的血管和淋巴管,为肿瘤向淋巴管转移提供结构基础[7]。
本实验通过DCN 转染乳腺癌MCF-7 细胞,观察DCN 高表达对VEGF 的调控作用,以期发现DCN 通过对VEGF 调控作用,影响乳腺癌MCF-7 细胞的增殖作用,为乳腺癌基因靶点治疗探明机制。
1 材料与方法
1.1 实验材料
MCF-7 细胞株(Bio Vector);Annexin V FITC APOPTOSIS DTEC KITⅠ(BD,美国),Lipofectamine 2000(Invitrogen,USA);兔抗人DCN 抗体(美国);MMLV 反转录试剂盒(Takara,Japan);pcDNA TM 5/FRT 载体(Invitrogen,USA);鼠抗人GAPDH(Bioworld,美国);pcDNA3.1-DCN(锐博,广州);人DCN质粒(柯雷生物);定量反应体系SYBRPremix Ex Taq(Takara,Japan)。
1.2 细胞培养
复苏后的MCF-7细胞RPMI1640培养基中,添加10%胎牛血清,37 ℃细胞培养箱中培养,24 h 换液,观察细胞密度达到90%时,采用胰酶消化法传代,取第3~5 代细胞进行相关实验。取MCF-7 细胞平均分为2 组,正常培养MCF-7 细胞为对照组,转染质粒高表达DCN的MCF-7细胞为DCN组[8]。
1.3 Lipo2000转染质粒诱导细胞高表达DCN
以阳离子脂质体Lipofectamine 2000 为载体,转染到内含DCN 的cDNA 节段,以及FRT 位点的pcDNA™35/FRT质粒载体至MCF-7细胞中。细胞培养后,检测稳定高表达DCN 的MCF-7 细胞各项指标。
1.4 流式细胞仪检测细胞数量
接种MCF-7 细胞到6 孔板,MCF-7 细胞应处于转染后对数生长期,细胞继续生长,密度达到30%~50%时,筛选DCN 转染的MCF-7 细胞。转染细胞72 h 后,500 μL 的结合缓冲液加入5×105个细胞悬浮,后再加入Triton FITC 荧光标记单克隆抗体(fluorescein-isothiocyanate)5 μL 摇匀,然后加PE(phycoerythrin)5 μL 混匀,无光线条件下反应5~15 min。用流式细胞仪(Becton IDickinson Co.)检测细胞数目。
1.5 MTT法检测MCF-7细胞增殖
换液当天开始计时,7 d 后检测。检测时,吸去所有孔中的培养基,于每孔加入培养液200 μL,后加入20 μL MTT,混合均匀,孵育3~4 h于恒温细胞培养箱中。吸去每孔培养基后,每孔加入DMSO 100 μL,继续恒温孵育5~10 min。吸溶液到另一个准备好的干净的96 孔板中,连续光谱微孔板在光波波长490 nm下测每孔溶液的OD值,记录结果[9]。
1.6 VEGF基因表达检测
转染24 h 后24 孔板细胞使用TRlzl 提取各组细胞总RNA 进行RT-PCR 检测。基因VEGF 引物:上游5' -AATCGAGACCCTGGTGGACA-3',下游5' -TTAACTCAAGCTGCCTCGCC-3'。 取RNA 体积为50 μL,然后按照RT-PCR 试剂盒方案:45 ℃条件,45 min 进行反转录反应。PCR 反应条件:94 ℃2 min,反转录酶灭活和RNA/cDNA 引物预变性;94 ℃30 s,52.5 ℃1 min,68 ℃2 min,共重复40次;最后1 次68 ℃持续7 min。在2%琼脂糖凝胶上进行RT-PCR 产物电泳,紫外摄像系统中照相,天能分析软件光密度扫描各条带,检测各组VEGF mRNA RTPCR 产物,及对应的内参GAPDH mRNA RT-PCR 产物A值,分析AVEGF/AGAPDH 的比值[10-13]。
1.7 Western blot 法检测细胞转染后MCF-7 细胞VEGF蛋白表达
DCN转染的MCF-7细胞用含血清及胰岛素的培养基制成单细胞悬液后,1×106个细胞/皿,接种于中培养皿中,培养24 h 后,更换为无血清含胰岛素的培养基48 h,用40 ℃PBS 冲洗细胞3 次,预先将蛋白酶抑制剂cocktail 按1∶100 加入细胞裂解液RIPA 中混匀。加入适量RIPA 冰上裂解30 min,将裂解产物刮下收集于EP 管,12 000 r/min,40 ℃离心15 min。吸取上清液,BCA 法蛋白定量后,50 μg 蛋白经12%SDSPAGE 胶分离后转移到PVDF 膜上,含5%牛奶的TBST 溶液封闭1 h。分别孵育对应一抗4 ℃过夜。TBST 洗膜5 min,共3 次,室温孵育二抗1.5 h。TBST洗膜每次10 min,共3 次。ECL 发光底物曝光显影。ImageJ 1.39 U 分析目的条带的光密度值。以GAPDH作为内参,实验重复4次。
1.8 统计学处理
应用SPSS 13.0 软件进行统计学分析,计量结果采用的方式进行描述,不同组数值比较均采用t检验,P<0.05为差异具有统计学意义。
2 结果
2.1 细胞培养结果
图1为MCF-7细胞培养图片,转染DCN后MCF-7细胞增殖能力较对照组减弱,相同培养周期DCN组细胞数目较对照组减少。

图1 DCN转染MCF-7 24、48、72 h细胞生长情况Fig.1 MCF-7cells transfected with DCN for 24、48、72 h
2.2 流式细胞术检测细胞数量
结果显示MCF-7 细胞转染DCN 后分别继续培养24、48、72 h,与对照组相比较,DCN 组MCF-7细胞数量较对照组明显减少,P<0.05,见表1。
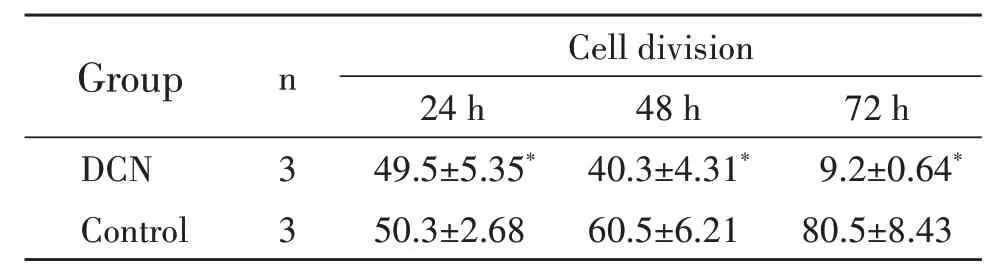
表1 流式细胞仪检测MCF-7细胞数量Tab.1 The flow cytometry measures the number of MCF-7 cells
2.3 MTT法观察各组细胞存活率MTT
结果显示,与对照组相比较,DCN 组细胞存活率明显下降,增殖能力受到显著抑制,P<0.05,见图2。
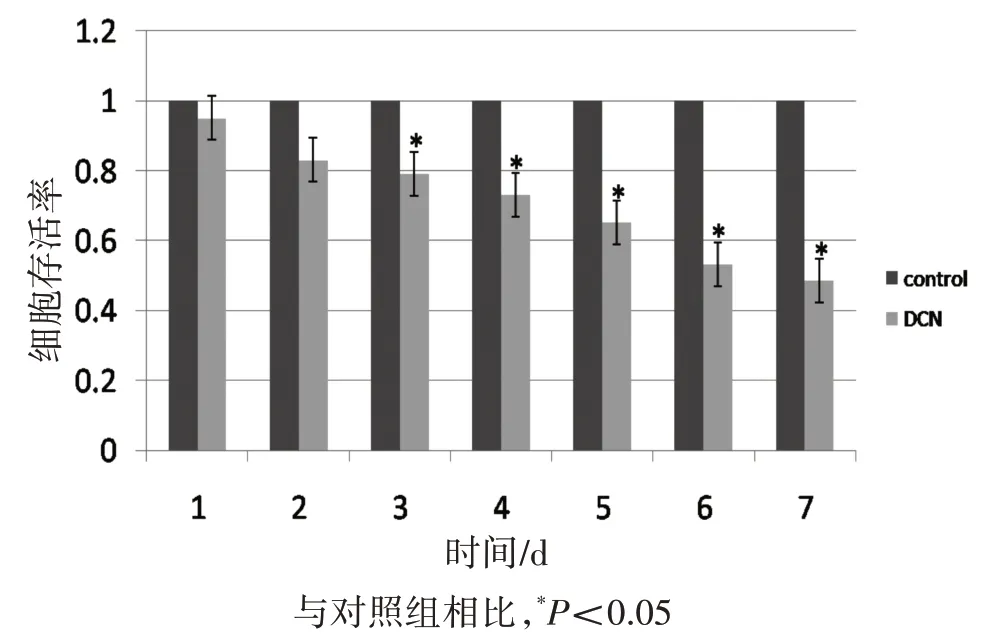
图2 MTT法检测MCF-7Fig.2 Prpliferation of MCF-7 cells was detected by MTT
2.4 RT-PCR检测MCF-7细胞VEGF表达
转染24 h后提取总RNA,电泳见图3。结果显示DCN 组细胞培养24 h 后VEGF mRNA 表达水平相较对照组有降低趋势。

图3 VEGF mRNA电泳图Fig.3 VEGF mRNA electropherogram
2.5 Western blot法检测VEGF蛋白表达
细胞转染DCN 后继续培养24 h,Western blot 法检测MCF-7 细胞中VEGF 蛋白表达水平。结果显示,与正常对照组比较,DCN 组MCF-7 细胞中VEGF蛋白表达水平降低,见图4。
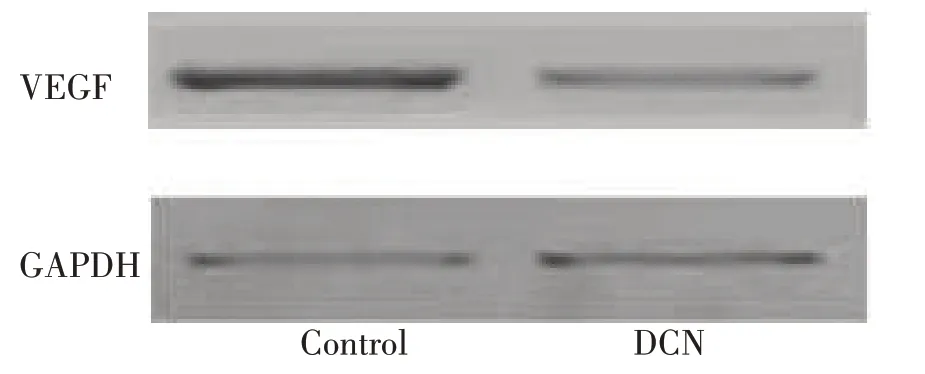
图4 Western blot法检测转染后细胞内VEGF蛋白表达Fig.4 Western blot detection of VEGF protein expression in transfected cells
3 讨论
本研究采取基因克隆重组技术等分子生物学实验方法,以人乳腺癌MCF-7细胞为宿主细胞,构建了一个能够表达核心蛋白聚糖基因的稳定高效筛选系统,将已有的正常核心蛋白聚糖cDNA 中表达相应氨基酸的基因进行点突变。通过亚克隆技术,将含有突变基因的cDNA 以及正常核心蛋白聚糖cDNA 克隆到含有FRT 位点的pcDNA™5/FRT 载体中,从而得到多个能高效表达变异核心蛋白聚糖的细胞株。
QT-RTPCR 技术检测正常及变异核心蛋白聚糖在Flip-In 定点整合和表达系统中mRNA 水平的表达;Western Blot 方法检测正常及变异的核心蛋白聚糖在Flip-In 定点整合和表达系统中蛋白水平的表达。MTT技术检测正常和变异基因对MCF-7细胞的增殖活性的影响;结果显示,DCN 转染乳腺癌MCF-7细胞,DCN 在乳腺癌细胞内高表达后,细胞生长受到抑制。
有研究认为,VEGF 因子是与肿瘤淋巴管生成和淋巴道转移密切相关的。Karkkainen 等[14]研究发现,剔除VEGF 基因的小鼠持续出现组织和淋巴水肿而不缓解。VEGF 因子可能与肿瘤细胞的异型增生和分化有关系[15],VEGF 因子可以引起癌细胞与宿主细胞间相互作用[16],通过细胞自身分泌的方式,VEGF因子调节、保护和刺激内皮细胞增殖、刺激胚胎干细胞和造血干细胞分化。分子作用机理,研究者[17]认为,VEGF 因子通过与受体VEGFR-2/VEGFR-3 结合,使受其发生自身磷酸化(认为是酪氨酸激酶信号系统),信号经过细胞内传导,诱导DNA 有丝分裂增强,增强细胞增殖以及淋巴管出芽生长;细胞内具体的信号传导途径,有待进一步研究。VEGF 因子导致淋巴管生成以及肿瘤组织由淋巴转移的作用是多方面的[18-20],深入研究VEGF 因子的作用机理以及传导途径,对更加深入地认识肿瘤以及淋巴道转移机理,指导肿瘤的基因治疗都具有重要意义。
