双氢青蒿素对胃癌SGC-7901细胞凋亡和侵袭能力的影响
2024-01-04刘师兵董长松朱文赫高金昌吉林医药学院科研实验室吉林吉林303吉林医药学院附属四六五医院消化内科吉林吉林303
刘师兵,董长松,朱文赫,于 洋,林 松,高金昌 (.吉林医药学院科研实验室,吉林 吉林 303;.吉林医药学院附属四六五医院消化内科,吉林 吉林 303)
双氢青蒿素(Dihydroartemisinin,DHA)是青蒿素的衍生物[1],相比于青蒿素,DHA的水溶性更好、生物利用度更高,更容易代谢[2],且对正常组织细胞的毒性很低[3]。随着青蒿素类药物在临床治疗中的广泛应用,其对多种肿瘤细胞的抑制和杀伤作用也得到了关注。研究表明,DHA 对白血病、肺癌、前列腺癌及乳腺癌等多种肿瘤细胞具有促进肿瘤细胞凋亡、抑制肿瘤细胞转移、逆转肿瘤细胞耐药性、抑制肿瘤新生血管形成等多种细胞毒作用[3]。DHA 对胃癌细胞是否也有类似作用成为研究的焦点。本研究通过检测DHA 对胃癌SGC-7901 细胞增殖、形态变化、凋亡数量、侵袭能力以及相关蛋白表达的影响,初步探讨DHA 在SGC-7901 细胞凋亡和侵袭方面的作用及其可能机制。
1 仪器与试剂
1.1 研究对象
细胞株:胃癌SGC-7901 细胞由吉林医药学院科研实验中心提供。
主要仪器:LAS X 激光共聚焦扫描显微镜(德国Leica 公司);Microfuge 16 型离心机(Sigma 公司);MCO-20AIC 二氧化碳培养箱(日本三洋公司);550型酶标仪(美国BIO-RAD 公司);MUSETM 细胞分析仪(美国EMD Millipore 公司);蛋白电泳印迹系统(美国BIO-RAD公司)。
主要试剂:IMDM 培养基、胎牛血清、胰蛋白酶、Bax、Bcl-2、caspase-3、VEGF(均购自Biosharp 广州硕谱生物科技有限公司);CCK-8(北京碧云天生物技术公司);Hoechst 33258 染液(武汉赛维尔生物科技有限公司);基质胶(美国Corning公司)。
1.2 细胞实验
1.2.1 细胞培养与分组
使用含有10%胎牛血清的IMDM 培养基,将SGC-7901 细胞放入恒温37℃、CO2浓度为5%的培养箱中常规培养,0.25%胰蛋白酶消化传代,每2 d传代1 次。根据IC50数据将细胞分为空白组和DHA 低(40 μmol/L)、中(80 μmol/L)、高剂量组(120 μmol/L)。
1.2.2 CCK-8法检测细胞增殖活力
取对数生长期的SGC-7901 细胞接种于96 孔板中,用含有10%胎牛血清的IMDM 培养基混匀细胞,接种浓度约为1×104个细胞/孔,每孔终体积为100 μL,常规培养24 h;用DMSO 溶解DHA 为100 mmol/L,再用IMDM 培养基稀释成不同浓度(25、50、75、100、150 μmol/L),分别加入孔板中,每个浓度重复4 个孔,继续培养24 h 后弃去培养基;用IMDM稀释的CCK-8加入孔板中,3 h后使用酶标仪检测。
1.2.3 Hoechst染色法观察细胞形态变化
接种细胞于6 孔板中,常规培养24 h;根据分组加入相应浓度的药物,继续培养24 h;弃去培养基,加入4%多聚甲醛,常温下固定10 min。弃去固定液,用0.01 mol/L PBS 液洗3 次,每次间隔3 min。加入终浓度为10 mg/L 的Hoechst 33258 染液染细胞核5 min。用0.01 mol/L PBS 液洗3 次,每次间隔3 min。激光共聚焦显微镜下观察细胞核形态变化。
1.2.4 Transwell侵袭实验
选择生长状态良好,融合度达70%~80%的细胞,按分组加入相应剂量的DHA,培养24 h。用4 ℃预冷的基质胶与IMDM 按1∶8 的比例进行混合,每个小室滴加60 μL 稀释后的基质胶并置于24 孔板中,将孔板放入细胞培养箱内聚合3 h。加药后的细胞用0.01 mol/L PBS 液洗2 次,消化、离心收集,再用无血清的IMDM 混悬并离心(1000 r/inm,3 min),以清洗细胞表面的胎牛血清。细胞计数后,每个小室内加入密度为2.5×105的细胞200 μL,下室加入胎牛血清浓度为15%的IMDM 500 μL。继续培养48 h 后,进行结晶紫染色。镜下观察细胞侵袭情况,每组取5个视野进行拍照、计数,取平均值。抑制率=[1-(穿出基质胶的细胞数/原细胞数)]×100%。
1.2.5 Western blot 法检测Bcl-2、Bax、cleaved caspase-3和VEGF蛋白表达
取对数生长期细胞,根据实验分组加入低、中、高浓度的DHA,培养24 h 后弃去培养基,消化、离心收集细胞。加入含有蛋白酶抑制剂(PMSF)的RIPA蛋白裂解液150 μL,超声细胞粉碎仪超声细胞2 次,每次3~5 s,4 ℃放置30 min,蛋白裂解液充分裂解细胞后,高速台式冷冻离心机离心收集上清液。蛋白定量,SDS-PAGE 结束后,将蛋白转移到PVDF 膜上,5%脱脂奶粉封闭1.5 h,PBST 洗3 次,加入1∶1000 的Ⅰ抗,4 ℃过夜。次日PBST 洗3 次,加入HRP 标记的Ⅱ抗(1∶2000),室温摇床孵育1.5 h;PBST 洗5 次,ECL 显色,扫描记录。以β-actin 作为内参照,采用Quantity One 软件进行分析处里,以目标蛋白与内参照蛋白的吸光度比值表示蛋白的相对表达量。
1.2.6 流式细胞术
取对数生长的HepG2细胞接种于6孔板中,接种浓度约为2×105个细胞/孔,常规培养24 h,根据不同药物处理组给药,继续培养24 h 后,胰蛋白酶消化并收集细胞,800 r/min 离心5 min 后弃去上清液,加入IMDM 培养液混悬细胞,使细胞浓度约为1×106个细胞/mL,将细胞原液与MUSETM Annexin-V 凋亡细胞检测试剂1∶1 混匀,避光孵育20 min 后用MUSETM细胞分析仪检测。
1.3 统计学分析
实验数据采用()表示,SPSS 19.2 软件进行统计学分析处理,实验数据均重复3 次,组件比较采用单因素方差分析或重复测量方差分析,两两比较采用LSD-t检验,P<0.05为差异有统计学意义。
2 结果
2.1 双氢青蒿素对胃癌细胞增殖的影响
CCK-8检测结果表明,DHA 能够抑制SGC-7901细胞增殖,随着给药浓度的增加,SGC-7901 细胞活力下降,与空白组比较差异具有统计学意义(P<0.05),即细胞增殖活力与浓度呈负相关。计算IC50为(78.89±0.10)μmol/L,见图1。参考此数据,进行实验分组,DHA 低、中、高剂量组加药浓度分别为40、80、120 μmol/L。
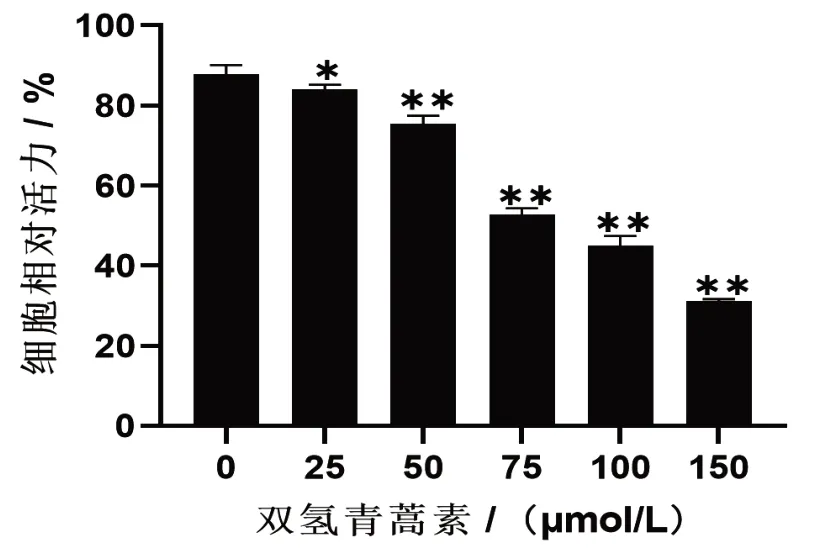
图1 双氢青蒿素对胃癌细胞增殖的影响Fig.1 Effect of dihydroartemisinin on the proliferation of gastric cancer cells
2.2 DHA对SGC-7901细胞核形态的影响
Hoechst 33258 是一种可以穿透细胞膜的膜透性荧光染料,在嵌入双链DNA后释放蓝色荧光,故正常细胞和中早期凋亡细胞均可着色。实验结果显示,低、中、高剂量组的SGC-7901 细胞的细胞核,不同程度地出现固缩和破裂,荧光强度随药物浓度增加而增强。见图2。
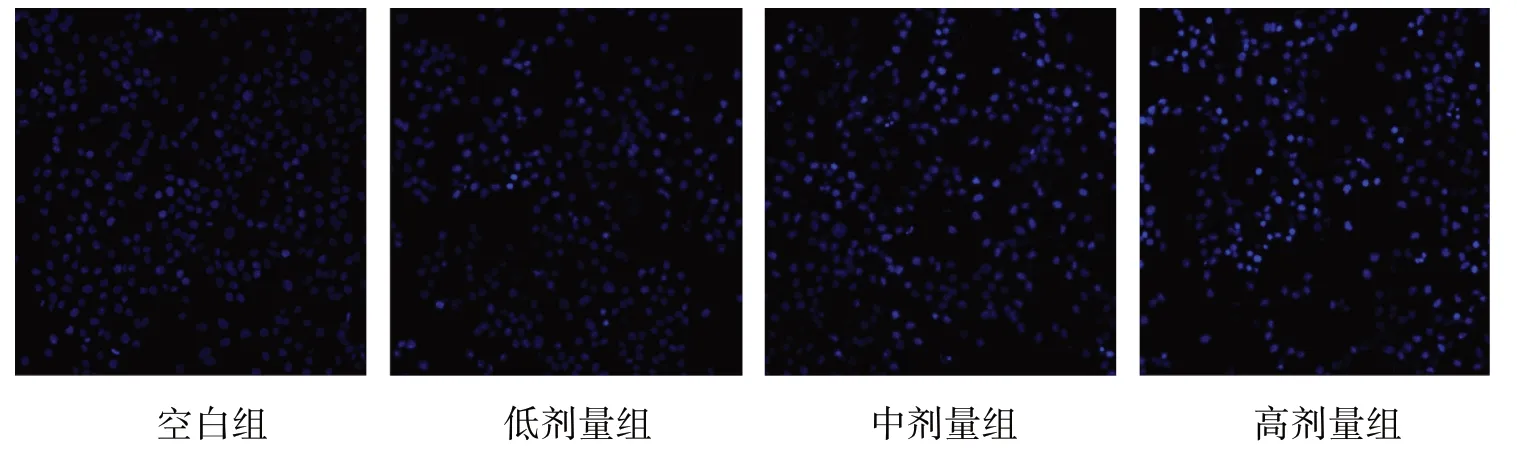
图2 DHA对SGC-7901细胞核形态的影响(200×,bar=50 μm)Fig.2 Effect of DHA on the nuclear morphology of SGC-7901(200×,bar=50 μm)
2.3 双氢青蒿素对SGC-7901细胞侵袭能力的影响
Transwell 侵袭实验结果显示,与空白组相比,各剂量组穿过基质胶的数量明显减少。相较于空白组88.6%的细胞侵袭率,低剂量组的细胞侵袭率为66.8%,中剂量为54.3%,高剂量仅为11.4%。可见给药浓度越高,SGC-7901细胞侵袭率越低。见图3、4。
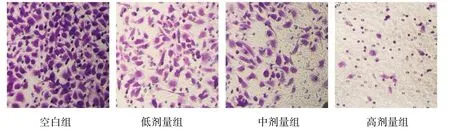
图3 双氢青蒿素对SGC-7901细胞侵袭能力的影响(400×)Fig.3 Effect of dihydroartemisinin on the invasion ability of SGC-7901 cells(400×)
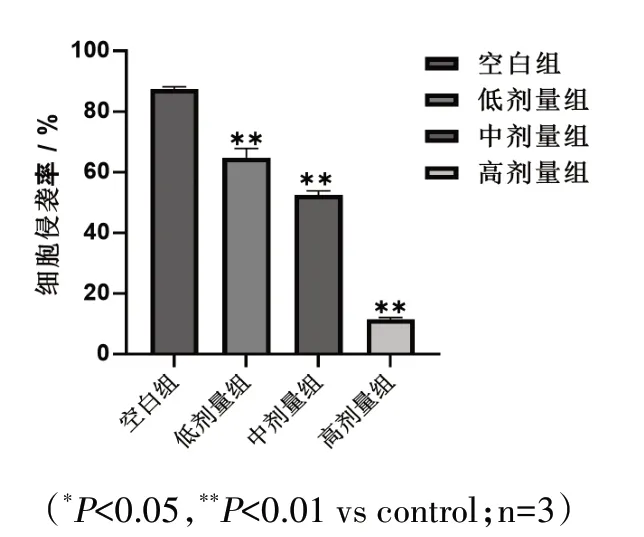
图4 双氢青蒿素对SGC-7901细胞侵袭能力的影响Fig.4 Effect of dihydroartemisinin on the invasion ability ofSGC-7901 cells
2.4 DHA 对SGC-7901 细胞Bcl-2、Bax 和cleaved caspase-3蛋白表达的影响
Western blot 法检测结果显示,与空白对照组相比,随着DHA 浓度的增加,Bax 和cleaved caspase-3蛋白表达明显增加,Bcl-2 和VEGF 蛋白表达显著降低(P<0.05),见图5。

图5 DHA对SGC-7901细胞Bcl-2、Bax、cleaved caspase-3和VEGF 蛋白表达的影响Fig.5 Effect of DHA on the expression of Bcl-2,Bax,cleaved caspase-3,and VEGF proteins in SGC-7901 cells
2.5 DHA对SGC-7901细胞凋亡的影响
使用流式细胞术对不同给药组进行检测,结果发现,不同给药组细胞均有不同程度的凋亡,且凋亡率与给药浓度成正比,即药物浓度越高,凋亡率越高。见图6。

图6 DHA对SGC-7901细胞凋亡的影响Fig.6 Effect of DHA on apoptosis of SGC-7901 cells
3 讨论
胃癌是全球最常见的恶性肿瘤之一[4]。国家癌症中心数据显示,我国胃癌病例约占所有癌症病例的9.8%,位居第3;死亡病例约占所有癌症死亡病例的12.0%,同样位居第3[5]。如未能早期发现和治疗,很难通过手术、化疗和放疗等方法治愈。肿瘤细胞的侵袭和转移是影响癌症治疗的最主要原因之一[6]。因此,抑制转移过程是胃癌治疗的新策略[7]。DHA是青蒿素在人体内的活性代谢产物之一[8],虽已有研究表明,DHA 可以诱导多种肿瘤细胞凋亡,但是DHA 能否诱导胃癌细胞凋亡,并通过抑制胃癌侵袭和转移发挥抗肿瘤作用尚不完全明确。本研究将不同剂量的DHA 作用于胃癌SGC-7901 细胞,观察其对SGC-7901 细胞凋亡和侵袭能力的影响。CCK-8检测结果显示,DHA 作用SGC-7901 细胞24 h 后,细胞生长受到明显抑制,且随着DHA浓度增加,抑制作用明显增强。采用Hoechst 染色法观察细胞核的形态改变,激光共聚焦显微镜扫描结果显示,给药组的SGC-7901 细胞出现明显的细胞核固缩和致密浓染的形态变化,且有细胞核形态改变的细胞数量,与给药浓度呈正比。应用Transwell 染色法观察SGC-7901 细胞侵袭能力的改变,通过拍摄图片和计数后发现,空白组穿透基质膜的细胞数量明显增多,即给药浓度越高,穿透基质膜的SGC-7901 细胞数量越少,可见DHA 对SGC-7901 细胞的侵袭能力有影响。为求证DHA 能够抑制抑制SGC-7901 细胞的侵袭能力,选择VEGF 蛋白进行Western blot 检测。VEGF 是通过血管上皮受体VEGFR 介导的受体信号通路,是HIF-1α 的上调能够诱导VEGF 基因表达和血管生成,进而促进肿瘤细胞的生长和转移,是肿瘤细胞能够转移和侵袭的基础[9]。所以,抑制VEGF 信号通路可以有效抑制肿瘤的发生和发展。本实验结果表明,DHA 能够抑制VEGF 的表达,且给药浓度越高,VEGF 蛋白的表达量越低,可见DHA 能够抑制SGC-7901细胞的侵袭能力。细胞中的促凋亡蛋白和抑凋亡蛋白间的相互平衡介导细胞凋亡[10],其中Bcl-2 和Bax 是研究较广泛的促凋亡蛋白和抑凋亡蛋白,二者通常在正常的细胞中以二聚体的形式存在,可有效调控细胞的凋亡,且二者的比值介导细胞进入凋亡阶段的进程[11]。Bcl-2 表达增加后可结合Bax 形成异源二聚体,通过抑制Bax的活性并抑制细胞凋亡;Bax表达增加时可结合Bax 形成同源二聚体,通过活化caspase-9 酶切caspase-3 酶原,且激活caspase-3 表达对该剪切有促进作用,进而启动caspase级联反应,最终诱导细胞发生凋亡[12]。Western blot 检测结果显示,与空白组相比,DHA 各浓度组Bax 和cleaved caspase-3 蛋白表达显著上升,Bcl-2 蛋白表达显著降低;流式细胞仪结果显示,各给药组SGC-7901 细胞凋亡数量较空白组明显增加,且随着给药浓度的上升,细胞的凋亡率也明显呈上升趋势。可见,DHA 对SGC-7901细胞有明显的促进凋亡的作用。
综上所述,DHA 能够抑制SGC-7901 细胞的增殖,诱导其凋亡,并能减弱SGC-7901 细胞的侵袭能力,表明DHA 对SGC-7901 细胞具有毒性效应,其机制可能与DHA 对Bcl-2、Bax、cleaved caspase-3 和VEGF 蛋白表达调控有关,但具体的作用途径与机制还有待进一步研究。
