内源性抗氧化剂金属硫蛋白对慢性间歇性乏氧引起的心肌损害的保护性作用及机制研究
2024-01-04王鹤儒夏彬凤郑庆霜崔明月
王鹤儒 尹 霞 夏彬凤 郑庆霜 崔明月
(1.浙江大学医学院附属第一医院心血管超声中心,浙江 杭州,310000;2.吉林大学白求恩第一医院心血管内科,吉林 长春,130000;3.吉林大学中日联谊医院老年病科,吉林 长春,130000)
阻塞性睡眠呼吸暂停(obstructive sleep apnea,OSA)是临床常见的睡眠呼吸紊乱性疾病,心脏是其最常累及的主要脏器之一,OSA 已被认为是减少心血管疾病的公共健康干预的靶点之一[1]。OSA 所致的反复氧去饱和事件即慢性间歇性乏氧(chronic intermittent hypoxia,CIH)是其主要致病因素,而氧化应激(oxidstive stress,OS)是CIH 所致心脏损伤的主要发病机制之一[2-3]。
金属硫蛋白(Metallothionein,MT)是一种在心脏中高表达的内源性抗氧化蛋白,其表达可由人体必需微量元素锌直接诱导[4]。除此之外,锌离子可在氧化应激条件下通过促使稳定状态的核因子E2 相关因子2(Nuclear factor erythroid 2-related factor,Nrf2)水平上升来上调MT 的表达[5-6]。研究表明MT 表达上调对CIH 所导致的心脏损伤发挥保护性作用,而其作用机制鲜有阐明[7-10]。综上,我们模拟CIH 环境建立心脏损伤模型,并对部分小鼠予以硫酸锌及SFN 干预,通过检测小鼠心脏结构及功能、心肌结构组织、相关蛋白因子的表达等指标,探究锌及SFN 是否具有抗CIH 引起的心肌损伤的作用,并初步探索其作用机制,为临床寻找更好的预防和治疗OSA 及其相关心血管疾病的药物提供科学依据。
1 材料与方法
1.1 实验材料
昆明小鼠,8 周龄,雄性,体质量20~25 g,购买于北京维通利华实验动物技术有限公司,萝卜硫素(B20805-20 mg,源叶生物,中国),硫酸锌(S22124-500 g,源叶生物,中国),Nrf2 抗体(12721T,CST,美国),MT 抗体(ab235036,abcam,美 国),Akt1 抗 体(2938T,CST,美 国),Akt2 抗 体(5239S,CST,美国),天狼猩红染液(Solarbio,中国), 氧流控制系统及氧循箱(A84XOV,BioSpherix,美国),电泳仪(DYY-7C,北京,北京六一),酶标仪(ELX-800,美国,BIOTEK),超声心动仪(Philips,SONOS 5500,中国)。本研究通过吉林大学白求恩第一医院医学伦理委员会批准。
1.2 实验方法
1.2.1 CIH 模型构建及SFN、硫酸锌治疗模型构建
选取体质量为20~25 g 的健康小鼠,随机分为对照组、CIH 组、0.9%氯化钠溶液组、CIH+硫酸锌治疗组、CIH+SFN治疗组,每组5 只。CIH 组缺氧模式如下:20.9%及8%氧浓度每120 秒交换一次,暴露2 h/d,连续8 周。对照组小鼠:放置在室内空气下相似的培养箱中。硫酸锌及SFN 治疗模型:在CIH 第二天分别给予硫酸锌(5 mg/kg)及SFN(0.5 mg/kg)腹腔注射,隔天注射,持续给药8 周。0.9%氯化钠溶液组:在CIH 第二天给予同等剂量的0.9%氯化钠溶液腹腔注射。
1.2.2 心脏功能评价
在实验结束后,将所有小鼠予以戊巴比妥钠腹腔注射(40 mg/kg)将其麻醉。采用Philips SONOS 5500 高效超声系统监测心脏功能。取仰卧位固定小鼠,利用30 MHz 高频探头采集胸骨旁长轴切面,记录M 型超声心动图像。
1.2.3 天狼猩红染色
在小鼠被处死后,将部分心脏固定于10%福尔马林中;经梯度酒精脱水、二甲苯透明及石蜡包埋后制作厚度为3 μm厚的石蜡切片,用天狼猩红饱和苦味酸水溶液进行染色。使用光学显微镜进行观察及拍照。
1.2.4 免疫组化
将制好的3 um 厚的石蜡切片进行脱蜡及水化,对抗原进行修复后用3%的氧化氢室温孵育25 min,滴加10%山羊血清覆盖组织,并置于室温封闭30 min,将稀释好的一抗滴入其中4℃过夜,复温后滴入稀释的二抗室温孵育50 min,复染(苏木素)后置入不同浓度的乙醇溶液中进行脱水,最后进行二甲苯透明及树胶封片。
1.2.5 免疫印记(Western-blot)
提取各组小鼠的新鲜心肌组织总蛋白。根据蛋白定量的结果加入适量上样缓冲液,稀释配平后制成蛋白质样品。取适量样品上样至SDS-PAGE 凝胶;使用恒压电泳使蛋白质进入分离胶后加大电压至120 V,预计目的蛋白分离后停止电泳;将SDS-PAGE 凝胶上蛋白质样品电转到硝酸纤维素膜;5%脱脂牛奶室温封闭1 h;分别使用抗MT、Nrf2、Akt1、Akt2和内参β-actin 抗体4℃孵育过夜,TBST 洗涤10 min,重复3次;二抗室温孵育1 h,TBST 洗涤10 min,重复3 次;滴加混好的ECL 发光液,室温孵育3 min 后弃去,使用保鲜膜将条带封存在暗夹后于暗室显影。应用图像处理分析软件(Image J)对各组小鼠心肌的MT、Nrf2、Akt1、Akt2 和β-actin 条带灰度值进行定量分析。
1.3 统计学分析
2 实验结果
2.1 硫酸锌及SFN 可改善CIH 导致的心脏结构及功能变化
超声心动图结果表明,在CIH 暴露8 周后,CIH+N.S 组与对照组相比,代表心脏结构的指标左心室内径(left ventricle cavitary dimensions,LVID)明显升高,代表心脏收缩功能的指标缩短分数(fractional shortening,FS)和射血分数(ejection fraction,EF)明显降低,上述指标均差异有统计学意义(P<0.05);硫酸锌及SFN 干预后,两组LVID 水平低于CIH+N.S 组,EF、FS 水平高于CIH+N.S 组,上述指标差异均有统计学意义(P<0.05),见图1。
2.2 CIH 导致小鼠心肌心肌纤维化
天狼猩红染色将心肌中的胶原成分染成红色,其余成分染成黄色。利用Image J 软件测量心肌胶原纤维阳性区占所观察视野的面积比,结果显示:对照组小鼠心肌组织内大血管、小血管周围及心肌质间可见少许胶原纤维沉积,CIH 组及CIH+N.S 组小鼠心肌组织内大小血管周围可见明显的胶原纤维沉积,SFN 及硫酸锌干预组小鼠心肌内胶原组织沉积较CIH+N.S 组有所减少,见图2。
2.3 硫酸锌、SFN 上调MT、Nrf2、AKT2 的表达
WB 及免疫组化的结果表明,与对照组相比,CIH+N.S 组小鼠心肌组织中MT、Nrf2 及Akt2 在心肌中表达下降,差异有统计学意义(P<0.05);与CIH+N.S 组相比,硫酸锌及SFN干预组小鼠心脏组织中MT、Nrf2 及Akt2 的表达明显上调,差异有统计学意义(P<0.05),见图3、图4、图5。
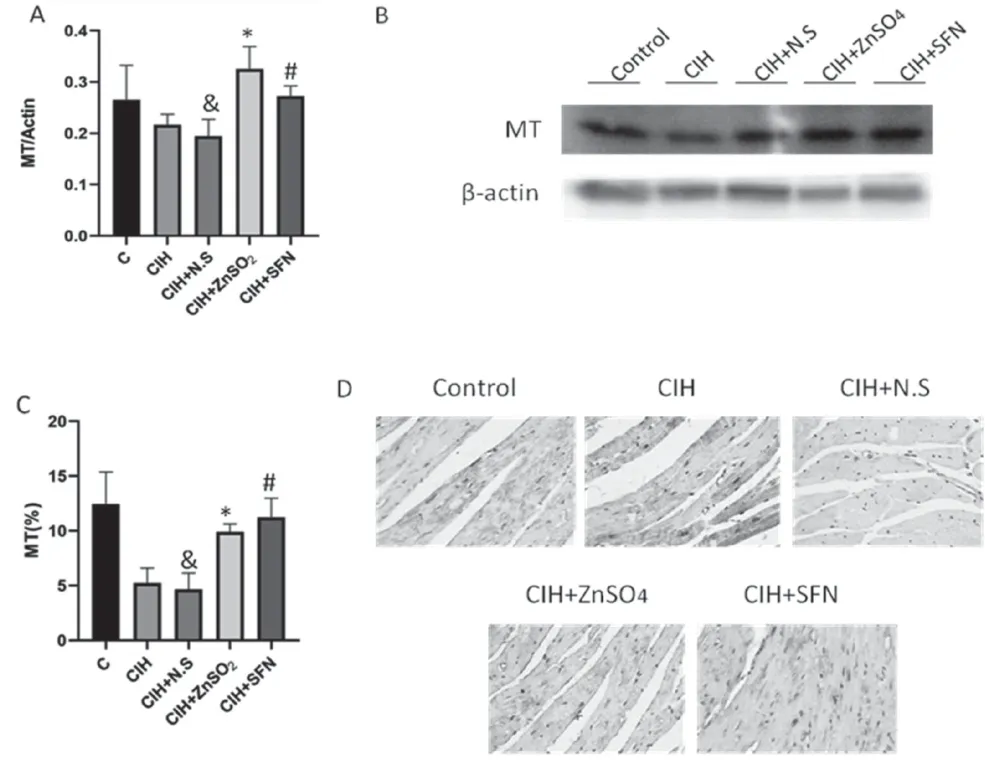
图3 硫酸锌及SFN 上调MT 表达
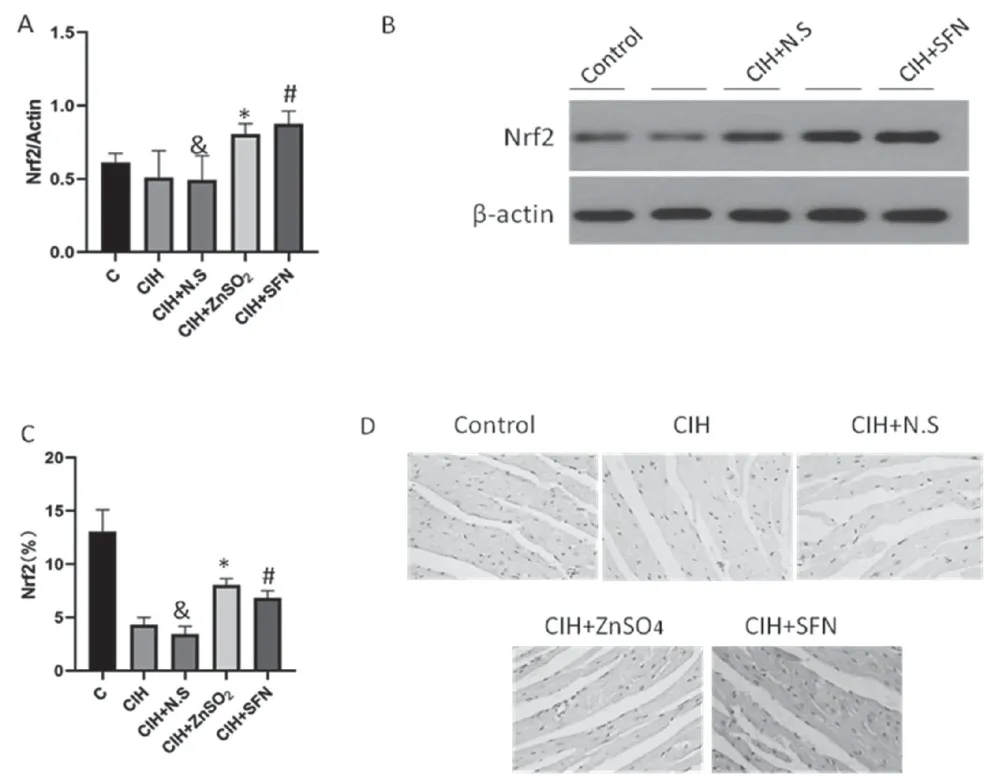
图4 硫酸锌及SF N 上Nrf2 表达

图5 硫酸锌及SFN 上Akt2 表达
3 讨论
OSA 是一种睡眠呼吸障碍性疾病,其导致的反复氧去饱和事件即CIH 可对机体多个系统造成损害,在众多并发症中由CIH 导致的心肌损伤是OSA 最为常见的并发症之一。CIH是一种长期、慢性、间歇性、夜间乏氧现象,心肌细胞在反复的缺氧/复氧环境中会产生大量的活性氧(reactive oxygen species,ROS)及 活 性氮(reactive nitrogen species,RNS),当超过机体的清除能力或机体的抗氧化能力下降不能将过量的ROS/RNS 清除时则会引起氧化和抗氧化失衡,由此导致氧化应激。未被清除的ROS/RNS 可导致心肌中脂质、DNA和蛋白质的损伤以及酶的失活,这将引起心肌细胞迅速的凋亡及坏死,最终导致心肌肥厚及心肌重塑。因此氧化应激(oxidstive stress,OS)是CIH 所致心脏损伤的主要发病机制之一。然而迄今为止,CIH 导致的心肌损伤的发病机制并未完全阐明,治疗方法亦较少,因此明确其发病机制及新的药物和治疗方法具有十分重要的意义。
MT 是一种低分子量、内源性抗氧化蛋白,在人体内普遍存在,而在心脏相对高表达。MT 不仅可以直接清除自由基,还可以通过多条细胞信号转导通路抑制氧化应激。大量研究表明,MT 可抵御多种病理状态及物理因素如糖尿病、肥胖、缺血再灌注、脓毒血症、吸烟、低温等导致的心脏损伤,是一种强大而有效的内源性心脏保护蛋白[11-12]。然而尚无证据表明在CIH 条件下补锌是否可诱导MT 表达并有效预防CIH 导致的心脏损伤。本研究发现补锌能显著改善CIH 所导致的心脏结构改变及心功能低下,减少胶原纤维在心肌中沉积,明显减轻了心肌纤维化程度。而在8 周时,与对照组相比,CIH组及CIH+N.S 组MT 的表达出现明显下降,而在硫酸锌与SFN 干预后MT 的表达明显升高,因此我们认为,锌及SFN对CIH 导致的心脏损伤发挥保护性作用可能依赖于上调MT表达实现。
研究表明MT 可由多种物质通过多条途径诱导表达[4]。其中人体必需微量元素锌被认为是内源性MT 的诱导剂之一,可有效诱导其在体内的表达[13]。首先,MT 由锌直接诱导表达的经典方式为锌离子经ZIP 转运进入细胞后激活金属反应元件转录因子1(metal regulatory transcription factor 1,MTF-1),随后MTF-1 易位进入细胞核,与MT 基因的启动子区域结合,上调MT 基因转录使其表达增加[14-15]。除此之外,锌离子可作为第二信使,将细胞的内源性“危险信号”传递给Nrf2 负调控因子Kelch 样环氧氯丙烷相关蛋白(Kelch-1ike ECH- associated protein l,Keap1),而锌离子与Keap1 接触后会导致其构象改变,从而抑制Nrf2 的泛素化,细胞内Nrf2 水平上调使稳定状态的Nrf2 水平上升进而上调MT 等一系列抗氧化蛋白的表达[5-6]。因此,本研究在检测MT 蛋白水平的基础上还进一步检测了各组小鼠心肌组织中Nrf2 的表达情况。结果表明,硫酸锌及SFN 干预组Nrf2 水平亦上调。首先对于SFN 来说,其作为Nrf2 的激活剂可直接使稳定状态的Nrf2 水平上调,从而增加其下游抗氧化蛋白MT 的表达;而对于锌来说,结合实验结果我们认为其有可能通过直接及间接两种方式影响MT 的表达。
另有实验证明MT 减轻CIH 所致心肌细胞凋亡、炎性反应、心脏结构改变及心功能下降等是通过激活Akt 信号通路实现[16];而MT 可通过PI3K/Akt 通路与Nrf2 协同对CIH 导致的心脏损伤发挥保护性作用[9-10]。因此我们认为MT 的心脏保护作用的发挥与Akt 信号通路密切相关,然而Akt 有三种亚型,每个亚型对于心脏的作用不尽相同。CIH 条件下到底是哪一类型的Akt 发挥主要作用尚不明确,因为Akt1 和Akt2 均在心脏中具有相对高表达,Akt3 仅在心脏中的低水平表达,且其主要功能与大脑的生长及功能密切相关,于是我们检测了小鼠心肌中的总Akt1 和Akt2 的蛋白水平[17]。实验结果表明,在SFN 及硫酸锌治疗组中Akt2 的表达均明显上调。由此可见,Akt2 可能在MT 减轻CIH 导致的心脏损伤的过程中发挥了主要作用。
综上所述,本研究发现MT 在CIH 导致的心肌损伤中发挥了保护性作用,补锌可能会直接及间接地诱导MT 的表达,SFN 作为Nrf2 的激活剂可能间接上调MT 的表达,而Akt 信号通路可能参与了MT 的保护性作用。本研究为CIH 导致的心肌损伤的发病机制提供了理论依据,为OSA 导致的心脏相关并发症的临床治疗提供了一种潜在的候选药物。
