来曲唑对幼年动物的发育毒性及机制研究进展
2024-01-04付莉莉魏丽萍刘楚乔陶巧玉张鹏邱云良
付莉莉,魏丽萍,刘楚乔,陶巧玉,张鹏,邱云良
(1.安徽中医药大学药学院,安徽 合肥 230012;2.益诺思生物技术南通有限公司,江苏 南通 226000;3.南通市海门长三角药物高等研究院,江苏 南通 226133;4.上海益诺思生物技术股份有限公司,上海 201203;5.江西中医药大学药学院,江西 南昌 330000)
芳香化酶抑制剂(aromatase inhibitors,AI)被批准仅用于缓解或辅助治疗绝经后女性雌激素受体阳性乳腺癌[1]。芳香化酶是一种细胞色素P450酶,是雌激素生物合成的限速酶,在性腺、骨、脂肪基质细胞和中枢神经系统等广泛表达,可催化雄烯二酮和睾酮(testosterone,T)分别生成雌酮和雌二醇(estradiol,E2)[2]。AI 药物共有3 代,前两代甾体类AI(第一代的睾内脂、氨鲁米特,第二代的福美可坦)因不良反应较多而很少使用;第三代非甾体AI如来曲唑(letrozole)、阿那曲唑(anastrozole)是目前常用的高效、可逆、安全的药物。由于来曲唑抑制芳香化酶活性,降低雌激素水平,从而延缓骨龄进展、增加生长年限、改善成年身高,自20世纪80年代以来,已被辅助用于儿童和青少年的其他疾病的治疗,如儿童矮小症、体质性青春期生长发育延迟及性早熟等[3-7]。但临床发现,来曲唑在儿童中的使用存在不良反应风险。王春林等[8]发现,来曲唑主要药物不良反应风险有肝、肾功能障碍,脂质代谢紊乱,高雄激素血症,生殖系统和骨代谢紊乱等,但是关于其对男性生殖系统损害和骨代谢的长期影响目前还不清楚。由于来曲唑对儿童临床及非临床发育毒性的研究结果存在争议,且目前关于来曲唑对生殖系统、认知功能和骨代谢毒性机制尚不清楚,本文拟综述来曲唑对幼年动物的发育毒性及其可能机制,为其在临床儿科更安全有效的使用提供依据。
1 对幼年动物的发育毒性
来曲唑可抑制芳香化酶活性,降低E2水平,E2的降低可引起睾丸形态异常、生精小管及间质组织的改变,还会降低骨密度,对骨代谢的平衡造成影响;此外,还会造成认知功能损伤和神经细胞凋亡。从而可对幼年动物的生殖系统、骨代谢和认知功能产生影响。
1.1 生殖系统
来曲唑特异性抑制芳香化酶,造成性激素及促性腺激素异常,从而干扰下丘脑-垂体-性腺轴的调节。Pilutin 等[9]研究表明,来曲唑影响雄性和雌性大鼠的生育能力,剂量低至每天3 μg·kg-1就可使幼鼠出现垂体肥大及睾丸异常。陈力力等[10]研究表明,来曲唑影响幼猪睾丸生精小管细胞的生长发育。Pouliot等[11]研究报道,来曲唑对幼年雄性大鼠睾丸和精子活力有影响,对雌性大鼠的子宫和阴道发育也有影响。
1.2 骨代谢
来曲唑可通过调节幼年动物的骨代谢和骨转化对骨密度产生影响。有研究发现,来曲唑可显著升高幼年大鼠骨中NF-κB 受体活化因子配体(receptor activator of NF-κB ligand,RANKL)的水平[12-13]。Mohamed 等[14]研究显示,来曲唑可显著降低幼年大鼠E2水平、Ⅰ型原胶原N 端前肽(propeptide of typeⅠprocollagen,PINP)水平和股骨骨密度,增加T水平。Kalam等[15]研究发现,来曲唑会降低幼年小鼠碱性磷酸酶水平,增加抗酒石酸酸性磷酸酶水平。表明成骨细胞中RANKL 的增加和PINP 的降低,以及破骨细胞抗酒石酸酸性磷酸酶的增加,可能是由于来曲唑抑制芳香化酶活性而造成性类固醇激素异常。虽然来曲唑对幼年动物骨代谢存在一定不良反应,但其对儿童骨骼健康的影响尚不清楚,需进一步研究。
1.3 认知功能
芳香化酶在大脑额叶和颞叶高度表达,这些区域通常与学习、记忆、感觉处理(颞叶)和多巴胺能活动(额叶)有关[16]。芳香化酶编码基因CYP19A1是人类阅读、言语和语言等认知功能的候选调控基因,调控大脑和认知功能。有研究表明,颞叶神经元能通过雄激素前体的芳构化在局部合成雌激素[17],而雌激素受体β 在人脑的海马区大量表达,这一区域被认为是记忆功能的重要区域。由此可见,来曲唑可抑制芳香化酶,导致E2水平降低,从而影响E2对认知功能的调节作用。
来曲唑对幼年动物认知功能影响的研究比较匮乏,从药理作用及成年动物的研究可推测其对幼年动物认知功能具有影响。Gervais 等[18]发现,经来曲唑治疗的狨猴血液循环中E2减少,而海马内E2增加,海马神经元的空间工作记忆和内源性兴奋性降低。Marbouti 等[19]研究发现,来曲唑能显著降低雌、雄大鼠海马E2水平,导致大鼠认知功能下降。然而Pouliot 等[11]等研究未发现来曲唑对幼年大鼠神经行为功能有不良影响。鉴于来曲唑可通过血脑屏障,理论上来曲唑治疗可能导致认知功能障碍,该问题有必要进行深入研究。
1.4 其他
来曲唑主要通过肝代谢,可加快肝酶对高密度脂蛋白胆固醇的代谢,导致高密度脂蛋白胆固醇降低,有增加心血管疾病的风险[20]。临床试验表明,来曲唑治疗对血清胰岛素、空腹血糖、三酰甘油无不良影响[21-23]。然而,雌性大鼠在青春期前连续90 d 给予高剂量来曲唑治疗后,出现胰岛素敏感性降低和脂肪细胞增大[24]。
2 对幼年动物发育毒性的机制
来曲唑对幼年动物发育毒性的机制可能与其药理作用有关。E2降低会影响睾丸细胞的发育成熟、体内性激素及促性腺激素的表达以及睾丸组织中雌激素受体的表达及分布,同时还会增加RANKL 诱导破骨细胞的增殖、分化及成骨细胞的凋亡、氧化应激、NF-κB 活性;此外,还会干扰E2调节海马经典及非经典效应,降低星形胶质细胞对谷氨酸(glutamic acid,Glu)的吸收,减少L 型钙通道阻滞胱天蛋白酶3活化等。
2.1 对雄性动物生殖毒性机制
2.1.1 影响睾丸细胞发育成熟
睾丸生殖细胞、间质细胞及支持细胞都含有芳香化酶[25]。雄性哺乳动物的E2是由芳香化酶催化睾丸组织中的T 产生的,抑制雄性哺乳动物芳香化酶活性会对雄性哺乳动物生殖系统的发育和功能产生不利影响[26]。研究表明,来曲唑可引起内源性雌激素减少,进而导致动物交配次数减少,抑制雄性动物睾丸内精子的发生[27]。有研究发现,芳香化酶功能基因缺失的雄性小鼠内源性雌激素减少的同时,睾丸内精子发生受到破坏[28]。还有研究显示,来曲唑影响雄性冠毛猕猴和成年大鼠附睾内梭形精子的成熟[29]。这些研究结果表明,来曲唑对雄性动物睾丸精子的发生及生殖细胞的分化、成熟有重要影响,但其如何影响睾丸支持细胞的生长发育未见报道。来曲唑对雄性动物睾丸支持细胞和生殖细胞生长发育的作用机制需深入研究。
2.1.2 影响体内性激素及促性腺激素的表达
雄激素可刺激雄性生殖器官发育与成熟,维持生精作用;雌激素可促进性未成熟大鼠睾丸生殖细胞增殖、分化和成熟,还参与精子的发生和精母细胞的成熟。当芳香化酶活性受到抑制时,性未成熟大鼠雌激素减少,生精功能受损。
研究发现,芳香化酶功能受损的雄性小鼠体内雌激素含量显著降低,睾丸生殖细胞增殖受到抑制,附睾组织中梭形精子细胞异常,成熟精子细胞凋亡加速[30]。Berger 等[31]发现,1 周龄幼年雄猪投喂来曲唑6周后,体内E2含量显著降低,而T含量显著升高。陈钊等[32]研究发现,来曲唑能促进雄性幼猪睾丸支持细胞增殖,减少生精细胞数量,且幼猪体内E2和黄体生成素水平下降,而卵泡刺激素和T水平显著升高。推测可能是来曲唑抑制芳香化酶活性,导致体内E2含量降低,T 含量升高,从而干扰了下丘脑-垂体-性腺轴对精子发生的调节,负反馈促进促卵泡激素分泌,抑制促黄体生成素分泌。
2.1.3 影响睾丸组织中雌激素受体表达及分布
雌激素也存在于男性体内,其内源性主要来源是睾丸。睾丸中的芳香化酶催化T转化为E2。E2信号转导需要与其特异性受体相互作用,以调节精子的发生和精子的成熟[33]。陈钊等[34]发现,来曲唑能降低猪体内E2含量,导致ERα 和ERβ 表达降低,进而导致“雌激素-雌激素受体复合体”表达降低,导致猪睾丸生殖细胞减少。可见,来曲唑使芳香化酶失活,从而干扰睾丸组织中雌激素信号的表达。
2.2 骨毒性机制
性类固醇激素主要包括雌激素、雄激素和孕激素。雌激素和雄激素来源于胆固醇,它们在骨骼代谢中发挥重要作用。研究显示,雌激素与骨的生成和代谢密切相关[35]。细胞水平研究表明,破骨细胞和成骨细胞表面均存在ER,雌激素可抑制破骨细胞的分化、成熟和骨吸收作用;同时,雌激素也可通过抑制成骨细胞凋亡延长成骨细胞寿命[36],使得骨吸收和骨形成处于平衡状态。
雌激素主要通过骨保护素(osteoprotegerin,OPG)/RANKL/RANK 信号通路,以及调节成骨细胞或骨髓单核细胞的白细胞介素1(interleukin-1,IL-1)、IL-6、肿瘤坏死因子α(tumor necrosis factorα,TNF-α)、巨噬细胞集落刺激因子和前列腺素的产生,抑制破骨细胞的增殖、分化及其活性[37-38]。
雌激素主要通过抑制细胞凋亡、抑制氧化应激和降低NF-κB 活性,直接影响成骨细胞的骨形成。在细胞水平上,雌激素通过激活非受体型蛋白酪氨酸激酶/编码SH 结构域的基因的蛋白产物/细胞外信号调节激酶(extracellular signal regulating kinase,ERK)信号通路,诱导转录因子ETL 样蛋白1、CCAAT/增强因子结合蛋白β 氧化磷酸化[39]和下调c-Jun N 端激酶介导的c-Jun/激活剂蛋白1 活性,导致关键转录因子活性的改变[40],进而抑制成骨细胞凋亡,增加成骨细胞活性。研究表明,E2通过ERβ/糖原合成酶激酶-3β 依赖的Wnt/β-联蛋白信号通路诱导增殖和分化相关基因表达,抑制氧化应激反应,从而促进成骨细胞的增殖和分化[41]。Chang 等[42]研究显示,雌激素与ER 结合能够抑制NF-κB 信号通路,导致NF-κB 活性降低。NF-κB 的抑制导致fos 相关抗原1(fos-related antigen-1,Frα-1)表达增加,而Frα-1 是体内外参与骨基质形成的重要转录因子。
来曲唑可通过抑制芳香化酶活性间接降低雌激素,从而影响OPG/RANKL/RANK 信号通路及骨骼系统和免疫系统分泌的细胞因子、趋化因子及转录因子的表达,导致破骨细胞骨吸收增加;同时,雌激素的降低也会增加成骨细胞的细胞凋亡、氧化应激和NF-κB 活性,进而降低成骨细胞的活性,减少骨形成。因此推测,来曲唑对骨代谢影响的作用机制为间接降低雌激素、增加破骨细胞的骨吸收和导致成骨细胞骨形成不足。
2.3 认知功能毒性机制
芳香化酶在啮齿类动物大脑不同区域高表达,并将T 转化为E2,E2在下丘脑、杏仁核、海马体和大脑皮质的浓度很高。E2对整个生命周期的大脑发育和功能有一系列不同影响,包括促进各种认知能力的发展和维持[43]。来曲唑通过血脑屏障分布到大脑并影响局部E2合成[44],可能对认知功能产生有害作用。
雌激素对海马发育的作用主要为激素-激素受体复合物与DNA 结合的类型(经典效应)和不结合的类型(非经典效应)[45]。经典效应是通过E2-ER复合物与DNA 上的雌激素反应元件(estrogen response element,ERE)的结合来介导,导致基因转录和蛋白质合成(图1)。雌激素对细胞功能的非经典效应是独立于细胞核中ERE 发生的(图1),可以由细胞膜处或细胞膜附近的细胞内ER 或由细胞膜结合的ER 介导。在ERK 下游,哺乳动物雷帕霉素靶蛋白(mammalian target of rapamycin,mTOR)介导的蛋白合成也对E2的记忆增强作用及E2对CA1 树突棘密度的促进作用至关重要。ERK 也通过H3 乙酰化和环磷腺苷效应元件结合蛋白(cAMP-response element binding protein,CREB)磷酸化参与E2对基因转录的影响。Wnt/β-联蛋白信号可能也在E2的记忆增强效应中发挥作用,但涉及的机制尚不清楚。Lu等[46]报道,神经元衍生的E2在调节小鼠前脑中的快速蛋白激酶B-ERK 和CREB-脑源性神经营养因子信号转导中具有关键作用,即E2有助于海马的神经可塑性、神经发育和认知信号通路。此外,雌激素通过丝裂原活化蛋白激酶通路对神经有保护作用;还可通过作用于L 型钙通道阻滞胱天蛋白酶3 活化等,阻碍Glu 介导的细胞死亡[47]。Glu也被认为是一个重要的调控凋亡的因素,雌激素可介导Glu表达,增加星形胶质细胞对Glu 的吸收,减少内环境中Glu 含量,抑制Glu 介导的神经细胞死亡[48]。来曲唑会造成E2降低,从而干扰神经元的增殖和分化。推测来曲唑可能通过影响E2对中枢神经系统的调节作用,从而产生认知功能毒性。

图1 雌激素对啮齿类动物记忆巩固作用的经典和非经典机制.E2:雌二醇;ER:雌激素受体;Glu:谷氨酸;ERK:细胞外信号调节激酶;mTOR:哺乳动物雷帕霉素靶点;CREB:环磷腺苷效应元件结合蛋白;ERE:雌激素反应元件.
3 结语
来曲唑对幼年动物的发育毒性主要体现在对生殖系统、骨发育以及认知功能的影响,其导致幼年动物睾丸E2降低、睾丸形态异常、生精小管及间质组织发生改变;通过抑制芳香化酶导致E2缺乏,降低骨密度并影响骨代谢;降低海马区E2水平导致神经细胞凋亡以及认知功能障碍(图2)。来曲唑对幼年动物毒性机制可能是由于其药理作用引起的。对于生殖系统毒性机制可能与睾丸细胞的发育成熟、体内性激素及促性腺激素表达以及睾丸组织中雌激素受体分布及表达有关。骨代谢毒性机制可能与影响雌激素对破骨细胞骨吸收和成骨细胞骨形成有关;雌激素的降低会增加RANKL 诱导破骨细胞的增殖和分化,增加骨吸收,同时也会增加成骨细胞的凋亡、氧化应激和NF-κB 活性,从而减少骨形成。认知功能毒性机制可能是由于E2的降低以及芳香化酶的缺乏,从而影响E2对中枢神经系统的调节作用,如干扰E2调节海马经典及非经典效应、降低星形胶质细胞对Glu 的吸收、减少L 型钙通道阻滞半胱天冬酶3活化等。
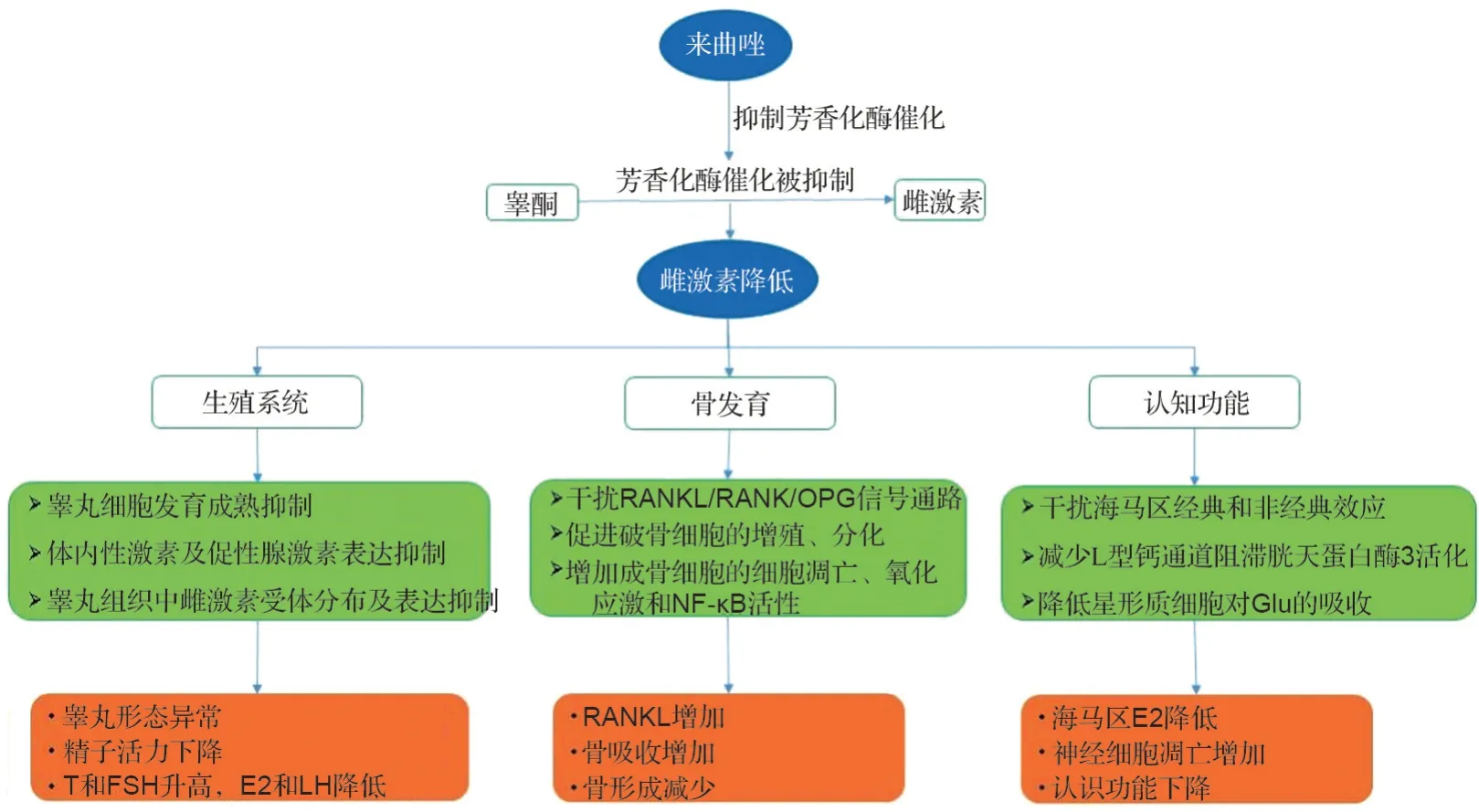
图2 来曲唑对幼年动物的发育毒性及其可能机制.T:睾酮;FSH:促卵泡激素;E2:雌二醇;LH:黄体生成素;OPG:骨保护素;RANKL:NF-κB受体活化因子配体;RANK:NF-κB受体活化因子;Glu:谷氨酸.
目前关于来曲唑对于儿童毒性影响的非临床及临床研究数据比较匮乏,且存在争议,可靠性差。由于成熟体系和不成熟体系之间的内在差异,对儿童的毒性可能不会在成人中观察到,来自幼年动物的数据在评估药物对儿童的潜在毒性方面具有很大价值[49-50]。所以仍需通过幼年动物实验来考察曲唑对幼年动物产生的生殖毒性、骨代谢毒性、认知功能毒性及其可能的毒性作用机制,为临床儿科更安全、有效地使用来曲唑提供依据。
