芩香清解口服液对4日龄大鼠的发育毒性
2024-01-04郭健敏张文强邓应华蒙飞彪谢松强梁纯杨威
郭健敏*,张文强*,邓应华,蒙飞彪,谢松强,梁纯,杨威
(1.广州湾区生物医药研究院,广东莱恩医药研究院有限公司,广东省药物非临床评价研究企业重点实验室,国家中药现代化工程技术研究中心中药非临床评价分中心,广东省创新药物评价与研究工程技术研究中心,广东 广州 510990;2.河南大学药学院,河南 开封 475000;3.香港科技大学生命科学部,香港 999077)
芩香清解口服液(Qinxiang Qingjie oral solution,QXQJ)为已上市的中成药,来源于蒙药,主要由黄芩、广藿香、蝉蜕、大黄、生石膏和葛根等12 味中药制成,具有疏散风热、清泻里热、解毒利咽的功效,临床上用于小儿急性上呼吸道感染表里俱热证。应用儿科人群主要划分为3 个阶段:第1 阶段:6 月龄~3 岁,一次5 mL;第2 阶段:3~7 岁,一次10 mL;第3 阶段:7~14 岁,一次15 mL。前期药效学研究结果显示,QXQJ 具有明显的止痛、解热、镇咳、祛痰、消炎和抗菌等作用,针对EV71 病毒引起的幼龄小鼠肌肉肌纤维损伤及炎症细胞浸润亦具有明显的治疗效果[1]。急性呼吸道感染是儿科最为常见的疾病,好发于≤5岁儿童。因此,本研究选择出生后4~21日龄(postnatal day 4~21,PND4~PND21)(相当于≤2岁婴幼儿时期)幼龄大鼠进行给药,恢复期选择PND22~PND42(相当于2~12 岁儿童时期)[2-3],系统考察重复给予PND4大鼠QXQJ 18 d后的发育毒性,并根据产生的毒性反应及其严重程度,判断是否有与QXQJ 相关的特有毒性或与年龄有关的敏感性差异,为临床上6 月龄~2 岁儿科人群应用QXQJ提供参考。
1 材料与方法
1.1 动物、药物、试剂和主要仪器
选用由孕15 日龄健康孕大鼠自然分娩的仔大鼠128 只,雌雄各半,体重7~11 g,孕大鼠购自湖南斯莱克景达实验动物有限公司,生产许可证号:SCXK(湘)2019-0004。大鼠饲养于广东莱恩医药研究院SPF 级动物房,自由摄食、饮水,动物房环境温度、日温差、湿度等均符合要求。本研究实施经广东莱恩医药研究院动物福利与伦理委员会审核并批准(编号:IA-SE2019037-01)。
QXQJ(广州一品红制药有限公司生产,批准文号:国药准字Z20168003,批号:SY10719001)。血液学和凝血功能检测试剂(上海长岛生物科技有限公司);血液生化检测试剂(浙江伊利康生物技术有限公司);免疫球蛋白G(immunoglobulin G,IgG)、IgA、IgE、IgM、生长激素(growth hormone,GH)、生长激素释放肽(growth hormone releasing peptide,GHRP)ELISA 检测试剂盒(美国R&D Systems)。InAlyzer 型双能X 射线动物身体成分分析系统(韩国Medikors Inc);7180 型全自动生化分析仪(日本日立公司);C3510 型全自动凝血分析仪(北京普利生仪器有限公司);ELx808 型酶标分析仪(美国BioTek);DM3000 型生物显微镜(德国LEICA)。
1.2 动物分组和给药
于PND2选择每窝活仔数≥10只的整窝仔大鼠,将每窝仔大鼠调整为雌雄各4 只,采用交叉抚育法进行分组[4-5],随机重新将所有幼仔组窝抚养,将来源于不同窝的幼仔组成新窝(新窝中不含原窝幼仔),重组好的新窝整窝被分配到一个组别。实验共分成4 组,即溶剂对照组及QXQJ 3.45,10.35 和28.05 g·kg-1组,每组4 窝,每窝8 只,雌雄各半,共计16窝128只。
考虑到药物在体内的吸收、分布、代谢等情况,在进行人用剂量外推时需重点关注物种和年龄差异[6]。本研究在体表面积等效剂量折算法基础上,以相应年龄幼龄大鼠与成年大鼠体表面积的比值作为系数加乘,设QXQJ 给药剂量(以生药计)分别为3.45,10.35 和28.05 g·kg-1,约相当于1 岁儿童临床拟用量(每天15 g生药量)的1,3和8倍。各组仔大鼠于PND4开始ig给药,给药容积为5 mL·kg-1,每天1 次,连续18 d(PND4~PND21)。溶剂对照组给予等体积纯水。
1.3 检测指标
实验期间每天观察1次大鼠的一般状况,每3 d称量1 次仔大鼠体重,并在此期间对仔大鼠的生长发育、神经反射、自发行为和体格进行系统检查。仔大鼠离乳后,每周测定1 次摄食量;于PND22对各组16只活体仔大鼠(雌雄各半)全身骨骼进行检查,于PND42对各组其余16 只股骨骨骼进行检查。于PND22和PND42将检查后的仔大鼠处死,用于血液学及凝血、血液生化学、免疫及生长激素和组织病理学检查,具体毒性检测指标见表1。

Tab.1 Toxicity detection indexes of juvenile rats after ig administration of Qinxiang Qingjie oral solution (QXQJ)
1.4 统计学分析
2 结果
2.1 一般状况
给药期和恢复期,正常对照和QXQJ 3.45 g·kg-1组幼龄大鼠一般状况均未见异常。QXQJ 10.35 g·kg-1组于给药期PND5~PND16有19 只幼龄大鼠出现黄棕色软便或稀便,PND17全部恢复;于PND14~PND18发现5只腹部膨大,PND19全部恢复。QXQJ 28.05 g·kg-1组幼龄大鼠于PND6~PND21有32 只出现黄棕色软便或稀便,于PND8~PND21有32 只腹部膨大,停药起(PND22)全部恢复。
2.2 体重
QXQJ 28.05 g ·kg-1组雌雄幼龄大鼠于PND7~PND27体重均显著低于溶剂对照组(P<0.05),于PND33起雌雄幼龄大鼠体重与溶剂对照组比均未见明显差异,表明QXQJ 28.05 g·kg-1重复给药可使幼龄大鼠体重在给药期明显偏低,停药恢复1周后基本恢复正常(图1)。
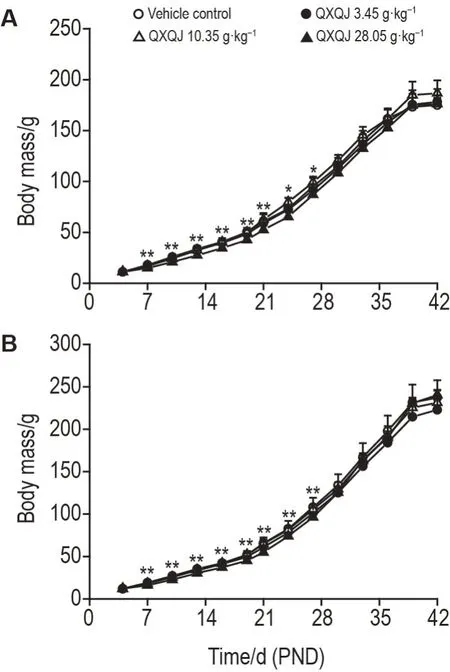
Fig.1 Effect of QXQJ on body mass of juvenile rats.The juvenile SD rats(n=32,half male and half female)in each group were ig given pure water,QXQJ 3.45,10.35 and 28.05 g·kg-1,respectively,once a day,after postnatal day 4(PND4)for 18 d.Then,the remaining rats(n=16,half male and half female)in each group had their observation resumed for 3 weeks.A:female;B:male.±s,n=16 in period PND4-PND21,n=8 in period PND24-PND42.*P<0.05,**P<0.01,compared with vehicle control group.
2.3 摄食量
停药后测定各组幼龄大鼠摄食量。结果表明,与溶剂对照组相比,QXQJ 28.05 g·kg-1组PND40雌性幼龄大鼠摄食量显著降低(P<0.05),但变化幅度<20%,且对体重未见影响,认为此现象的临床指导意义较小。其余时间点各组雌雄幼龄大鼠摄食量均未见明显变化(图2)。

Fig.2 Effect of QXQJ on food intake of juvenile rats.See Fig.1 for the rat treatment.A:female;B:male.±s,n=8.*P<0.05,compared with vechicle control group.
2.4 生长发育、神经反射和自发行为
QXQJ 3.45,10.35 和28.05 g·kg-1组幼龄大鼠生长发育、神经反射和自发行为检查指标均已达同时期标准,达标大鼠数量与溶剂对照组相比无统计学差异(表2)。

Tab.2 Effect of QXQJ on growth development,neural reflex and spontaneous behavior of juvenile rats
2.5 体格
与溶剂对照组相比,QXQJ 28.05 g·kg-1组雌雄幼龄大鼠于PND7~PND21顶臀长、尾长和四肢总长均显著降低(P<0.05);PND7~PND28胸围亦明显降低(P<0.05),表明QXQJ 28.05 g·kg-1重复给药可致幼龄大鼠体格在给药期明显偏低,停药恢复1周后基本恢复正常(图3)。

Fig.3 Effect of QXQJ on physical development of juvenile rats.See Fig.1 for the rat treatment.A:top hip length;B:tail length;C:total length of limbs;D:chest circumference;1:female;2:male.±s,n=16 in period PND4-PND21,n=8 in period PND24-PND42.*P<0.05,**P<0.01,compared with vehicle control group.
2.6 骨骼
与溶剂对照组相比,QXQJ 28.05 g·kg-1组PND22雌雄幼龄大鼠全身骨骼骨比重(bone mineralspecific gravity,BMG)和骨密度(bone mineral density,BMD)均显著低于溶剂对照组(P<0.05),QXQJ 3.45,10.35 和28.05 g·kg-1组PND22和PND42雌雄幼龄大鼠全身及股骨骨骼BMG 和BMD 均未见明显差异,提示QXQJ 28.05 g·kg-1重复给药可导致幼龄大鼠骨骼发育减缓,恢复期结束时已全部恢复正常(图4)。

Fig.4 Effect of QXQJ on skeletal development of juvenile rats.See Fig.1 for the rat treatment.A:BMG;B:BMD;1:female;2:male.±s,n=8.*P<0.05,**P<0.01,compared with vehicle control group.
2.7 血液学和凝血
结果(表3)显示,与溶剂对照组相比,QXQJ 28.05 g·kg-1组PND22雌雄幼龄大鼠红细胞(red blood cells,RBC)数和平均红细胞血红蛋白(mean corpuscular hemoglobin,MCH)水平均显著降低(P<0.05);QXQJ 10.35 g·kg-1组PND22雌性幼龄大鼠网织红细胞(reticulocytes,RET)数显著升高(P<0.05);各剂量组凝血指标均未见明显差异。提示QXQJ 28.05 g·kg-1组雌雄幼龄大鼠RBC 和MCH虽降低,但变化幅度较小,未见剂量-毒性关系。考虑到同时期该幼龄大鼠体重小于溶剂对照组,认为幼龄大鼠消化系统功能尚未发育完善导致其体重减轻和生理性贫血。

Tab.3 Effect of QXQJ on hematology and coagulation of juvenile rats
2.8 血液生化
与溶剂对照组相比,QXQJ 3.45,10.35 或28.05 g·kg-1组PND22或PND42幼龄大鼠谷丙转氨酶(glutamic pyruvic transaminase,GPT)、谷草转氨酶(glutamic oxaloacetic transaminase,GOT)、碱性磷酸酶(alkaline phosphatase,ALP)和谷氨酸脱氢酶(glutamate dehydrogenase,GLDH)显著降低(P<0.05);QXQJ 28.05 g·kg-1组PND22雌雄幼龄大鼠甘油三脂(triglycerides,TG)均显著升高(P<0.05),PND22雄性幼龄大鼠总胆固醇(cholesterol,CHOL)显著升高(P<0.05);提示肝功能相关指标(GPT,GOT,ALP 和GLDH)在各剂量组出现散在性差异,未见剂量-毒性关系,判断为幼龄大鼠生长发育过程中正常的生理波动;QXQJ 28.05 g·kg-1组幼龄大鼠TG 和CHOL 有升高现象,停药3 周后未见相关性变化,判断为幼龄大鼠哺乳期正常的生理变化(表4)。
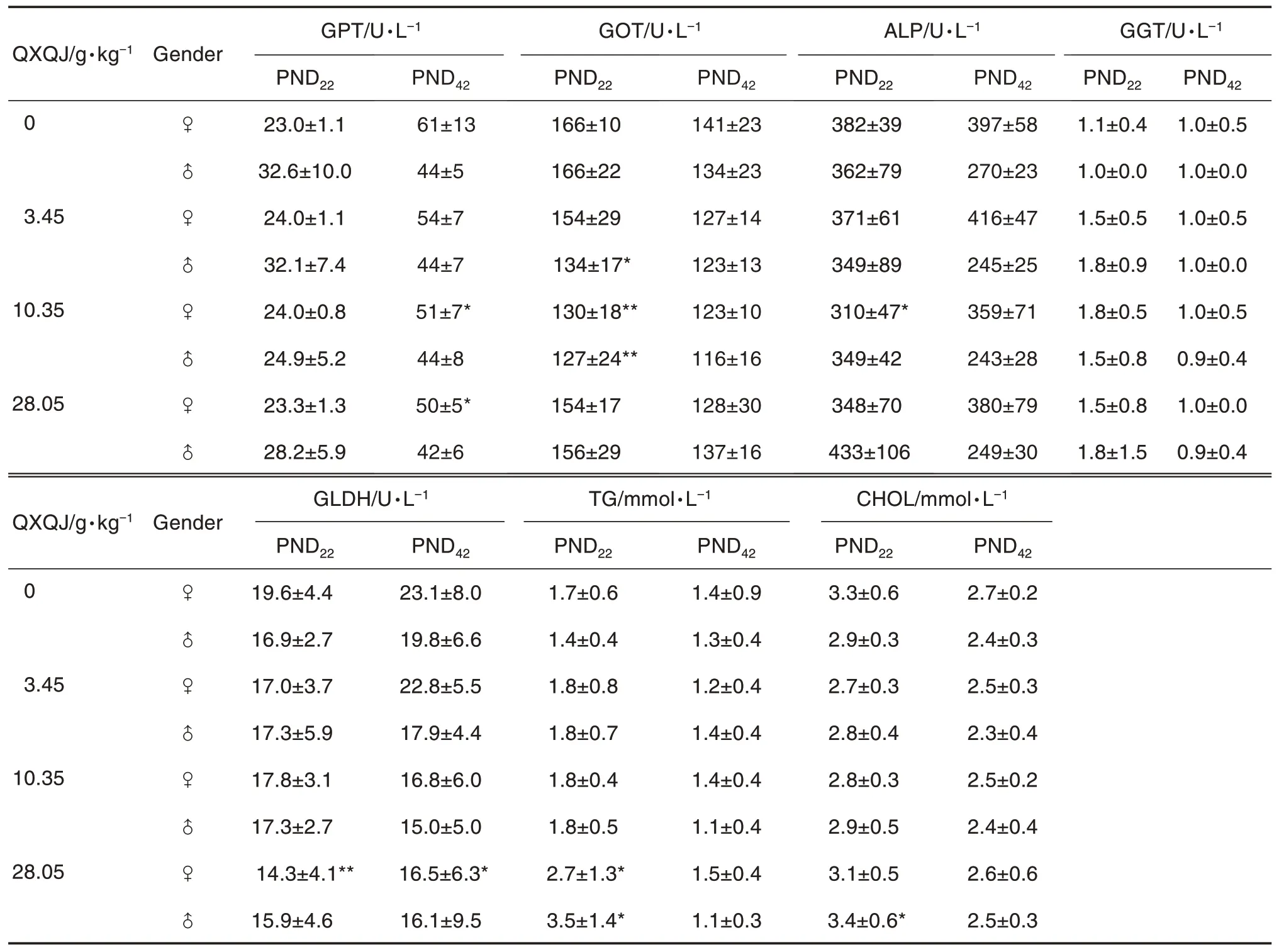
Tab.4 Effect of QXQJ on blood biochemistry of juvenile rats
2.9 免疫和生长激素
与溶剂对照组相比,QXQJ 3.45,10.35 和28.05 g·kg-1组雌雄幼龄大鼠PND22和PND42免疫和生长激素检测指标均未见明显差异(表5)。

Tab.5 Effect of QXQJ on immunity and growth hormone of juvenile rats
2.10 组织病理
结果(图5)显示,PND22和PND42末次处理后,HE 染色检查溶剂对照组和QXQJ 28.05g·kg-1组幼龄大鼠脑、心和肝等组织病理变化,均未见相关性异常变化。

Fig.5 Effect of QXQJ on histopathology changes of juvenile rats by HE staining.See Fig.1 for the rat treatment.
3 讨论
QXQJ已上市多年,相关临床研究表明,其在治疗小儿急性上呼吸道感染表里俱热证方面,疾病疗效、证候疗效均不劣于奥司他韦,且用于儿童人群时不良反应少,安全性良好[7-8]。本研究中重复ig给予3 个剂量的QXQJ 后,QXQJ 10.35 和28.05 g·kg-1组幼龄大鼠在给药期间均出现不同程度的黄棕色软便或稀便及腹部膨大等症状,28.05 g·kg-1剂量组较为明显,继而出现体重、体格和骨骼检查结果明显低于溶剂对照组;幼龄大鼠消化道不良症状在停药/离乳后(PND22)全部恢复,体重和体格在停药恢复1 周后基本恢复正常,骨骼发育指标在恢复期末与溶剂对照组相比亦无明显差异。上述不良反应具有群体效应和持续性,与临床研究结果“芩香清解口服液在改善小儿疾病病情、缓解呼吸道局部及全身症状的同时存在轻、中度消化不良反应(呕吐、腹泻)”[7-8]类似,分析可能与QXQJ 所含组分大黄蒽醌类成分的泻下作用相关[8-9],但QXQJ的急性毒性和长期毒性研究结果提示,其对成年小鼠和大鼠给药后均未发现毒性反应[10]。推测本研究中QXQJ 10.35 和28.05 g·kg-1组幼龄大鼠出现的不良反应与其消化系统尚未发育完全相关,停药后随其消化系统逐渐发育完全可全部恢复。亦考虑到幼龄大鼠尚未离乳,胃容量有限,ig 给予QXQJ 28.05 g·kg-1剂量的浓稠药液会直接影响其母乳摄入量,造成幼龄大鼠体重、体格和骨骼发育减缓,停药后逐渐恢复正常水平。
儿科人群正处于生长发育的特殊时期,受昼夜节律、心理和生理机能尚未发育成熟以及病理因素的影响,其在药物的吸收、分布、代谢、排泄等方面与成年人均存在差异,是临床用药风险评估中的敏感人群[11]。儿科用中药的发育毒性研究存在诸多困难,如检测项目繁琐而检测技术手段落后,进而影响检测效率;对幼龄动物的操作方法和护理经验缺乏以及特殊气味的中药制剂引起哺乳期母鼠对幼鼠的排斥等因素导致的仔鼠生长发育减缓甚至死亡;部分中药制剂的特殊性状导致幼龄动物给药操作难度增加,最终远不满足试验的暴露剂量等[12-14]。本研究考虑上述难点对试验进行以下优化:①给药期结束后,采用双能X射线幼龄大鼠身体成分分析系统(世界卫生组织金标准)对各组幼龄大鼠进行BMG 及BMD 检测分析,该系统主要优势为可进行活体动物检测分析,检测完毕后仍可进行其他活体检查等[15],可极大提升试验研究中的检查精度和效率;②重新组窝后将新窝中粘有母鼠粪便和尿液的垫料轻轻涂抹在仔鼠身上和操作人员的手上,重新分配的仔鼠在新窝中至少待10 min 后将代乳母鼠放回笼内,以增加代乳母鼠对新仔鼠的熟悉度及哺乳的迫切度;③为降低给予带气味的中药制剂后引起母鼠对仔鼠的排斥概率,每次给予受试物后均轻柔的将仔鼠埋入提前用母鼠尿液淋湿的垫料中以掩盖或减小母鼠对中药气味的识别。
综上所述,QXQJ 连续给药18 d,对PND4SD大鼠无不良反应剂量(no observed adverse effect level,NOAEL)为3.45 g·kg-1(相当于1岁儿童临床拟用量的1 倍);当剂量为10.35 和28.05 g·kg-1(相当于1 岁儿童临床拟用量的3 和8 倍)时,可导致未断乳幼龄大鼠出现黄棕色软便或稀便及腹部膨大等消化不良症状,继而影响其体格发育指标,离乳后症状可缓解,停药后基本恢复,表明QXQJ 对幼龄大鼠的生长发育无明显毒理学影响。
本研究针对儿科用中药发育毒性试验中存在的特定难点进行了探索突破,选择的检测技术及操作方法在满足中药发育毒性评价需求的同时保证了幼龄大鼠系统发育检测的精确性和效率,降低了外来因素对幼龄大鼠生长发育的影响,为儿科用中药发育毒性试验研究提供科学的参考。
