全基因转录组测序分析双氢青蒿素改善脂多糖诱导小鼠急性肺损伤机制
2024-01-04杨鲁霞张孝昌李擎宇魏振桥黄曼琼焦园园邢雅玲王升启
杨鲁霞,张孝昌,李擎宇,魏振桥,黄曼琼,焦园园,邢雅玲,王升启
(1.河南中医药大学药学院,河南 郑州 450046;2.军事科学院军事医学研究院生物信息中心,北京 100850)
急性肺损伤(acute lung injury,ALI)是一种以肺弥散功能障碍为特征的由多种非心源性因素引起的急性进行性呼吸衰竭,其加重期为急性呼吸窘迫综合征(acute respiratory distress syndrome,ARDS),可发展为多器官功能衰竭,严重威胁人体健康[1-2],其特征性临床表现为低氧性呼吸衰竭、功能残气量降低、肺顺应性降低、非静液性双侧肺浸润、富含蛋白质渗出物和中性粒细胞引起的血管通透性增加等[3]。多种炎症介质引发一系列炎症反应,中性粒细胞在肺部积聚,是肺组织损伤的重要因素,而炎症反应的过度放大或失控是ALI 发生发展的重要机制[4]。ALI 死亡率高,有效治疗方法少,迫切需要探索更有效的ALI治疗策略。
青蒿素是一种从中草药青蒿中分离出来的倍半萜内酯,被用于治疗疟疾等寄生虫病[5]。双氢青蒿素(dihydroartemisinin,DHA)是青蒿素的主要活性代谢产物,具有较强的抗疟活性和较高的生物利用度[6],在免疫调节、抗氧化和抗肿瘤方面具有重要作用[7-12]。研究表明,DHA 具有抗炎作用[13-14],可减轻脂多糖(lipopolysaccharide,LPS)诱导的小鼠脓毒症急性肾损伤的炎症反应、抑制NF-κB 信号通路激活和氧化应激[15],通过磷脂酰肌醇3 激酶(phosphatidyloinositol-3 kinase,PI3K)/蛋白激酶B(protein kinase B,Akt)信号通路促进自噬[16]。但DHA在急性肺损伤中的抗炎作用机制尚不清楚。
全基因转录组测序技术通过同时检测信使RNA(mRNA)、长链非编码RNA(lncRNA)、环形RNA(circRNA)、微RNA(microRNA)等表达,结合多种生物信息学分析,得到差异表达基因,并进行功能通路富集,从而分析在确定表型中起主要作用的基因,探究其潜在的调控网络与机制[17-18],为研究疾病机制提供新角度,为药物靶标发现提供新方法。
本研究制备LPS 诱导的ALI 小鼠模型,ip 给予DHA 干预,通过对比模型组和DHA 组小鼠的病理变化、ALI 相关炎症因子分泌等,探讨DHA 对LPS诱导的ALI 小鼠的干预作用,并通过全基因组转录组测序策略,探索DHA 发挥作用的潜在靶标及机制。
1 材料与方法
1.1 药物、主要试剂和仪器
DHA(用1%吐温80和10%聚乙二醇400溶液配制为混悬液)和LPS(溶于生理盐水)(美国Sigma公司);吐温80 和聚乙二醇400(macrogol 400,PEG-400)(大连美仑生物技术有限公司);小鼠白细胞介素6(interleukin 6,IL-6),IL-β和肿瘤坏死因子α(tumor necrosis factor-α,TNF-α)ELISA 试剂盒(北京索莱宝科技有限公司);4%多聚甲醛固定液(碧云天生物技术研究所);RNA Easy Fast 动物组织/细胞总RNA提取试剂盒(离心柱型)、FastKing一步法除基因组cDNA 第一链合成预混试剂和SYBR Green I PCR(real time-quantitative polymerase chain reaction,RT-qPCR)实时荧光定量试剂盒(天根生化科技有限公司)。实时定量PCR 仪(型号:7500 Real-Time PCR System,美国Thermo Fisher Scientific 公司);PCR 仪(型号:C1000 Touch Thermal Cycler,美国Bio-Rad Laboratories公司);酶标仪(型号:Epoch,美国BioTek 公司);化学发光免疫分析仪(型号:MP180,北京泰格科信生物科技有限公司);Qubit荧光仪(美国Thermo Fisher Scientific公司)。
1.2 动物、分组和给药
30只C57BL/6J雄性小鼠,7周龄,体重20~22 g,购于北京维通利华实验动物有限公司,生产许可证号:SCXK(京)2021-0006,饲养于SPF 级动物房,采用12 h间歇光照,环境温度为22~26 ℃,相对湿度为60%~70%,动物摄食、饮水自由。动物实验经军事科学院军事医学研究院伦理委员会审批,编号:IACUC-DWZX-2021-748。
小鼠适应性喂养7 d,随机分为正常对照组、模型组、模型+DHA 组,每组10 只。ip 给予LPS 10 mg·kg-1制备ALI模型,正常对照组小鼠给予等体积生理盐水,模型+DHA 20 mg·kg-1组ip 给予DHA 20 mg·kg-1,给药体积为0.01 mL·g-1。
1.3 样本制备
肺组织制备:给药后24 h 处死小鼠,分别取出左肺叶、右肺上叶、右肺中叶和右肺下叶。
肺泡灌洗液(bronchoalveolar lavage fluid,BALF)制备:给药后24 h 处死小鼠,体表消毒后剪开小鼠皮肤使胸腔暴露,分离气管,将预冷的1 mL PBS经主气管注入肺部,灌洗3次,每次停留1 min,灌洗后回收BALF。
1.4 肺组织湿/干重比的测定
取1.3 制备的左肺叶,用4 ℃预冷的生理盐水洗净,滤纸吸干水分,称取质量记作湿重(wet weight,W)。将肺组织置于60 ℃烘箱中,干燥48 h至恒重后,称取质量记作干重(dry weight,D),计算W/D比值。
1.5 HE染色观察肺组织病理改变
取1.3 制备的右肺上叶置于4%多聚甲醛中固定,石蜡包埋,切成5 μm 切片,进行HE 染色,置于显微镜下观察病理变化。
1.6 细胞计数仪分类计数BALF中炎症细胞
取1.3 制备的BALF,用细胞计数仪测定白细胞总数。将BALF 4 ℃下500×g离心10 min,弃上清液;取细胞沉淀制成细胞重悬液,取20 μL涂片,进行瑞士吉姆萨染色,进行细胞分类计数。
1.7 酶联免疫吸附实验(enzyme linked immunosorbent assay,ELlSA)检测BALF中TNF-α,lL-1β和lL-6水平
取1.3 制备的BALF,将BALF 4 ℃下500×g离心10 min,取上清液用ELISA 试剂盒检测BALF 中TNF-α,IL-1β和IL-6水平。
1.8 RT-qPCR 法检测小鼠肺组织中IL-1β,IL-6,TNF-α,胎盘特异蛋白8(placenta-specific protein 8,Plac8)和Toll 样受体7(Toll-like receptor 7,TLR7)mRNA表达
取1.3 制备的右肺中叶应用RNA Easy Fast 动物组织/细胞总RNA 提取试剂盒(离心柱型)提取小鼠肺组织RNA。测定RNA 浓度后,应用FastKing一步法除基因组cDNA第一链合成预混试剂盒将提取的RNA 逆转录为cDNA,应用Talent 荧光定量检测试剂盒(SYBR Green)进行相关基因的定量检测,以β肌动蛋白为内参基因,由2-ΔΔCt法计算基因的相对表达水平。相关引物由生工生物工程(上海)股份有限公司合成,引物序列见表1。

Tab.1 Primers for real-time quantitative polymerase chain reaction(RT-qPCR)
1.9 小鼠肺组织全基因转录组测序及生物信息学分析
取1.3 制备的右肺下叶,快速置于液氮罐中待转录组测序,小鼠肺组织全基因转录组测序由联川生物公司进行。对原始测序结果进行过滤,去除接头污染、低质量、含N 比例>5%的Reads,得到高质量序列(clean data)。应用Ensembl 平台小鼠GRCm38 基因组及v100 注释文件构建参考基因组文件,Hisat2(V2.2.1)软件将高质量序列比对到参考基因组上,featureCounts(V2.0.0)软件统计比对到每个基因上的Reads 个数,得到基因的表达水平。应用DEseq2V1.32.0 软件对样本进行差异表达分析。先分别选取正常对照组、DHA 干预组(20 mg·kg-1)相对于对模型组的差异基因〔logFC>1且FDR(false discovery rate)<0.05〕;然后,选取二者变化趋势相反的差异基因作为显著差异表达基因。根据差异基因检测结果,对显著差异表达基因进行GO和KEGG通路富集分析。
1.10 统计学分析
2 结果
2.1 DHA 对LPS 诱导的ALl 模型小鼠肺组织湿/干重比值的影响
模型组小鼠肺W/D 值(7.3±0.4)较正常对照组(4.2±0.4)显著升高(P<0.01),模型+DHA组小鼠肺W/D 值(5.5±0.5)较模型组显著降低(P<0.01),提示DHA能够显著改善毛细血管渗漏,减轻肺水肿。
2.2 DHA 对LPS 诱导的ALl 模型小鼠肺组织形态的影响
HE 染色结果(图1)显示,正常对照组小鼠肺泡结构完整,无明显病理改变;模型组小鼠肺组织炎症细胞浸润严重,肺泡间隔增厚,肺泡腔变小,肺泡水肿、充血;模型+DHA 组上述组织病理学损伤明显改善,炎症细胞浸润减轻。
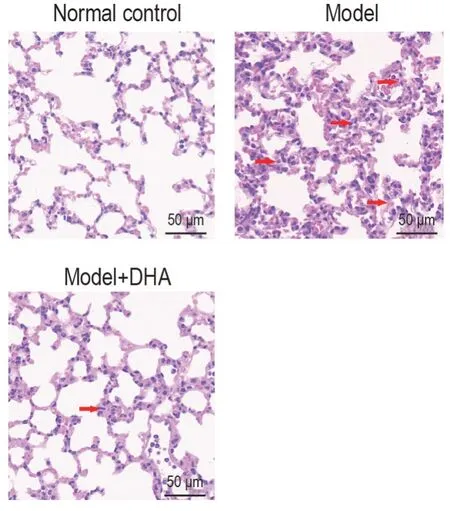
Fig.1 Effect of dihydroartemisinin(DHA)on lung histopathological morphology in acute lung injury(ALl)model mice induced by lipopolysaccharide (LPS)(HE staining).The mice were adaptively fed for 7 d,and randomly divided into normal control group,model group,and model+DHA group,with 10 mice in each group.The model was induced by LPS(ip,10 mg·kg-1).Meanwhile,mice in model+DHA group were injected ip with DHA 20 mg·kg-1.The mice were executed 24 h after DHA administration.Arrows show alveolar cavity shrinking,thickening alveolar septum,inflammatory cell infiltration and the formation of hyaline membranes.
2.3 DHA 对LPS 诱导的ALl 模型小鼠BALF 中炎症细胞数的影响
光镜下观察细胞计数涂片(表2)可见,模型组中性粒细胞、淋巴细胞、嗜酸性粒细胞、白细胞等炎症细胞数均较正常对照组显著增多(P<0.01),而模型+DHA组较模型组显著减少(P<0.01)。

Tab.2 Effect of DHA on counts of inflammatory cells in bronchoalveolar lavage fluid(BALF)of ALl model mice induced by LPS
2.4 DHA 对LPS 诱导的ALl 模型小鼠BALF 中炎症细胞因子水平的影响
2.4.1 ELlSA
表3结果显示,与正常对照组相比,模型组小鼠BALF 中炎症因子IL-1β,IL-6 和TNF-α 水平显著升高(P<0.01);与模型组相比,模型+DHA 组小鼠BALF 中IL-1β,IL-6 和TNF-α 分泌水平显著降低(P<0.01)。提示DHA 能够抑制炎症细胞因子的分泌,缓解LPS诱导的ALI。
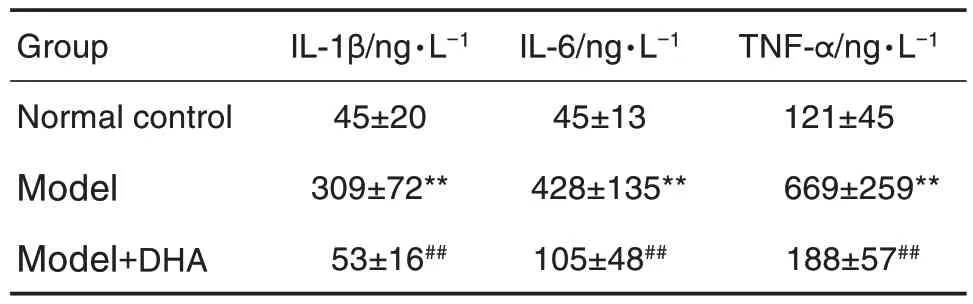
Tab.3 Effect of DHA on levels of lL-1β,lL-6 and TNF-α in BALF of ALl model mice induced by LPS
2.4.2 RT-qPCR
RT-qPCR 检测结果(表4)显示,与正常对照组相比,模型组小鼠肺组织中炎症因子IL-1β,IL-6和TNF-αmRNA表达水平显著升高(P<0.01);与模型组相比,模型+DHA 组小鼠肺组织中IL-1β,IL-6和TNF-αmRNA 表达水平显著降低(P<0.05,P<0.01)。提示DHA 能够抑制肺组织中炎症细胞因子mRNA表达水平。

Tab.4 Effect of DHA on mRNA levels of lL-1β,lL-6 and TNF-α in lung tissue of ALl model mice induced by LPS
2.5 DHA 对LPS 诱导的ALl 模型小鼠肺组织全基因转录组测序及生物信息学分析
由图2结果显示,与正常对照组相比,模型组差异基因共有3 153 个,其中上调1 745 个,下调1 408 个。与模型组相比,模型+DHA 组差异基因1 255 个,其中上调336 个,下调919 个。对正常对照组、模型组和模型+DHA 干预组之间的差异表达基因进行GO 功能富集分析,结果(图3)显示,差异表达基因在生物过程中主要共同富集的前30 个重要条目为:细胞因子生成调控、T 细胞活化调节、白细胞迁移和细胞趋化作用等。对正常对照组、模型组和模型+DHA组之间的差异表达基因进行KEGG通路富集分析,前20条结果(图4)显示,涉及304 条生物学功能相关信号通路,其中共同显著富集的途径中免疫相关通路包括B 细胞受体信号通路、趋化因子信号通路、FcγR介导吞噬作用信号通路和NF-κB信号通路信号通路等。

Fig.2 Volcano maps of differentially expressed genes in lung tissue of ALl model mice induced by LPS.See Fig.1 for the mouse treatment.FDR:false discovery rate;Fold change:the average gene expression levels of the two groups.

Fig.3 GO enrichment analysis of differentially expressed genes in lung tissue of ALl model mice induced by LPS.See Fig.1 for the mouse treatment.Mouse lung tissue was collected for RNA transcriptome sequencing(RNA-seq).Top 30 significant biological processes,cellular components and molecular function determined by GO functional enrichment analysis for differentially expressed genes.A:the GO analysis diagram of model group and normal control group;B:the GO analysis of the model group and the model+DHA group.In the figure,BP represents the biological process module,CC represents the cellular component module,and MF represents the molecular function module.The color bars ranging from blue to red represent the adjusted P-value of enrichment significance,with blue indicating a large adjusted P-value and red indicating a small adjusted P-value.

Fig.4 KEGG pathway enrichment analysis of differentially expressed genes in lung tissue of ALl model mice induced by LPS.See Fig.1 for the mouse treatment.Mouse lung tissue was collected for RNA transcriptome sequencing(RNA-seq).A:the KEGG analysis chart compared with the normal control group in the model group;B:the KEGG analysis of the model group compared to the model+DHA group.The color bars ranging from blue to red represent the adjusted P-value of enrichment significance,with blue indicating a large adjusted P-value and red indicating a small adjusted P-value.
该分析结果表明,从基因差异表达分析,DHA作用的潜在基因靶标数量较多;从差异基因的功能分析,DHA 可能主要通过调控炎症与免疫反应相关信号通路,发挥抑制小鼠ALI作用。
2.6 DHA改善小鼠ALl炎症的潜在调控靶点筛选
从差异表达基因中筛选模型组较正常对照组显著上调、模型+DHA 组较模型组显著下调且变化趋势稳定的免疫相关差异表达基因进行后续表达验证,包括免疫相关的胎盘特异蛋白8(placentaspecific 8,Plac8)、Toll样受体7(Toll-like receptor 7,TLR7)、同种异体移植炎症因子1(allograft inflammatory factor 1,Aif1)、POU 2级同源框2(POU domain,class 2,transcription factor 2,Pou2f2)和邻苯二甲酰胺抗菌肽(cathelicidin antimicrobial peptide,Camp)等。Plac8 调节细胞增殖、分裂、分化、免疫和凋亡等生理活动,在细菌感染防御中发挥重要作用[19]。TLR7 和Pou2f2 调节IL-6 产生,调控病原体的先天免疫应答。Aif1作为活化巨噬细胞的标志物,可促进炎症介质的表达并刺激炎症细胞的增殖和迁移[20]。Camp 也在防御微生物感染中起重要作用。
2.7 DHA 对LPS 诱导的ALl 小鼠肺组织关键基因mRNA表达影响
应用RT-qPCR,对选取的基因Plac8,TLR7,Aif1,Pou2f2和CampmRNA 表达水平进行验证。结果(表5)显示,与正常对照组相比,模型组小鼠肺组织Plac8和TLR7mRNA 表达均显著上升(P<0.01);与模型组相比,模型+DHA 组小鼠肺组织Plac8和TLR7mRNA 表达均显著降低(P<0.05,P<0.01)。Plac8和TLR7mRNA 表达与转录组测序表达趋势一致,Aif1,Pou2f2和CampmRNA表达与转录组测序表达趋势不一致。提示ALI可导致小鼠肺组织Plac8和TLR7表达活化诱发炎症反应,DHA 能够降低LPS 损伤小鼠肺组织Plac8和TLR7mRNA表达改善小鼠炎症反应,Plac8和TLR7可能是DHA发挥抗炎作用的潜在靶点。

Tab.5 Effect of DHA on expression of relevant differentially expressed genes in lung tissues of ALl model mice induced by LPS
3 讨论
本研究结果表明,DHA能有效改善LPS诱导的ALI小鼠肺组织病理变化,显著降低小鼠肺组织W/D比值和BALF中炎症细胞数,并减少促炎因子TNF-α,IL-1β和IL-6的分泌。研究表明,LPS通过激活炎症细胞,诱导促炎细胞因子过度产生,造成血管内皮损伤,血管通透性增加,引发弥漫性肺泡损伤、肺水肿等病理表现[21-22]。本研究结果表明,DHA 可能通过降低内皮屏障通透性、改善微血管渗漏、减轻肺水肿、调节多种炎症因子分泌而改善ALI的炎症反应。
本研究采用全基因组转录组测序技术,分析正常对照组、模型组、DHA 干预组小鼠肺组织中的差异表达基因。初步筛选到免疫相关的2 个关键基因——Plac8和TLR7。TLR7 属于TLR 家族,在炎症、先天免疫和宿主感染防御中发挥着核心作用[23],主要由单链RNA 激活,受到接头分子髓样分化因子(myeloiddifferentiationfactor88,MyD88)和肿瘤坏死因子受体相关因子(tumor necrosis factor receptor-associated factors,TRAF)等调控,最终促进NF-κB p65 活化、诱导Ⅰ型干扰素的产生;TLR7通过激活NF-kB信号转导,诱导IL-6和TNF-α等炎症因子产生,促进炎症反应[24-26]。本研究结果表明,DHA对ALI的改善作用,可能通过作用TLR7,调节NF-κB信号转导以减轻小鼠肺部炎症[27]。有研究显示,DHA可以抑制NF-κB信号转导减轻LPS诱导的小鼠肺部炎症[28],本研究结果与此报道一致。
Plac8 在呼吸道纤毛细胞、分泌细胞和肺树突状细胞、淋巴细胞、上皮细胞以及对SARS-CoV-2感染高度敏感的细胞中高度表达,定位于溶酶体区,是参与自噬反应和程序性细胞死亡的关键调节分子,而ALI 诱发的炎症反应涉及免疫细胞等多种细胞的程序性死亡和细胞周期调控[28-30]。Plac8 通过作用于PI3K/Akt/NF-κB,PI3K/Akt/GSK3β 和Wnt信号通路,调节细胞增殖和(或)凋亡,促进炎症细胞因子IL-6 的产生,加重炎症进展[31-33]。本研究结果表明,Plac8 是DHA 作用的相关分子,可能是DHA 减轻ALI的新作用靶标。差异表达基因GO和KEGG 通路富集分析显示,DHA 主要通过调控炎症与免疫反应相关信号通路发挥减轻ALI 的作用,与Plac8和TLR7功能相符。
本研究结果表明,DHA 能够减轻LPS 诱导的ALI,通过转录组测序发现,Plac8 和TLR7 可能是DHA治疗ALI潜在靶点,其机制可能为DHA通过降低TLR7和Plac8mRNA的表达,负调控其参与的信号转导通路,进而调控炎症相关细胞因子分泌、免疫细胞活化等免疫反应,以多靶点多途径方式改善ALI,发挥抑制小鼠ALI的作用,减轻肺部炎症损伤。
