谷氨酸化学交换饱和转移成像对放射性脑损伤大鼠的应用价值
2024-01-04李国栋刘岩李昊刘彩云李祥林李青龙翁娜宾莉黄丹琪王旭
李国栋,刘岩,李昊,刘彩云,李祥林,李青龙,翁娜,宾莉,黄丹琪,王旭*
作者单位:1.滨州医学院附属医院核医学科,滨州 256600;2.滨州医学院医学影像学院,烟台 264003;3.河南省中医院磁共振室,郑州 450000
0 前言
放射治疗(radiation therapy, RT)是头颈部肿瘤的有效治疗手段,但不可避免对正常脑部造成损害,形成放射性脑损伤(radiation-induced brain injury, RBI)[1]。随着放疗后五年存活率的提高和患者对术后生活质量的重视,RBI 正日益成为一个重要的预后问题。特别是,高达50%~90%全脑放疗患者在RT后6个月出现渐进性认知障碍[2]。RBI诱导认知障碍有两种:RT 后半年内常出现短暂性认知障碍,随后改善;RT 半年后认知功能形成不可逆转的晚期损伤[3-4]。测量RT后脑组织细微的生理和代谢变化及其与神经认知功能的关系可以为RT提供指导并保护脑功能。多参数MRI 凭借其代谢和功能成像的优势已用于诊断和监测RBI 诱导认知障碍,然而由于疾病的进展复杂性很难确定影像标记物,尤其是无结构损伤的早期阶段[2]。动态对比增强磁共振成像(dynamic contrast-enhanced magnetic resonance imaging, DCE-MRI)是一种提供血管信息的体内成像方法。研究人员使用DCE-MRI 发现脑肿瘤患者海马早期血管剂量反应与晚期神经认知功能存在相关性[5],但其应用范围受到对比剂和磁场均匀性的影响而有限。扩散张量成像(diffusion tensor imaging, DTI)是评估白质微结构(如脱髓鞘与轴突功能障碍)的最佳手段,有研究表明DTI 指标的变化与放疗后引起的视觉空间记忆有关[6]。DTI主要可视化白质纤维束,而灰质是高级认知中枢,如颞叶和额叶等辐射敏感皮层无法很好被评估;在疾病进展不同阶段各个白质脑区的DTI 指标变化各异,增加了RBI 的诊断难度。静息态功能磁共振成像(resting-state functional magnetic resonance imaging, rs-fMRI)是一种研究大脑神经元功能的非入侵有效方法,RT 早期通过低频振幅、局部一致性和功能连接等指标可以预测头颈部肿瘤患者放疗后神经认知功能[7]。然而,rs-fMRI对数据采集要求严格,后处理流程和数据分析比较复杂。质子磁共振波谱(proton magnetic resonance spectroscopy,1H-MRS)已应用于脑代谢物的无创测量[8-10]。全脑放疗4 个月后左海马N-乙酰天冬氨酸(N-acetylaspartate,NAA)浓度下降与听觉词语学习下降有关[11]。大脑化学物质的变化可能表明早期大脑神经元损伤,但是MRS 转化为临床应用面临很多挑战。首先,采集时间长和设置参数标准不一,空间分辨率差以及缺乏高质量波谱图像[12]。其次,波谱的半量化分析一般是比值,结果可能存在误差以及几乎所有量化软件无法获得一致的高质量波谱数据分析。
辐射诱导认知功能障碍的研究主要集中在海马,因为海马不仅具有高度的放射敏感性,还是学习和记忆的中枢。众所周知,认知功能与大脑海马谷氨酸和N-甲基-D-天冬氨酸(N-Methyl-D-aspartic acid, NMDA)受体的信号水平和活性的变化密切相关[13-14],先前的研究[13]也表明RBI 大鼠的病理生理变化与谷氨酸水平有关。因此,可视化和量化分析谷氨酸信号可能是诊断RBI 潜在的生物标志物。谷氨酸化学交换饱和转移(glutamate chemical exchange saturation transfer, GluCEST)是一种有前途的无创分子成像技术[15-17],定量分析结果比较准确,具有超高的敏感度和空间分辨率,已用于分析各种脑部疾病[18-20]。它主要基于化学交换饱和转移(chemical exchange saturation transfer, CEST)效应,使用谷氨酸的氨基质子交换自由水测量得到结果[21]。先前研究[22]显示,酰胺质子转移(amide proton transfer, APT)成像使用来自内源性细胞蛋白和肽的酰胺质子信号,用于区分复发性肿瘤和放射性脑坏死。然而,GluCEST 对RBI 的应用价值尚见报道。因此,通过MRI评估这种兴奋性神经递质代谢变化有利于诊断和预测晚期辐射诱导认知毒性。这最终可能使脑肿瘤患者受益,为采取预防措施提供有效依据,以尽量减轻RBI的损害。在这项研究中,我们假设依靠分子成像来识别RBI 病变区域,应用GluCEST 成像技术可视化和定量评估RBI 大鼠海马谷氨酸信号的变化以及与神经认知功能的关系。此外,本研究还使用了高效液相色谱仪(high-performance liquid chromatography, HPLC)测量海马谷氨酸浓度与GluCEST 信号获得数据进行比较,以证明GluCEST 测量的信号稳定性。评估RBI 大鼠模型中大脑海马生物学信息是GluCEST成像技术的新应用,开发了一种用于理解和临床评估脑部放疗认知效应的新工具。
1 材料与方法
1.1 实验动物
所有实验均严格按照国家研究委员会实验室实验动物护理和使用指南进行,并得到滨州医学院伦理委员会的批准,批准文号:2022602。5 周龄雄性SPF 级无病原体Sprague-Dawley(SD)大鼠购自济南朋悦实验动物中心。为排除外界因素对实验结果的干扰,在实验开始前对大鼠进行适应性喂养1 周,将每只大鼠单独饲养在室温(23±2)℃、湿度(55±10)%、可自由获取饮用水和食物、12 h 的光照/黑暗循环和通风良好的环境。
1.2 实验模型
大鼠在辐照前腹腔注射注射4% 水合氯醛(1 mL/100 g,天津市科密欧化学试剂有限公司,中国)麻醉。参照先前的研究[23],使用精确X 射线辐照仪(X-RAD 320,Precision X-ray 公司,美国)对小动物进行辐照,构建急性RBI 大鼠模型:辐照野的前界大致为每只大鼠双眼后眦的连线,后界位于双耳后眦的连线,大鼠身体的其余部分被特制的铅块屏蔽。将大鼠分为两组:对照组(n=9)和RBI组(n=9)。对照组大鼠麻醉并置于X 射线辐照仪中,但不进行辐照。RBI组大鼠接受30 Gy的单次垂直全脑辐照(320 kV,12.5 mA,3.275 Gy/min)。所有年轻的成年大鼠在实验中全部存活。
1.3 行为和体质量测量
在研究期间,辐照前后每日观察各组大鼠的精神状况和食欲等行为情况,每周测量并记录大鼠的体质量,评估全脑辐射对体质量的影响。一共观察时间为6 周,每周测量一次,包括辐照前适应性喂养的1周,辐照前当天以及辐照后的5周。
1.4 Morris水迷宫实验
为了检测辐射诱导大鼠认知功能的变化,每组大鼠在辐照4 周后进行水迷宫实验。Morris 水迷宫实验(DMS-2Morris 水迷宫,中国医学科学院药物研究所,中国)是在充满不透明水的塑料圆形水池(直径1.5 m)中进行的[24]。简言之,水池内划分为四个象限,存放一个透明平台(直径10 cm)淹没在目标象限(象限Ⅲ)中心的水面下1 cm。在实验的前一天,允许大鼠在水迷宫中自由游泳60 s 适应平台的环境。定位航行实验为期4 天,每天训练4 次,将老鼠放置分别放在四个象限之一的水中,并允许搜索平台长达60 s,大鼠若找到平台允许它停留10 s,在规定时间内未找到平台,手动引导它们到达平台停留10 s,之后进行下一象限重复此过程。总路程被记录为大鼠到达透明平台所需的距离长度,游泳速度是大鼠在实验过程中的平均移动速度。在空间探索实验期间,移除透明平台,将大鼠放入水中游泳60 s。计算大鼠在目标象限(象限Ⅲ)的停留路程和穿越次数,表明每组大鼠巩固记忆的程度。
1.5 MRI扫描
在水迷宫实验后,使用7.0 T小动物磁共振(70/20 PharmaScan, Bruker公司,德国)进行MRI数据扫描,采用Bruker 四通道表面线圈进行头部定位扫描。冠状位分别采集了T2WI和GluCEST序列。T2WI使用快速采集弛豫增强(rapid acquisition relaxation enhanced, RARE)序 列,参数 如下:视野35 mm×35 mm,TR 3500 ms,TE 33 ms,层厚0.8 mm,矩阵256×256,激励次数4。在每只大鼠扫描CEST序列之前,在感兴趣区(region of interest, ROI)使用局部高阶匀场以提高信噪比和磁场均匀性。选择观察良好的海马层面作为GluCEST参考层面。GluCEST使用连续波射频饱和脉冲的压脂RARE序列,参数如下:共51个频率偏移(扫描频率范围从-5~+5 ppm,间隔为0.2 ppm),射频饱和功率3.6 μT,TR 5500 ms,TE 3.56 ms,视野35 mm×35 mm,层厚1 mm,矩阵70×70,激励次数2。
1.6 CEST图像处理
MRI 数据使用Matlab 2018a 软件(Mathworks,Natick MA,美国)中的自定义脚本进行处理[25]。使用基于ROI 的方法进行CEST 分析,所有图像由两名工作年限为3~4年的放射住院医生独立勾画海马双侧ROI,重复测量3次取平均值。GluCEST值(GluCEST%)表示大脑中谷氨酸的相对浓度,通过非对称性磁化转移速率MTRasym计算得到的,见公式(1):
其中,谷氨酸在3.0 ppm 处,Ssat和S0分别是有和无饱和脉冲的信号强度。
1.7 HPLC谷氨酸测量
MRI 扫描后,立即处死大鼠并快速取出大脑储存至-80°C 冰箱(Forma 900 Series,Thermo Scientific公司,美国),采用HPLC 方法测量从脑组织提取的海马谷氨酸含量[26]。首先,使用电子天平(XSR1005 DualRange,Mettler Toledo 公司,瑞典)将整个海马组织样品进行称重,以m∶v=1∶19 的比例溶解在50%甲醇(Oceanpak 公司,瑞典)中并充分匀浆。使用离心机(H1750R,长沙湘仪离心机仪器有限公司,中国)将匀浆液在4°C 下以14000 r·min-1离心35 min,用0.22 μm 滤膜过滤,取上清液5 μL 进样分析。使用配备荧光检测器和Hypersil Supersil ODS2色谱柱(4.6 mm×200 mm,5 μm,大连依利特分析仪器有限公司,中国)的HPLC(Agilent 1260,Agilent公司,美国)分析谷氨酸含量。
1.8 统计学分析

2 结果
2.1 行为和体质量评估
与对照组相比,RBI 组大鼠第一周左右开始出现相互攻击的行为,食欲和饮水量减少,部分大鼠全脑出现脱毛现象。如图1所示,与对照组相比,经30 Gy的X 射线辐照大鼠从第一周开始体质量降低(t=25.9,P<0.0001)。RBI 组大鼠在辐照后第一周左右体质量持续下降,虽然随后几周体质量逐渐回升,但未达到对照组的体质量。

图1 全脑辐照对体质量的影响。30 Gy导致大鼠从第一周开始体质量显著降低。****:P<0.0001,***:P<0.001,**:P<0.01。Fig.1 Effects of whole-brain irradiation on body weight.30 Gy caused a significant reduction in the body weight of the rats from the first week.****: P<0.0001, ***: P<0.001, **: P<0.01.
2.2 Morris水迷宫评估
本研究使用Morris水迷宫测试评估了两组大鼠的海马依赖性空间学习和记忆能力(图2)。在定位航行期间,与对照组相比,RBI 组大鼠到达隐藏平台的总路程上花费了更多的时间(t=3.7,P=0.009,图2A)和游泳速度略微增加(图2B),但是差异无统计学意义,表明辐照4周后大鼠学习能力受损较轻。在空间探索期间,与对照组相比,RBI 大鼠在目标象限的停留路程(t=2.5,P=0.030,图2C)和穿越原平台的次数减少(U=15.5,P=0.020,图2D),这表明RBI 破坏了空间记忆保留。
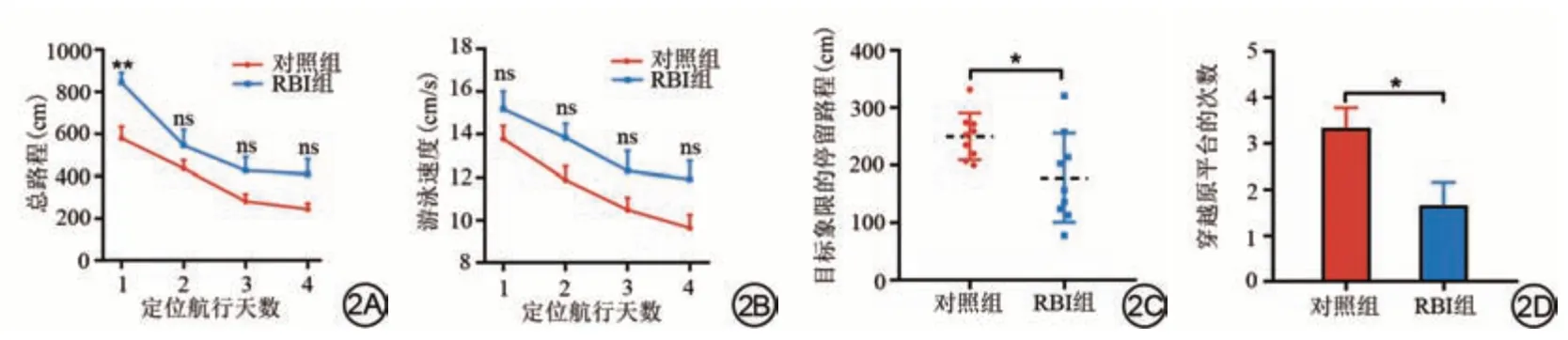
图2 RBI导致了大鼠的认知能力下降。2A~2B:定位航行实验中两组大鼠的总路程和游泳速度;2C~2D:空间探索实验中两组大鼠在目标象限内停留路程和穿越原平台的次数。ns:P>0.05,*:P<0.05,**:P<0.01。RBI:放射性脑损伤。Fig.2 RBI caused cognitive decline in rats.2A-2B: Total distance travelled and swimming speed of the two groups of rats in the localisation navigation experiment; 2C-2D: Staying distance in the target quadrant and traversed the original platform for both groups of rats in the space exploration experiment.ns: P>0.05, *: P<0.05, **: P<0.01.RBI: radiation-induced brain injury.
2.3 GluCEST评估
对照组和RBI组大鼠海马GluCEST效应如图3所示。对照组和RBI 组大鼠海马GluCEST 值差异具有统计学意义(对照组vs.RBI 组:2.84%±0.07% vs.2.48%±0.03%,t=3.0,P=0.008,图3B)。与对照组相比,RBI 组中的 MTRasym 曲线在2~5 ppm 范围内有明显的宽幅(图3E),这可能是由于谷氨酸的更快交换速率和化学位移平移效应,正如先前报道的那样[17]。图3F 定量分析显示2.6 ppm(对照组vs.RBI组:3.09%±0.09% vs.2.66%±0.13%,t=4.2,P=0.016)和2.8 ppm(对 照 组vs.RBI 组:3.07%±0.06% vs.2.64%±0.08%,t=2.8,P=0.001)频率偏移处观察到显著的CEST效应。该MTRasym值显示最大的不对称性发生在3.0 ppm (对照组vs.RBI 组:3.10%±0.02% vs.2.64%±0.04%,t=9.5,P<0.0001)。
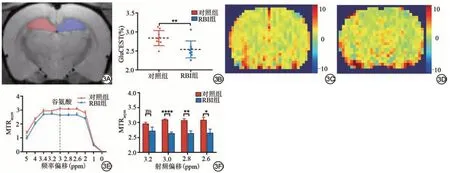
图3 选取的ROI位置及所对应的CEST效应。3A:海马为双侧ROI;3B:两组GluCEST 值比较;3C:对照组典型GluCEST 图;3D:RBI 组典型GluCEST 图;3E:两组在海马0~5 ppm 的非对称谱(3 ppm 为谷氨酸);3F:2.6~3.2 ppm 的非对称谱定量分析。ns:P>0.05,*:P<0.05,**:P<0.01,***:P<0.001,****:P<0.000 1。RBI:放射性脑损伤;GluCEST:谷氨酸化学交换饱和转移;MTRasym:磁化转移率不对称性。Fig.3 Selected ROI locations and corresponding CEST effects.3A:Hippocampus for bilateral ROI; 3B: Comparison of GluCEST between two groups; 3C: Typical GluCEST plot for control group; 3D: Typical GluCEST plot for RBI group; 3E: Asymmetric spectra of both groups in hippocampus 0-5 ppm(3 ppm for glutamate); 3F: Quantitative analysis of asymmetric spectra from 2.6-3.2 ppm.ns: P>0.05, *: P<0.05, **: P<0.01, ***: P<0.01, ****: P<0.0001.RBI: radiation-induced brain injury; GluCEST: glutamate chemical exchange saturation transfer; MTRasym: magnetization transfer rate asymmetry.
2.4 HPLC谷氨酸评估
HPLC 分析可以避免影响GluCEST 的某些混杂因素,包括呼吸、B0 场的不均匀性等,以进一步评估海马谷氨酸水平。两组样品的HPLC 分析结果见图4。与对照组相比,RBI 组海马谷氨酸浓度较低(对照组vs.RBI 组:14.41±0.44 vs.12.12±0.50,t=3.4,P=0.003)。
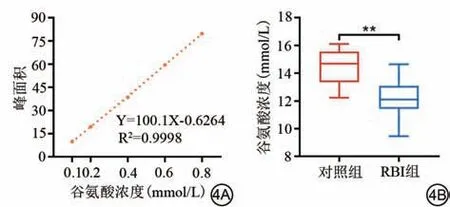
图4 各组样品的HPLC 分析结果。**:P<0.01。4A:谷氨酸样品的标准曲线;4B:两组大鼠的谷氨酸浓度差异。RBI:放射性脑损伤;HPLC:高效液相色谱仪。Fig.4 Results of HPLC analysis for each group of samples.**: P<0.01.4A: Standard curve for glutamic acid samples; 4B: Difference in glutamate concentration between two groups of rats.RBI: radiation-induced brain injury; HPLC: high-performance liquid chromatography.
2.5 谷氨酸水平与空间记忆呈正相关
为了检验辐射诱导的空间记忆效应与CEST 和HPLC检测的谷氨酸水平之间的关系,使用Pearson分析了Morris 水迷宫指标和谷氨酸水平之间的相关性。HPLC 分析揭示的谷氨酸浓度和GluCEST 水平之间显示了一致的正相关性(r=0.71,P=0.001,图5A)。该分析揭示了空间探索期大鼠在目标象限中停留路程与海马GluCEST正相关性(r=0.50,P=0.034,图5B)。
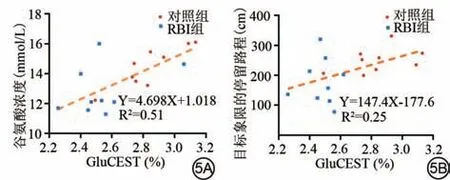
图5 空间记忆与谷氨酸水平呈正相关。5A:海马GluCEST 与HPLC测定的谷氨酸浓度之间的相关性;5B:海马GluCEST 与两组大鼠在目标象限的停留路程之间的相关性。RBI:放射性脑损伤;GluCEST:谷氨酸化学交换饱和转移。Fig.5 Spatial memory is positively correlated with glutamate.5A:Correlation between hippocampal GluCEST and glutamate concentration measured by HPLC; 5B: Correlation between hippocampal GluCEST and distance travelled to stay in the target quadrant for two groups of rats.RBI:radiation-induced brain injury; GluCEST: glutamate chemical exchange saturation transfer.
3 讨论
本研究应用GluCEST 成像技术研究RBI 大鼠的体内海马谷氨酸水平变化。结果发现,相较于对照组,RBI组大鼠空间记忆受损时,海马GluCEST信号显著降低,HPLC 实验也验证了GluCEST 信号的稳定性。本研究首次提出了GluCEST 可以用于评估RBI,使用具有高空间分辨率的GluCEST成像能够准确识别RBI损伤,获得CEST 代谢信息将有助于在RT 时尽早了解潜在RBI 损伤神经化学物质的病理生理变化和采取预防性措施保护脑功能,这可能为临床拓展了评估RBI及其认知功能障碍的潜在新方法。
3.1 构建RBI大鼠模型
在本研究中,定期观察两组大鼠的一般情况包括体质量、摄食、饮水等,结果发现RBI 大鼠在照射1 周后逐渐出现食欲缺乏、体形消瘦、体质量明显降低,这可能是因为射线导致的急性期口腔和咽部黏膜炎症以及唾液腺受损[27]使RBI 大鼠遭受吞咽困难。Morris 水迷宫实验中,相比于对照组,RBI 大鼠在定位航行实验中的总路程和游泳速度没有显著差异,表明大鼠的短期空间学习能力受损较轻,但RBI大鼠空间探索期在目标象限停留路程和穿越原平台次数降低,提示RBI 组大鼠的空间记忆保持能力受损,这与先前的研究报道基本一致[13,28-29]。总之,本研究成功构建单次30 Gy全脑照射RBI大鼠模型。
3.2 RBI大鼠GluCEST改变
RT 的主要目的是对肿瘤组织进行最大程度的杀伤,先前研究[30]中主要使用GluCEST 评估脑胶质瘤、脑转移瘤和脑膜瘤等脑肿瘤代谢信息,更准确了解肿瘤侵袭范围和为临床治疗提供参考。此外,常规MRI 通常很难区分放射性坏死与肿瘤进展,MEHRABIAN 等[31]发现CEST 定量分析能够提高脑转移瘤和放射性脑坏死区别。RT 过程中不可避免导致RBI 及其认知功能障碍,但如何采取有效技术手段进行监测仍是一个难题,有研究发现RBI诱导认知障碍可能与谷氨酸有关,先前RBI谷氨酸变化的无创研究更多采用的是1H-MRS。BROWN 等[32]注意到,与对照组相比,通过1H-MRS 评估发现亚急性期和晚期辐照幼鼠的海马谷氨酸浓度降低。BÁLENTOVÁ 等[33]的研究表明,不同剂量条件下通过1H-MRS 测量的海马谷氨酸和γ-氨基丁酸在全脑照射大鼠显示出降低的趋势。然而,1H-MRS 采用比率进行半定量分析,结果准确性差,而CEST敏感度较高,是1H-MRS测量代谢物浓度的102~104放大倍数[34],所以本研究获得结果可能更可靠。因此,在RT时,CEST MRI不仅有可能监测肿瘤组织的代谢信息,而且还可能用于评估RBI诱导认知功能障碍。
辐射诱导认知功能障碍机制尚未阐明,有研究[14]表明可能与海马神经元树突棘密度和形态的改变有关。具体原因可能如下,树突棘是突触接触和兴奋性突触传递的场所,树突棘的形态生理学被认为是认知特定组成部分的基础,突触强度的变化是学习与记忆的主要基础[2]。辐射后异常谷氨酸和NMDA 受体介导树突棘的结构改变,大脑兴奋性突触从某一时间点从急性增加转化为兴奋性突触丧失[13]。海马谷氨酸的兴奋性毒性导致神经元细胞死亡或凋亡[14],突触丢失和认知障碍[13],谷氨酸的浓度趋于降低。当然,其他RBI研究表明大脑颞叶和额叶等皮层属于放射敏感区域[7],下一步应对这些脑区谷氨酸神经元进行研究,这也是GluCEST优于DTI之处。
3.3 海马谷氨酸水平与空间记忆相关性分析
GluCEST 利用水的信号间接测量谷氨酸的变化,易受某些混杂因素影响,包括呼吸、B0 场的不均匀性等[21],而HPLC 也能够分析谷氨酸等代谢物的变化,具有重复性好、敏感度和精确度高等优势[26]。本研究采用HPLC 测量海马谷氨酸浓度辅助验证,与对照组相比,RBI组大鼠海马谷氨酸含量降低,与海马GluCEST结果一致,这说明GluCEST可以检测大鼠大脑中谷氨酸的局部差异。实验中HPLC测量的谷氨酸浓度与海马GluCEST 信号显示出了正相关,证明了GluCEST 信号的稳定性。海马GluCEST 和两组大鼠在目标象限停留路程之间显示出正相关,进一步表明谷氨酸可能与RBI诱导认知障碍有关。
3.4 不足与展望
本研究存在一些局限性。首先,3.0 ppm处CEST信号是重叠的[35],主要是谷氨酸(70%~75%),还有肌酸、γ-氨基丁酸和其他大分子(25%~30%),尽管后者对观察到的GluCEST信号的贡献低,但是很难完全排除对观察到的信号的影响。其次,由于技术的限制,CEST图像只能采集单层和手动勾画ROI,不能捕捉到所有脑区的变化,随着3D GluCEST成像和自动分割技术的发展[36],这个问题在未来有望得到解决。最后,CEST对磁场(B0和B1)不均匀性敏感[37],存在核奥氏效应,直接水饱和度、半固态非特异性磁化转移,这可能会影响了本实验结果准确性。磁共振引导RT是目前放疗领域的未来,研究表明,CEST MRI 已经可以在MR-Linac[38]检测肿瘤对放疗的反应[39-40]。随着CEST技术不断完善,GluCEST 成像不但可以评估肿瘤组织的自适应放疗,也可以用来实时监测放疗期间危及器官的辐射反应,在未来的研究中被用来融入RT计划。
4 结论
综上所述,本研究证明了GluCEST 成像在RBI 大鼠模型的临床前应用价值,用于检测和量化大脑中的代谢变化。GluCEST是非侵入性监测和理解RBI认知障碍的敏感方法,其可能是诊断和预后RT 中认知损伤的有用生物标志物。
作者利益冲突声明:全体作者均声明无利益冲突。
作者贡献声明:王旭设计了本研究的方案,对稿件重要内容进行了修改,获得了国家自然科学基金项目(编号:81771828)的资助;李国栋和刘岩起草和撰写稿件,获取、分析本研究的数据,刘岩获得了国家自然科学基金项目(编号:11805247)的资助;李昊、刘彩云、李祥林、李青龙、翁娜、宾莉和黄丹琪获取和解释了本研究的数据,对稿件重要内容进行了修改。全体作者都同意发表最后的修改稿,同意对本研究的所有方面负责,确保本研究的准确性和诚信。
