高海拔地区轻度认知障碍患者脑结构改变的分析
2024-01-04刘金昊祁永红杨国财
刘金昊,祁永红,杨国财
作者单位:青海省人民医院磁共振室,西宁 810007
0 前言
轻度认知障碍(mild cognitive impairment, MCI)被认为是正常衰老和阿尔茨海默病(Alzheimer's disease, AD)的过渡阶段,目前虽无特效治疗药物,但早期干预能延缓甚至阻止其进展。高海拔低氧环境对认知功能如短时记忆力、注意广度、思维判断能力等方面产生损害作用[1]。由于人类大脑高度回旋折叠,在认知障碍发病的早期阶段,常规MRI 上通常看不出明显的结构改变[2-3],当临床上应用常规MRI检查发现脑萎缩时,患者大多数都已进展到痴呆的中、晚期阶段[4-5],长期处于高海拔低压低氧环境会引发人体一系列的病理变化,可导致过度灌注和血管性水肿,从而引起血脑屏障的损伤,生活在海拔4000 多米的个体中出现脑自动调节损伤,最终导致脑结构的累积性变化[3,6],甚至引起认知功能改变[7]。结构磁共振成像(structural magnetic resonance imaging, sMRI)可为检测MCI 提供可靠的脑成像特征[5]。既往有研究对颅内总体积进行标准化后灰质(gray matter, GM)密度与GM 体积改变相一致,GM 密度降低提示脑组织神经元的减少和退化[8-9],先前有学者对MCI 患者的脑结构进行了研究,但未见针对高海拔地区MCI 脑结构的报道,本文分析了高海拔地区MCI 患者与健康对照(healthy controls, HC)者的脑结构差异,旨在为进一步求证高海拔低氧环境脑自动调节甚至脑结构改变提供影像学证据,指导临床医师早期认识低氧脑损伤的关键脑区。
1 材料与方法
1.1 研究对象
2020年10月至2021年11月,前瞻性纳入世居高海拔地区的MCI患者91例(MCI组)、HC 95例(HC组)。所有入组者均在青海省人民医院行头颅MRI检查。
MCI 诊断标准:(1)存在一个或多个认知功能域损害的客观证据;(2)复杂的工具性日常能力可以有轻微损害,但保持独立的日常生活能力;(3)尚未达到痴呆,且MCI 组简易精神状态(Mini-Mental State Examination, MMSE)量表评分为20~26分,蒙特利尔认知评估(Montreal Cognitive Assessment, MoCA)量表评分<26 分。MCI 组纳入标准:(1)世居高海拔地区(3700~4300 米);(2)符合MCI 诊断标准。排除标准:(1)存在神经系统疾病,如肿瘤、畸形、卒中等;(2)有药物滥用史;(3)酗酒者;(4)服用了影响认知功能的药物;(5)扫描图像或临床信息不完整。
HC 组纳入标准:(1)世居高海拔地区(3700~4300 米);(2)无认知功能障碍的临床表现;(3)无日常生活能力受损表现;(4)MMSE评分>27分。排除标准:(1)有头部外伤史;(2)酒精成瘾者;(3)慢性失眠者;(4)扫描图像或临床信息不完整。
本研究遵守《赫尔辛基宣言》,经过青海省人民医院医学伦理委员会批准,批准文号:2020-113,受试者均签署了知情同意书。
1.2 神经心理学量表
所有入组对象均由同一神经内科医生进行神经心理学测试,包括MMSE、MoCA评分。
1.3 MR仪器及检查方法
应用德国西门子3.0 T Skyra 磁共振仪对入组者行头颅检查,利用T1WI、T2WI、T2 液体衰减反转恢复(T2 fluid attenuated inversion recovery,T2-FLAIR)序列除外神经系统疾病如肿瘤、畸形、卒中等,其参数如下:T1WI(TR 2000 ms,TE 20.0 ms)、T2WI(TR 4300 ms,TE 105.9 ms)、T2-FLAIR(TR 8502 ms,TE 158.1 ms),FOV 240 mm×240 mm,层厚5 mm,层间隔1.5 mm。sMRI 扫描采用3D T1WI-MP RAGE 序列,扫描参数如下:TR 1900 ms,TE 2.43 ms,TI 900 ms,FOV 256 mm×256 mm,层厚1 mm,翻转角9°,体素大小1 mm×1 mm×1 mm。
1.4 图像后处理与分析
使用基于Matlab (R2019b)的SPM 12(https://www.fil.ion.ucl.ac.uk/)中的计算解剖工具箱(CAT12,http://dbm.neuro.uni-jena.de/cat12/)对3D-T1 加权图像进行预处理,将T1 图像空间配准到组织概率图(tissue probability maps, TPM),将其分割为GM、白质和脑脊液,对图像进行配置,然后进行空间标准化;使用8 mm 的高斯核对GM 图像进行平滑处理。使用自动解剖标记图谱116 模板将皮层划分为116个脑区,得到每个脑区的GM密度。
1.5 统计学分析
采用SPSS 17.0 统计分析软件进行人口学数据的统计学处理,将两组的年龄、MMSE评分及MoCA评分进行两独立样本t检验,以P<0.05 为差异有统计学意义。得到116 个脑区的GM 密度后,对MCI 组和HC组的GM 密度进行双样本t检验,得出差异具有统计学意义的脑区。
2 结果
2.1 MCI组和HC组基本信息
MCI 组和HC 组受试者年龄均≥50 岁、受教育年限均≥6 年、右利手。MCI 组91 例,年龄(64.0±6.7)岁,HC 组95 例,年龄(61.7±7.2)岁。MCI 组和HC 组的MMSE、MoCA 评分测试差异有统计学意义(P均<0.05),见表1。
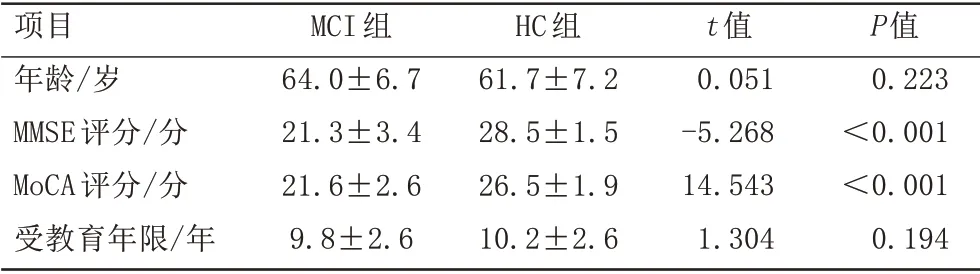
表1 MCI组和HC组基本信息Tab.1 Demographic data of MCI patients and HC
2.2 MCI组与HC组不同脑区GM密度的比较
比较MCI 组和HC 组的116 个 脑 区GM 密度,得到GM 密度存在显著差异的脑区(表2),显示MCI 组的左侧海马(图1A)、左侧海马旁回(图1B)、左侧梭状回(图1C)、左侧小脑(图1D)、右侧小脑(图1E)的GM 密度明显低于HC组(P<0.05,Bonferroni校正)。
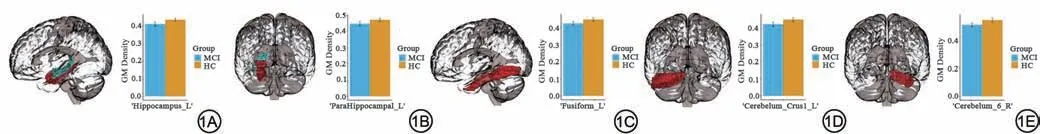
图1 MCI组与HC组脑区GM密度分析(蓝色柱状图为MCI,黄色柱状图为HC)。MCI:轻度认知障碍;HC:健康对照;GM:灰质。Fig.1 Analysis of GM density in the brain of MCI patients and HC group (blue bar chart is MCI, yellow bar chart is HC).MCI: mild cognitive impairment; HC:healthy controls; GM: grey matter.
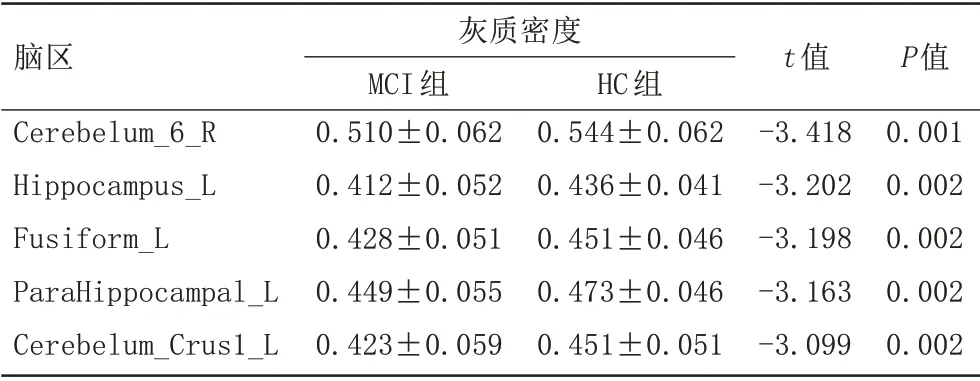
表2 MCI组与HC组不同脑区灰质密度的比较Tab.2 Comparison of gray matter density in different brain regions between MCI and HC group
3 讨论
本研究应用sMRI对高海拔地区MCI患者和HC的脑结构进行研究,分析MCI 与HC 的脑结构差异,结果发现MCI组的左侧海马、左侧海马旁回、左侧梭状回、左侧小脑、右侧小脑的GM 密度明显低于HC 组,首次发现高海拔地区MCI患者的脑结构改变,为进一步求证高海拔低氧环境脑自动调节甚至脑结构改变提供了影像学证据。
3.1 高海拔地区MCI患者海马和海马旁回的改变
本研究发现高海拔地区(3700~4300 米)MCI 患者左侧海马和海马旁回GM 密度较HC 组明显减低。海马是学习和记忆功能的关键脑区,还参与情绪反应、情绪控制,记忆力与海马的相关性最强,特别是对长期记忆的形成至关重要[10-11],海马旁回接收来自下颞叶皮质的传入纤维,在记忆的编码和提取中有重要的作用,参与空间记忆过程[12-13],可见海马和海马旁是内侧颞叶记忆系统的重要组成部分[12,14-15]。本研究发现高海拔地区(3700~4300 米)MCI 患者左侧海马和海马旁回GM 密度较HC 组明显减低,与之前的sMRI研究中发现与HC相比MCI患者中海马和海马旁回GM 体积减小[14,16-18]相一致。VALDÉS HERNÁNDEZ等[12]的研究也表明MCI 患者和HC 组的GM 体积在海马和海马旁回之间存在显著差异。SHU 等[19]对遗忘型MCI 患者的研究显示双侧颞极和左海马、海马旁回的GM体积较HC组减小。基于体素的形态学分析中显示MCI 的额中回和颞回及双侧海马和海马旁回和HC 组之间存在很大的总体差异[20-21]。JI 等[22]研究发现,在海拔4300米,SD大鼠海马和脑皮层的神经元损伤、细胞凋亡增加、Caspase-3 蛋白异常表达、氧化应激和自由基显著增加导致认知功能障碍,而在中等海拔(2260 米)环境中没有观察到认知功能的改变,与处在海拔450米的大鼠相比,神经元凋亡和相关蛋白表达差异无统计学意义,为神经元在缺氧诱导下发生退化导致认知功能损伤提供了证据。一项关于高原缺氧的动物实验显示暴露于高海拔缺氧地区的大鼠空间记忆功能受损,多模态MRI分析显示大鼠海马区域GM 体积减小,海马的脑结构与大鼠的行为改变有关[23]。
3.2 高海拔MCI患者梭状回的改变
本研究发现高海拔地区MCI 患者左侧梭状回GM密度较HC明显降低。梭状回是参与高级视觉加工的脑区,如面孔感知、肢体识别、物体识别、文字识别和视觉语言感知等,左侧梭状回主要负责对熟悉的人的面孔识别,右侧海马、右侧楔前叶与左侧梭状回存在着显著的功能连接[24-25]。在SUN 等[26]的研究中,左侧梭状回、颞中回、内嗅皮层的平均皮质厚度值从正常对照-单个认知领域损害-多个认知领域损害-AD呈下降趋势。一项功能研究表明MCI 组左梭状回的脑信号复杂度规律性降低[27]。一项关于世居高海拔居民与平原地区居民的脑血管反应性差异比较显示二者间左侧梭状回存在显著差异[28],间接验证了梭状回是高海拔缺氧相关脑结构改变的关键脑区。
3.3 高海拔MCI患者小脑的改变
本研究显示MCI患者较HC组脑GM密度差异的脑区主要位于左侧半球。一直以来小脑被认为是一个协调完成运动功能的重要结构,而越来越多的研究表明小脑不仅对运动性学习和运动记忆具有十分重要的意义[29-31],而且小脑与其他参与认知功能至关重要的大脑网络有紧密连接[32-33],如前额叶皮层和杏仁核[21]。有研究表明小脑与运动和感觉皮质以及前额叶和顶叶皮质有功能连接,提高了认知功能[33]。也有研究表明与HC 组相比,MCI 患者小脑后部Ⅰ、Ⅱ区体积减小,小脑前部体积也减小[21]。一项基于体素的MRI分析显示,MCI进展组的双侧小脑皮层、右颞叶皮层和双侧岛叶皮层的GM 体积减小[22]。遗忘型MCI 转化为痴呆组在小脑Ⅰ/Ⅱ和蚓部(Ⅳ和Ⅶb)中出现了显著的双侧GM体积丢失的现象[21]。在MCI状态下,小脑GM体积和认知功能测试显示出直接关联[29]。有研究发现,在调整了年龄、性别、受教育程度、海马体积和APOE4 状态之后,MCI 患者的小脑体积与认知能力有关,表明小脑网络可能会调节疾病早期的认知功能[33],组织病理学研究表明AD患者小脑可能发生神经退行性和神经病理变化,包括小脑皮质内淀粉样斑块沉积、浦肯野细胞密度损失、分子和颗粒细胞层萎缩[34]。
本研究显示MCI组较HC组脑GM密度差异的脑区主要位于左侧半球。此外,MCI 组和HC 组间GM 密度比较显示左侧半球的脑区比右侧半球差异更显著,这表明左侧半球可能更容易受到MCI的损伤[35-36]。另外一项关于高海拔地区认知和脑影像的研究表明由于两侧半球存在血供的差异,左侧半球比右侧半球更容易发生缺氧和梗死以及对慢性高海拔缺氧更敏感[37]。
一项神经病理学研究表明MCI 在额叶、顶叶、颞叶、海马和内嗅区的神经炎斑块和神经纤维缠结增加[38],支持MCI 的神经病理学改变与脑结构改变的部位存在重叠。研究表明高海拔暴露不仅影响GM 结构,还会影响脑内的功能连接、脑区间的功能整合,这应该是MCI患者认知能力受损的基础。
3.4 本研究的不足及展望
本研究仅对高海拔MCI 组和HC 组进行脑结构的研究,但未对高海拔地区与平原地区MCI患者脑结构进行对比分析,下一步我们将对这一方面进行研究。
4 结论
高海拔地区MCI患者具有脑结构上的退化特征,这可能是引起慢性高海拔暴露相关的认知功能改变的基础。
作者利益冲突声明:全体作者均声明无利益冲突。
作者贡献声明:杨国财设计本研究的方案,对稿件重要的智力内容进行了修改;刘金昊起草和撰写稿件,获取、分析或解释本研究的数据,获得了青海省卫生健康委员会指导性计划课题的资助;祁永红获取、分析或解释本研究的数据,对稿件重要内容进行了修改;全体作者都同意发表最后的修改稿,同意对本研究的所有方面负责,确保本研究的准确性和诚信。
