特发性肉芽肿性乳腺炎磁共振乳腺水肿表现及相关因素分析
2024-01-04赵秋枫李琼王嵩晁慧美孟畑
赵秋枫,李琼,王嵩*,晁慧美,孟畑
作者单位:1.上海中医药大学附属龙华医院放射科,上海 200032;2.上海中医药大学附属龙华医院中医乳腺科,上海 200032
0 前言
乳腺磁共振具有高软组织分辨率、多方位及多功能成像的特点,在乳腺疾病的诊断和治疗中有重要价值,对乳腺疾病的诊断敏感性较高,而特异性中等[1]。T2WI 所显示的乳腺水肿有助于提升乳腺磁共振的诊断特异性[2-4]。近年来,研究发现T2WI 所显示的乳腺水肿在良恶性鉴别、乳腺癌分子分型及临床病理预后因子相关性、预测腋窝淋巴结转移及新辅助化疗疗效等方面均有重要作用[5-8]。然而,对T2WI 所显示的乳腺水肿在乳腺炎性病变中价值的研究却少有报道,主要集中在与恶性病变的鉴别诊断,多认为胸大肌前方水肿在乳腺炎性病变中罕见[3,9]。特发性肉芽肿性乳腺炎(idiopathic granulomatous mastitis, IGM),又称特发性肉芽肿性小叶炎,是以乳腺小叶为中心的伴有非坏死性肉芽肿形成的非特异性乳腺炎症,近年来发病率逐年上升,受到越来越多的关注。IGM 的乳腺磁共振表现与常见的乳腺炎有所不同,并与乳腺恶性病变表现有部分重叠[10-11]。而对于IGM乳腺水肿的报道仅见少量小样本研究,最多的一组仅39 例[12],且对乳腺水肿的阐述仅于磁共振伴随征象中简要列出,并未见对水肿程度的详细描述,乳腺水肿的发生率报道不一,约为25%~100%[13-15]。较小的样本量可能是导致前期研究中乳腺水肿发生率差异较大的重要原因之一。本研究旨在通过对较大样本的IGM乳腺磁共振影像分析,探讨IGM患者T2WI图像上乳腺水肿的表现情况,并初步探索与其发生及程度相关的临床及影像学因素,为全面认识IGM提供更多的信息。
1 材料与方法
1.1 临床资料
回顾性分析2021 年1 月至2022 年12 月我院收治的IGM 病例。纳入标准:(1)经穿刺活检或手术病理证实为IGM;(2)穿刺或手术前行乳腺磁共振增强检查;(3)于乳腺磁共振检查两周内行血清催乳素(prolactin, PRL)及血管内皮生长因子(vascular endothelial growth factor, VEGF)检测。排除标准:(1)磁共振图像质量不佳;(2)磁共振检查前一月内有乳腺穿刺或局部手术史;(3)有同侧乳腺癌病史或胸部放疗史。本研究遵守《赫尔辛基宣言》,经上海中医药大学附属龙华医院伦理委员会批准,免除受试者知情同意,批准文号:2023LCSY021号。
1.2 仪器与方法
所有患者均行双乳磁共振检查,使用德国SIEMENS 公司ARAR 1.5 T 磁共振扫描仪,18 通道乳腺专用线圈。患者取俯卧位,腹部垫高,乳房自然下垂。扫描范围从乳房下界起始,向上至腋窝,包括双侧乳房。平扫采用横断位T1WI、短时间反转恢复(short time inversion recovery, STIR)T2WI及磁共振扩散加权成像,扫描参数:三维快速小角度激发成像序列:TR 12 ms,TE 4 ms,层厚1.5 mm,层间距0.3 mm,矩阵384×384,FOV 36 cm×36 cm,翻转角20°,扫描时长1 min 26 s;短时间反转恢复T2WI 序列:TR 7200 ms,TE 85 ms,TI 150 ms,层厚3 mm,层间距0.6 mm,矩阵384×384,FOV 36 cm×36 cm,翻转角170°,扫描时长3 min 22 s;自旋回波平面回波弥散加权成像:TR 6000 ms,TE 78 ms,b=0、800 s/mm2,层厚3 mm,矩阵128×128,FOV 36 cm×36 cm,扫描时长3 min 2 s。动态增强使用三维容积式内插值法屏气检查序列:TR 12 ms,TE 4 ms,层厚1.5 mm,层间距0.3 mm,矩阵 384×384,FOV 42 cm×42 cm,包括增强前蒙片及5期动态增强,于对比剂注射后15 s开始扫描,扫描时长6 min 15 s。高压注射器经肘静脉注射钆喷酸葡胺,剂量为0.1 mmol/kg体质量,注射速率3 mL/s,其后以相同速率注入30 mL生理盐水。
1.3 图像分析
由两位分别具有9 年(阅片者1)、6 年(阅片者2)阅片经验的主治医师共同阅片。STIR T2WI 图像上片状水样高信号定义为乳腺水肿,并进行乳腺水肿评分(breast edema score, BES)[5-6]。BES 1 分:无乳腺水肿,病灶周围无任何STIR T2WI 高信号影;BES 2 分,病灶周围水肿,病灶周围线状或局限分布的STIR T2WI 类似水样或稍低于水样信号影;BES 3分,胸大肌前方水肿,STIR T2WI条带状水样高信号延伸至胸大肌前方;BES 4 分,皮下水肿,STIR T2WI皮肤及皮下明显、广泛的高信号伴皮肤增厚,非局限于病灶所累及的皮肤周围。为进一步简化和便于临床应用,将BES 1 分及2 分合并为无或轻度乳腺水肿,即无胸大肌前方水肿;将BES 3 分及4 分合并为中度至重度水肿,即伴有胸大肌前方水肿[6]。病灶累及乳腺的不同深度,按磁共振乳腺厚度由浅入深三等分,分为前带、中带、后带。病灶范围测量使用动态增强剪影图像最大密度投影图,测量连续性病灶累及范围的最长径,多发病灶测量各连续性病灶累及长径之和,由一名医师(阅片者2)完成测量,不同时间测量3 次,取平均值。腋窝淋巴结短径超过1 cm,且淋巴门消失,判定为腋窝淋巴结肿大[16]。
1.4 统计学分析
采用SPSS 25.0软件进行统计学分析,乳腺水肿组与无乳腺水肿组、无或轻度乳腺水肿组与中重度乳腺水肿组间各临床及影像学因素的差异比较采用χ2检验及t检验。对于有统计学意义的变量,使用多元logistic 回归行多因素分析,探寻与乳腺水肿及水肿程度相关的临床及影像学因素。P<0.05 为差异具有统计学意义。
2 结果
2.1 患者基本情况
本研究纳入IGM 患者共129 例,均为女性,年龄22~52(31.6±4.7)岁,绝经前127 例,绝经后2 例。129 例患者中,124 例累及单侧乳腺,5 例累及双侧乳腺,共139个乳腺。发病至行乳腺磁共振检查间隔时间0.5~24(3.8±3.7)个月。其中,病程≤2 个月的共53个患乳,2月以上的86个患乳。
2.2 乳腺水肿在IGM中的表现
139个患乳中,127个(91.4%)呈现乳腺水肿,12个(8.6%)无乳腺水肿(BES 1分),15个(10.8%)表现为病灶周围水肿(BES 2分),68个(48.9%)表现为胸大肌前方水肿(BES 3 分),44 个(31.7%)表现为皮下水肿(BES 4分)(图1、图2)。27个患乳(19.4%)表现为无或轻度水肿(无胸大肌前方水肿),112个患乳(80.6%)表现为中重度水肿(伴有胸大肌前方水肿)。
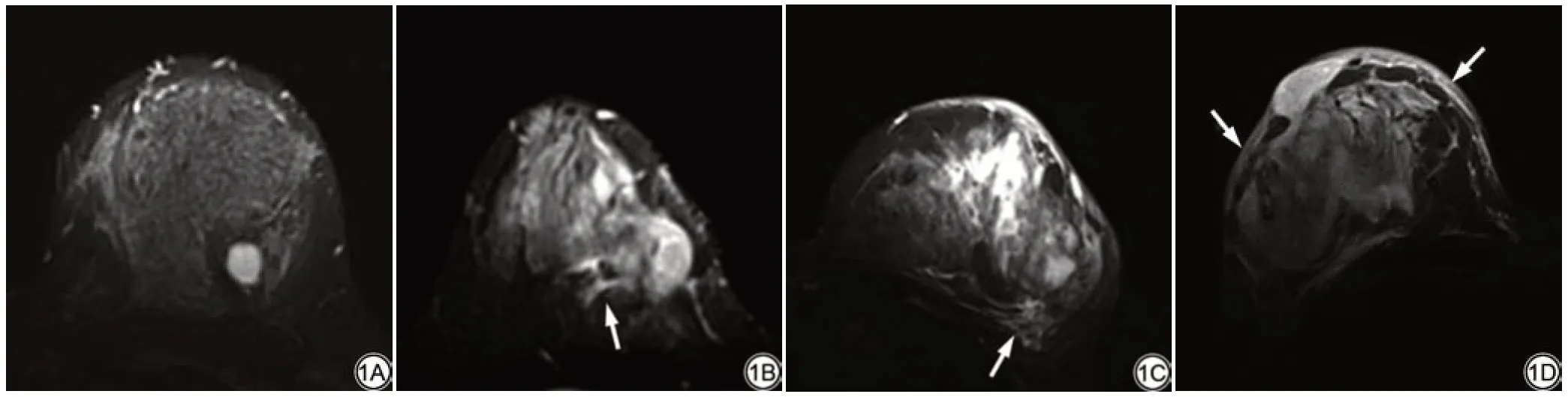
图1 磁共振乳腺水肿表现评分(BES)。1A:BES 1分,无水肿;1B:BES 2分,病灶周围水肿(箭);1C:BES 3分,胸大肌前方水肿(箭);1D:BES 4分,皮下水肿(箭)。Fig.1 Breast edema score (BES) on magnetic resonance images.1A: BES 1, no edema; 1B: BES 2, perilesional edema (arrow); 1C: BES 3, prepectoral edema(arrow); 1D: BES 4, subcutaneous edema (arrow).
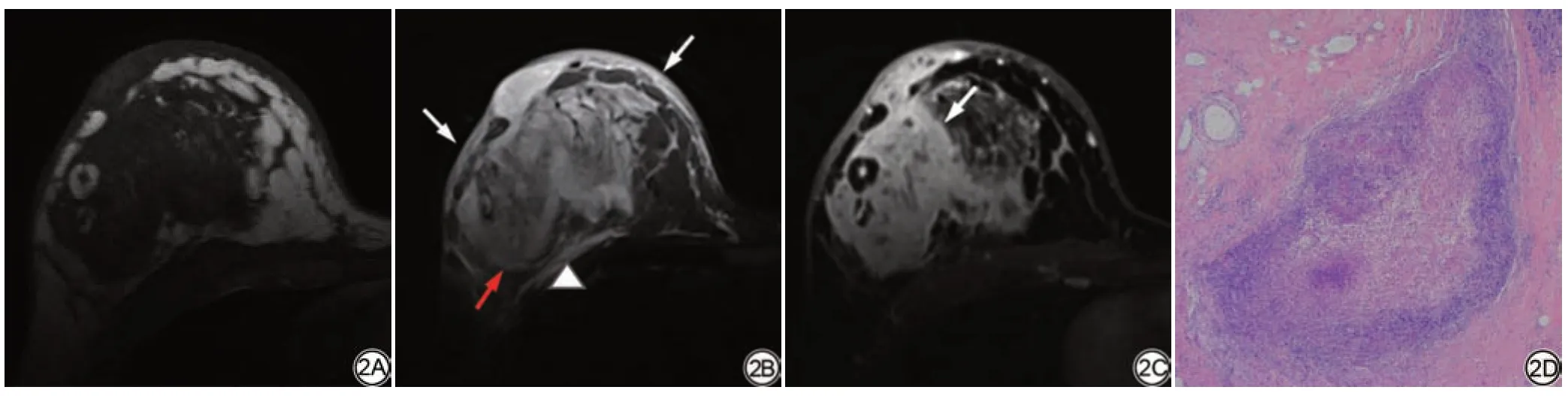
图2 女,32岁,右乳肿痛结块2月余。右乳外上象限区域分布非肿块强化灶,T1WI等稍低信号(2A);STIR T2WI等稍高信号(2B),病灶周围(红箭)、胸大肌前方(三角形)及皮下可见片状水样高信号(白箭),BES 4 分;增强后不均匀强化(2C)(箭)。手术病理40 倍HE 染色显示以小叶为中心的非干酪性肉芽肿(2D)。STIR:短时间反转恢复;BES:乳腺水肿评分;HE染色:苏木精-伊红染色。Fig.2 A 32-year-old woman with right breast tender with 1 mass for over 2 months.There's a regional non-mass enhancement lesion at right outer upper quadrant,with iso-to-hypointensity on T1WI (2A), and iso-to-hyperintensity on STIR T2WI (2B) and heterogeneous enhancement (2C) (white arrow).Patchy of water-like high signal intensity on STIR T2WI (2B) are noted at perilesional (red arrow), prepectoral (triangle) and subcutaneous regions (arrow).Non- caseating chronic granulomatous inflammation in a lobulocentric distribution is noted at HE staining (×40) of surgical pathology (2D).BES 4 is classified.STIR: short time inversion recovery; BES: breast edema score; HE staining: hematoxylin-eosin staining.
2.3 临床及影像学特征与磁共振乳腺水肿表现的相关分析
单因素分析显示:血PRL及VEGF水平、乳晕后累及与否、病灶累及象限数及乳腺深度、病灶的范围在乳腺水肿组与无乳腺水肿组间差异有统计学意义(P<0.05)。多因素logistic 回归显示病灶范围是乳腺水肿的独立风险因素[P=0.003,OR=1.091,95% 置信区间(confidence interval,CI):1.035~1.150](表1)。

表1 临床及影像学特征与磁共振乳腺水肿表现的相关分析Tab.1 Correlation analysis of clinical and imaging features with MRI findings of breast edema
2.4 临床及影像学特征与磁共振乳腺水肿表现程度的相关分析
单因素分析显示:病程、血PRL 及VEGF 水平、乳晕后累及与否、病灶累及象限数及乳腺深度、淋巴结肿大与否及病灶的范围在无或轻度水肿组与中重度水肿组间(即无胸大肌前方水肿组与伴有胸大肌前方水肿组间)差异有统计学意义(P<0.05)。多因素logistic 回 归 显 示 血PRL(OR=22.807,95%CI:2.281~228.008)、血VEGF(OR=24.140,95%CI:2.937~198.409)及病灶范围(OR=1.102,95%CI:1.035~1.174)是中重度乳腺水肿(即伴有胸大肌前方水肿)的独立风险因素(P<0.05)(表2)。
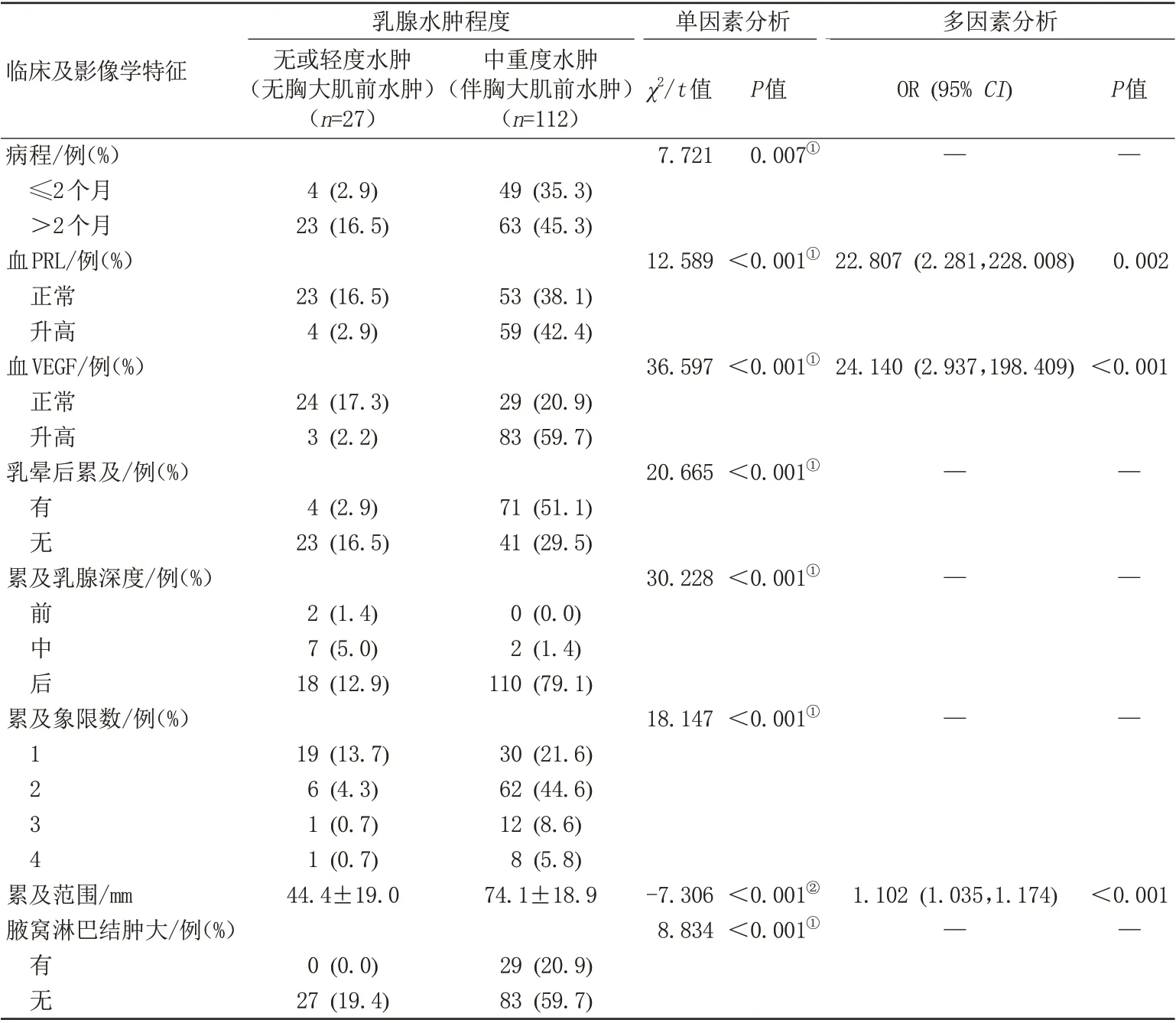
表2 临床及影像学特征与磁共振乳腺水肿表现程度的相关分析Tab.2 Correlation analysis of clinical and imaging features with the degree of breast edema on MRI
3 讨论
本文通过对139 例IGM 的磁共振STIR T2WI 图像表现的乳腺水肿及相关临床、影像学因素研究,分析了IGM各类磁共振乳腺水肿表现的发生率及乳腺水肿的相关因素,结果显示STIR T2WI乳腺水肿在IGM中的发生率较高,病灶范围是乳腺水肿的独立风险因素,血PRL、血VEGF及病灶范围是中重度乳腺水肿(即伴有胸大肌前方水肿)的独立风险因素。本研究是迄今为止最大样本量的IGM磁共振乳腺水肿表现的研究,有助于全面认识IGM的乳腺磁共振表现及乳腺水肿发生的可能原因。
3.1 胸大肌前方水肿在IGM中的发生
以往的观点认为病灶周围及胸大肌前方水肿是乳腺癌的特异性征象,胸大肌前方水肿在乳腺炎中罕见[3,9]。YASUMURA 等[17]对一组38 例乳腺炎性病变的研究中发现,乳腺磁共振均未见胸大肌前方水肿。RENZ 等[18]对48 例炎性乳癌和42 例急性乳腺炎的研究发现,胸大肌前水肿(66.7%/33.3%)及胸大肌肌间水肿(41.7%/7.1%)更常见于炎性乳癌中,认为可能与急性乳腺炎多发生在乳晕后而炎性乳癌多位于乳腺中部及背侧有关。本组中,胸大肌前方水肿的发生率(BES 3 分及4 分)高达80.6%,结果与以往对乳腺炎的研究有所不同。究其原因,我们认为,与常见的哺乳期乳腺炎不同,IGM 的病变是以乳腺小叶为中心,多发生在乳腺外周[19]。本组中有92.1%的患乳中病灶累及乳腺后带,位置较深,可能是较高的胸大肌前方水肿发生率的原因之一。此外,本研究发生胸大肌前方水肿的患乳,病灶范围较广,可能也是较高的胸大肌前方水肿发生率的原因之一。
3.2 IGM中磁共振乳腺水肿表现的相关因素
本组研究发现,病灶范围是IGM磁共振乳腺水肿表现及中重度水肿表现(即伴有胸大肌前方水肿)的独立风险因素。以往对乳腺癌的研究[20]中发现,相较于2 cm以下(T1期)肿瘤,大于2 cm(T2、T3期)肿瘤的乳腺水肿发生概率是其2倍(P<0.001)。我们也认为在IGM中,病灶范围较大者更易出现磁共振乳腺水肿表现,尤其是中重度水肿(即伴有胸大肌前方水肿)。
IGM 的病因不明,部分学者认为其发病与自身免疫相关,乳导管内分泌物蓄积扩张,而后导管壁破裂,导管内分泌物导致自身免疫反应,产生慢性炎症[9,21]。高泌乳素血症可使乳导管内分泌物不断蓄积,导致自身免疫性炎症反应持续存在。研究发现,难治性肉芽肿性乳腺炎患者高泌乳素血症发生率高,高泌乳素血症可能使肉芽肿性乳腺炎的临床表现更为复杂[22-23]。本组研究显示高泌乳素血症者更易发生乳腺水肿及中重度水肿(即伴有胸大肌前方水肿)。
由各种炎症因子介导的血管壁渗出的增加是炎症导致乳腺水肿的原因,其中VEGF 作用较为关键[24]。VEGF 是一种高度特异性的促血管内皮细胞生长因子,具有促进血管通透性增加、血管内皮细胞迁移、增殖和血管形成等作用,在肿瘤、血管性病变、自身免疫性疾病及炎症等病理情况下均可出现异常表达[25-27]。VEGF通过与内皮细胞上的受体结合后,激活下游信号级联反应,形成新生血管,并可刺激内皮细胞产生基质降解蛋白酶类,降解微血管基底膜和细胞外基质,破坏血管壁的完整性,增加血管通透性,促进血浆蛋白质等大分子物质渗出,纤维素积聚,导致乳腺肿胀、水肿[28-30]。本组研究显示血VEGF升高者更易发生乳腺水肿及中重度水肿(即伴有胸大肌前方水肿)。是否病变组织中VEGF 表达异常并与乳腺水肿相关,是我们未来研究的方向之一。
3.3 不足与展望
本研究尚存在一定局限性:首先,本项回顾性研究,纳入139个患乳,而BES 1分及2分的病例数相对较少,同时,本组患者存在一定入选偏倚,多数患者的病变较为复杂、病变范围较广。未来将在更大的样本基础上进一步深入研究。其次,本研究仅局限于对IGM磁共振乳腺水肿表现的研究,未进行乳腺癌的相关比较,这也是我们下一步的研究重点之一。
4 结论
综上所述,磁共振乳腺水肿表现在IGM中发生率较高,病灶范围与磁共振乳腺水肿表现的有无相关,血催乳素、血管内皮生长因子水平及病灶范围与磁共振乳腺水肿程度表现相关。
作者利益冲突声明:全体作者均声明无利益冲突。
作者贡献声明:赵秋枫设计本研究的方案,起草与撰写稿件,获取、分析及解释本研究的数据;李琼、晁慧美、王嵩、孟畑获取、分析及解释本研究的数据,对稿件重要内容进行了修改;王嵩对最终要发表的论文进行了全面的审阅和把关;赵秋枫获得了上海中医药大学预算内项目基金资助。全体作者都同意发表最后的修改稿,同意对本研究的所有方面负责,确保本研究的准确性和诚信。
