家蝇酵母双杂交cDNA文库构建和MD14-3-3互作蛋白筛选
2024-01-03陈明明焦振龙赵文静
陈明明, 焦振龙, 赵文静, 国 果,3,*
(1. 贵州医科大学基础医学院病原生物学特色重点实验室, 贵阳 550025; 2. 贵州医科大学转化医学研究中心, 贵阳 550025;3. 贵州医科大学环境污染与疾病监控教育部重点实验室, 贵阳 550025)
家蝇Muscadomestica是一种重要的医学媒介害虫。家蝇隶属于昆虫纲(Insecta)双翅目(Diptera)蝇科(Muscidae),主要栖居在养殖场、厕所、垃圾场以腐烂食物和植物的有机质为食,携带革兰氏阴性细菌和革兰氏阳性细菌、真菌及寄生虫等多种病原体(Khamesipouretal., 2018; Nayduchetal., 2023)。因此,家蝇不仅可传播霍乱、痢疾、沙门伤寒等多种传染性疾病的病原体,还是许多食物病原体交叉感染的重要媒介(李静等, 2022)。最重要的是,家蝇虽然可传播许多病原,但本身不感染病原。因此,家蝇清除病原体的免疫应答机制成为研究热点(Gilletal., 2017; Tangetal., 2019; Zhuangetal., 2021; Jiaoetal., 2022)。
血细胞(haemocyte)是昆虫清除病原体的主要组织。昆虫因缺少获得性免疫(accquired immunity)而依赖先天性免疫(innate immunity)来防御病原入侵,其先天性免疫由细胞免疫(cellular immunity)和体液免疫(humoral immunity)组成(Siderietal., 2008; Hillyer 2016; Eleftherianosetal., 2021)。其中,细胞免疫主要包括由血细胞介导的吞噬作用(phagocytosis)、包囊反应(encapsulation)以及血细胞结节(nodulation)等是昆虫清除病原体的主要途径(Siderietal., 2008)。然而,单个蛋白调控血细胞清除病原体的分子机制尚不完整(Liegeois and Ferrandon, 2020)。
14-3-3蛋白定位于昆虫血细胞,主要参与血细胞吞噬等免疫功能(Jiaoetal., 2022)。14-3-3蛋白家族是一类在真核生物间高度保守,可与多种蛋白结合并相互作用,具有免疫调控、信号转导等功能(Obsil and Obsilova 2011; Liuetal., 2016; Yangetal., 2019)。例如,果蝇Drosophila和蚊子14-3-3ε对其抗菌肽的分泌和血细胞吞噬中起重要作用(Shandalaetal., 2011; Trujillo-Ocampoetal., 2017);家蚕Bombyxmori14-3-3蛋白可增强对病毒的敏感性(Kongetal., 2007);虾和斑马鱼的14-3-3基因在抵抗革兰氏阴性细菌和革兰氏阳性细菌感染过程中起重要作用(Wangetal., 2021);相似地,我们发现家蝇MD14-3-3蛋白可穿透细胞膜杀死大肠杆菌Escherichiacoli和金黄色葡萄球菌Staphylococcusaureus(Jiaoetal., 2022)。然而,家蝇MD14-3-3的互作蛋白尚不清楚。
酵母双杂交(yeast two-hybrid, Y2H)技术是探究蛋白互作最有效的方法。目前,该方法广泛应用于微生物、植物、线虫、昆虫和高等动物等,在筛选互作蛋白中发挥着重要作用,其原理主要通过构建初级文库、次级文库、酵母转化等形成高质量的cDNA文库,然后从文库中筛选诱饵蛋白的互作蛋白,通过回转验证即可确证互作(王冰等, 2013; 范琳芳等, 2016; 孙莉等, 2019; 赵星月等, 2020; 张博等, 2023)。本研究首先构建家蝇酵母双杂交cDNA文库,进一步从中筛选MD14-3-3的互作蛋白,为解析家蝇MD14-3-3介导免疫应答提供科学依据。
1 材料与方法
1.1 实验昆虫
感染病原体的家蝇由贵州医科大学现代病原生物学实验室饲养,饲养温度(26±1) ℃,相对湿度60%~70%,光周期10L∶14D。
1.2 总RNA的提取与mRNA分离纯化
取3龄家蝇幼虫以及家蝇成虫取血淋巴,离心收集血细胞,然后转入1.5 mL无RNase的离心管中,加入1 mL的Trizol试剂(Invirtrogen,美国),振荡混匀,室温静置10 min充分裂解,后续操作按照Trizol总RNA提取液试剂说明书。按照Oligotex mRNA Midi Kit (Invirtrogen, 美国)说明书分离纯mRNA。用紫外分光光度计NanoDrop One测量RNA质量与浓度, 1%琼脂糖凝胶电泳检测mRNA完整性。
1.3 初级文库的构建
参照CloneMiner试剂盒(Invirtrogen,美国)说明书,将分离纯化得到的mRNA 反转录合成双链cDNA。用T4 DNA聚合酶使双链cDNA平末端化。cDNA与三框attB1重组接头连接(3种接头分别各连接1份)。将连接产物全部上样于cDNA Size Fractionation Columns,按照说明书对cDNA片段进行分级分离并收集。将收集的双链cDNA通过构建BP重组反应连接至pDNOR222载体(Invirtrogen,美国)(200 ng/μL)电转化大肠杆菌DH10B感受态细胞。在冰上,将10 μL重组产物和50 μL电转感受态细胞混匀,电击后迅速向电转杯中加入SOC培养基4 mL,将电转物取入到新的1.5 mL离心管,置于37 ℃,225~250 r/min摇床培养1 h,培养结束后,获取初级文库菌液。取初级文库菌液10 μL,100倍以及1 000倍稀释,取50 μL在LB培养基上涂板(含相应抗性Kan+),24 h后计数进行库容量鉴定。
1.4 次级文库的构建
从鉴定后的初级文库中抽提质粒与pGADT7-DEST(Invirtrogen, 美国)进行LR重组反应(attL入门克隆和attR目的载体间的重组反应)获得次级文库。构建LR反应将cDNA文库(文库类型为Uncut型)质粒与pGDT7-DEST(文库载体)进行重组连接(25 ℃,16~20 h), 转入大肠杆菌DH10B感受态细胞中,获得次级文库菌液,取转化菌液10 μL,将其稀释100倍后取50 μL涂含氨苄青霉素的LB培养基平板,进行文库质量鉴定。剩余培养物按照1∶1比例(v/v)加入20%甘油, 即为次级文库菌液。从菌液中提取质粒得到次级文库质粒, 用于后续酵母双杂交共转化。其中,文库滴度(CFU/mL)=平板上的克隆数/50 μL×1 000×1×103μL,文库总容量(CFU)=文库滴度(CFU/mL)×文库菌液总体积(mL)。
1.5 库容量及重组率和插入片段长度的鉴定
获取的次级文库取100 μL,分别稀释10, 100和1 000倍进行酵母三框cDNA文库库容检测,从中取出50 μL涂布LR平板(含相应抗性氨苄青霉素),第2天计数。按照文库滴度(CFU/mL)=平板上的克隆数/50 μL×1 000×1×103μL,文库总容量(CFU)=文库滴度(CFU/mL)×文库菌液总体积(mL)。随机挑取24个单克隆进行菌落PCR鉴定,菌落PCR引物见表1,初级文库鉴定使用引物M13,次级文库鉴定使用引物pGADT7。PCR体系: 正反向引物各0.5 μL, cDNA 1 μL, Buffer 2.5 μL, dNTP Mix 0.5 μL, ddH2O 19.5 μL, Taq DNA Polymerase 0.5 μL。反应程序: 94 ℃ 5 min; 94 ℃ 30 s, 58 ℃ 30 s, 72 ℃ 2 min, 25个循环;72 ℃ 5 min, 4 ℃保存。PCR产物进行1%琼脂糖凝胶电泳检测,对其插入片段长度和重组率进行鉴定。重组率(%)=(重组成功克隆数量/克隆总数)×100。

表1 引物信息
1.6 诱饵载体自激活检测及功能验证
以家蝇cDNA第1链为模板进行PCR扩增MD14-3-3,引物序列见表1,然后将pGBKT7连接至MD14-3-3构建pGBKT7-MD14-3-3,测序验证。随后参照Coolaber试剂盒(Coolaber,北京)说明书进行自激活检测及功能验证,将5 μL的pBT3-STE-Toc159、3 μL质粒pPR3-N和10 μL热变性的Carrier DNA加入酵母感受态细胞中混匀, 再加入PEG/LiAc 500 μL混匀, 30 ℃, 水浴30 min后, 42 ℃热击15 min, 4 000×g离心40 s, 弃上清, 用100 μL ddH2O重悬菌体。取50 μL菌液涂到SD/-Trp/-Leu(SD-TL), SD/-Ade/-His/-Trp/-Leu(SD-TLHA)和LacZ(LacZ蓝白斑筛选)培养基上,30 ℃培养72 h,观察结果菌落是否产生蓝斑。相似地,以pGBKT7-53和pGADT7-T为阳性性对照,以pGBKT7-Lam和pGADT7-T为阴性对照,进行自激活检测。
1.7 MD14-3-3互作蛋白筛选
将前期成功构建的pGBKT7-MD14-3-3载体进行酵母摇菌、质粒抽提、转化Y2HGold酵母菌感受态细胞,进行平板筛选。首先,将Y2HGold酵母菌接种在YPDA平板上,取直径2~3 mm的单克隆于3 mL YPDA培养液中(30 ℃,250 r/min,16~24 h)至OD600= 0.4~0.5,离心收集菌体。用3 mL 1.1×TE/LiAc溶液重悬酵母,同时将Carrier DNA预变性两次,加NaCl(0.9%)悬浮菌体,将其10, 100和1 000倍稀释,涂布SD-TL平板计算转化效率。同时,取150 μL菌液涂布于SD/-His/-Trp/-Leu(SD-TLH)平板上,共50块。30 ℃恒温培养箱培养5 d,长出大小1~2 mm的单克隆,挑取若干培养后进行SD-TL培养基(150 μL/块,64块)、SD-TLHA/AbA培养基(150 μL/块, 2块)、SD/TLHA/X-α-Gal/ AbA培养基(150 μL/块, 2块) 平板筛选。
1.8 回转验证
将1.7节确认的阳性克隆菌株加入到5 mL的SD-Trp/Leu液体培养基中,过夜培养后采用酵母小量抽提试剂盒(天根公司)抽提酵母质粒。然后,取10 μL与Y2HGold酵母菌株转化大肠杆菌Trans T1(全世金公司)新鲜感受态。涂布二缺平板,培养3 d后观察,将其中的阳性克隆与三缺培养3 d,观测到的阳性克隆在四缺培养基点板。最后,挑取四缺单克隆培养,使用pGADT7通用引物(表1)对其进行菌液PCR, PCR体系: 正反向引物各0.5 μL, 菌液cDNA 1 μL, Buffer 2.5 μL, dNTP Mix 0.5 μL, ddH2O 19.5 μL, Taq DNA Polymerase 0.5 μL。反应程序: 94 ℃ 3 min; 94 ℃ 30 s, 56 ℃ 30 s, 72 ℃ 1 min, 36个循环; 72 ℃ 5 min,用1%琼脂糖凝胶电泳检测后,将诱饵载体pGBKT7-Lam+pGADT7-T1和pGBKT7-Lam+pGADT7-T2送生工生物工程(上海)股份有限公司进行测序,验证互作蛋白,并对测序结果blast进行基因的同源性分析。
2 结果
2.1 mRNA分离纯化
利用Trizol 法提取总RNA,经紫外分光光度计检测,纯度为2.08,表明提取到完整的RNA。分离纯化未发现18S rRNA和28S rRNA拖尾条带,且分布弥散,其主要分布在1 000 bp以上,也无杂带(图1: A),表明mRNA无污染或降解,满足建库要求。同时,合成的双链cDNA 电泳结果也呈弥散状,大小分布从100~5 000 bp(图1: B),表明其中包含了不同大小和丰度的基因,可进一步构建cDNA文库。

图1 家蝇mRNA(A)以及双链 cDNA (B)电泳检测
2.2 文库构建与鉴定
在初级文库中,检测获得1 100个阳性克隆,文库滴度为2.2×106CFU/mL,总克隆数是8.8×106CFU。随机挑取24个克隆进行菌落PCR鉴定,琼脂糖凝胶电泳显示插入文库的片段长度在500~2 000 bp之间,平均长度>1 000 bp,重组率为100%,表明多样性好,成功构建初级文库(图2: A, C)。
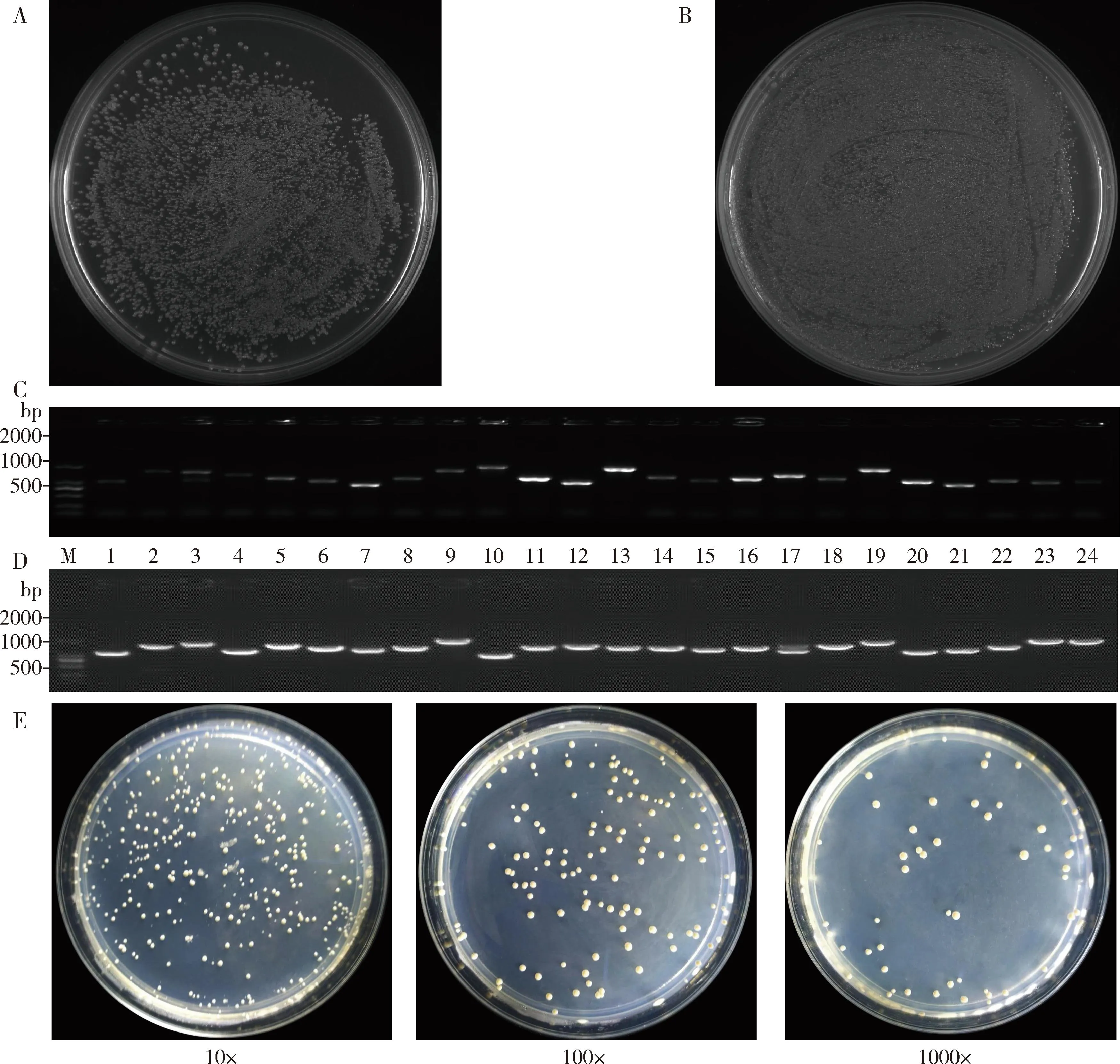
图2 家蝇酵母双杂交cDNA初级文库插入片段(A, C)、次级级文库插入片段(B, D)和文库容量(E)检测
在次级文库中, 获得的总克隆数为2 000 CFU, 文库滴度为4.0×106CFU/mL, 文库容量为1.6×107CFU。 PCR检测结果表明, 琼脂糖凝胶电泳显示插入片段长度在500~2 000 bp之间,平均长度>1 000 bp,重组率为100%(图2: B, D), 表明多样性好,成功构建次级文库,可用于进一步筛选互作蛋白。文库容量为1.6×107CFU(图2: E), 表明获得的酵母双杂交cDNA 文库符合互作筛选大于1×106CFU的要求。
2.3 文库自激活性
为保障结果的正确性,进一步自激活性验证,结果发现在3种培养基(SD-TL, SD-TLHA和LacZ)上,阳性对照(pGBKT7-53+pGADT7-T)菌落均能够良好生长,表明无毒性。同时,实验组(pGBKT7-MD14-3-3)与阴性对照(pGBKT7-Lam+pGADT7-T)结果一致,而与阳性对照结果相反(图3),表明该基因不具有转录激活活性可进一步筛库。

图3 家蝇MD14-3-3诱饵蛋白自激活检测
2.4 酵母双杂交筛库分析
将成功构建的pGBKT7-MD14-3-3载体进行酵母摇菌、质粒抽提、转化Y2HGold酵母菌感受态细胞,进行SD/TL培养基(150 μL/块,64块)、SD/THLA/AbA培养基(150 μL/块, 2块)、(SD/THLA/ X-α-Gal/ AbA培养基(150 μL/块, 2块) 平板筛选,最终两次重复均获得2个阳性克隆(图4)。

图4 家蝇酵母双杂交cDNA文库筛选MD14-3-3互作蛋白
2.5 回转验证
将MD14-3-3与2.4节中的2个阳性克隆进行一对一回转验证,结果发现共转染的酵母其均能在SD-TL, SD-TLHA/AbA与X-α-Gal的培养基中正常生长,且与阳性对照的结果一致,与阴性对照的结果相反,表明目标分子T1和T2为MD14-3-3互作蛋白(图5), 进一步对其测序并在NCBI数据库中的序列进行BLAST比对分析,发现T1为抗菌肽ctenidin-1(GenBank登录号: XM_ 005181706.1),T2为mucin-like protein HKR1(GenBank登录号: XM_011293334.2)。
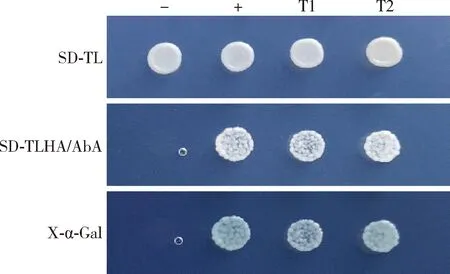
图5 与MD14-3-3互作的目标蛋白回转验证
3 讨论
利用酵母双杂交构建cDNA文库,从中筛选诱饵蛋白互作分子,建立目标蛋白互作的上下游关系,对探究分子机制具有非常重要的意义。其中,cDNA文库的容量和文库的重组率是评价文库完整性的核心指标,由于完整的mRNA由5′UTR, 3′UTR和CDS组成,因此要求重组cDNA片段足够长,即库容反映了mRNA的完整性,其最小库容应该在1×106CFU,重组率应在98%以上(Johnsson and Varshavsky, 1994)。本研究构建了家蝇初级文库与次级的cDNA文库,最终文库库容为1.6×107CFU,重组率为100%,插入片段长度在500~2 000 bp之间,平均长度>1 000 bp(图2),表明成功构建文库,可用于进一步筛选。
14-3-3蛋白定位于昆虫的血细胞,主要参与血细胞吞噬、包囊、黑化等免疫功能(Obsil and Obsilova, 2011; Shandalaetal., 2011; Jiaoetal., 2022)。然而14-3-3互作蛋白及其介导免疫的分子机制尚不清楚。前期发现果蝇与斑马鱼14-3-3蛋白抵抗G+菌和G-菌感染中发挥重要作用(Shandalaetal., 2011; Wangetal., 2021)。我们近期发现14-3-3蛋白可穿透细胞膜杀死大肠杆菌E.coli和金黄色葡萄球菌S.aureus(Jiaoetal., 2022)。本研究发现抗菌肽ctenidin-1可与14-3-3蛋白直接互作,据此推测其可能直接诱导细胞合成抗菌肽,而不通过Toll或者IMD信号通路来启动抗菌肽的合成。我们的研究为后期信号转导通路探究奠定了基础。
Mucin-like蛋白主要定位于昆虫的唾液腺,参与个体发育和免疫防御。例如,在果蝇中发现Mucin-like蛋白与其发育密切相关(Huangetal., 2022);而埃及伊蚊Mucin-like蛋白可与登革热病毒互作,从而抑制病毒感染自身(Yadavetal., 2023);有趣的是,白背飞虱Sogatellafurcifera的Mucin-like 蛋白诱导宿主免疫防御反应(Liuetal., 2022);而褐飞虱Nilaparvatalugens的Mucin-like蛋白与卵的发育密切相关(Louetal., 2019)。然而,我们发现Mucin-like蛋白可与14-3-3蛋白直接互作,这就解释了家蝇取食并携带多种病原但自身不感染,可能是病原体伴随Mucin-like蛋白进入体内,随即结合14-3-3蛋白并启动抗菌肽ctenidin-1合成,进而杀死病原防止自身感染。我们的假说还需进一步验证。
综上,我们成功构建了家蝇感染病原体后的酵母双杂交构建cDNA文库,并利用MD14-3-3蛋白为诱饵筛选到了两个互作蛋白(抗菌肽ctenidin-1和唾液mucin-like蛋白HKR1),提示mucin-like蛋白可能是MD14-3-3蛋白的上游调控分子,而ctenidin-1为其下游调控蛋白。我们的研究为后期探究MD14-3-3蛋白介导的免疫信号转导通路奠定了重要基础。
猜你喜欢
杂志排行
昆虫学报的其它文章
- 基于转录组数据的中华按蚊细胞色素P450超家族基因不同发育阶段、成蚊不同组织和吸血前后不同时期雌成蚊的表达模式分析
- 狄斯瓦螨VdesNPC2b蛋白的基因克隆、原核表达及其与寄主幼虫信息素结合机制研究
- 亚洲玉米螟对球孢白僵菌分生孢子和芽生孢子-玉米共生体的取食选择和嗅觉反应
- 紫外线辐照被寄生的黑腹果蝇蛹对果蝇锤角细蜂生长发育的影响
- Response of heat inducible heat shock protein 90 gene of Aphis gossypii (Hemiptera: Aphididae) to gossypol and flupyradifurone stresses and mutual effect on transcription factor HSF
- 蜜蜂衰老与寿命调控研究进展
