基于半胱胺保护的金纳米酶催化光度法测定痕量亚硝酸根
2024-01-03姚秀琪韦砻覃庆婷何深怡吴海娇凌绍明
姚秀琪,韦砻,覃庆婷,何深怡,吴海娇,凌绍明
(百色学院 化学与环境工程学院,广西 百色 533000)
亚硝酸盐是一种存在于水、土壤和生物体内的无机化合物,在农业和工业中常用作防腐剂和添加剂[1]。然而,亚硝酸盐离子可以作为亚硝胺和亚硝酸化合物的前体,这些物质会致癌和诱变,因此摄入大量亚硝酸盐会严重损害人体健康[2-3]。此外,亚硝酸盐是氮循环的活性中间体之一,可作为评价氮循环氧化和还原步骤平衡状态的重要指标[4]。亚硝酸盐离子也是水质污染程度的一个指标,世界卫生组织建议[4]雨水中亚硝酸盐的最高含量为3 mg·L-1。对饮用水,欧洲监管机构[5]将亚硝酸盐的最大允许含量定为0.1 mg·L-1。因此,亚硝酸盐的定量分析对水质安全和食品安全监测具有重要的意义。目前,检测亚硝酸根的方法主要有液相色谱法[6]、荧光法[7]、分光光度法[8]、化学发光法[9]、电化学法[10-11]、离子色谱法[12-13]、共振瑞利散射光谱法[14]和表面增强拉曼光谱法[15]等。
上述检测NO2-方法,各有优势与不足。如碳量子点荧光法[7]检测亚硝酸根借助碳点与NO2-的专一作用机制,也就是说一份分析物只能生成一份信号,灵敏度偏低的问题还是存在[16]。对一对一检测方法而言,催化荧光分析法得到极大关注,极少量催化剂的引入能够带来较多的生成物,致使荧光信息发生扩增作用,从而较大幅度地提高检测灵敏度[17]。廖雪凤等[18]利用NO2-催化溴酸钾氧化过量碘化钾生成I3-,借助I3-的刻蚀作用导致BSA保护的纳米金荧光减少原理,建立催化荧光法检测NO2-。该法灵敏度高、选择性好,但是荧光材料的制备与纯化过程复杂,检测费时。
近年来,基于纳米材料模拟酶的催化活性成为放大检测信号的重要手段,实现了痕量物质的高灵敏测定。研究发现,金属及其氧化物、贵金属纳米团簇、石墨烯及金属硫化物纳米片等具有过氧化物酶催化活性,这种纳米材料统称为“纳米酶”[19-20]。纳米酶在催化活性、表面电荷、形貌和尺寸上与天然过氧化物酶极为相似,具有价廉、稳定、易合成等优点,在生物医学检测、环境监测以及食品安全等领域应用广泛。如Wang等[21]基于金属有机骨架(MOF)[Cu(PDA)(DMF)]的过氧化物酶活性,实现人尿中多巴胺的检测。吴亮亮等[22]通过表面修饰Ag/Pt复合纳米簇,用于调控纳米酶的催化活性,实现对环境水样中痕量Cu2+的快速测定。因此,丰富和发展NO2-的检测新技术,降低检测成本、提高检测速度和灵敏度以及在线检测能力已成为急需解决的科学问题。
根据催化反应能够增强检测信号的作用[17],本工作拟将亚硝酸根的催化氧化反应和金纳米酶的催化显色反应相结合,组建“双催化反应体系”以期提高检测NO2-的灵敏度,探索建立一种快速、灵敏度高的、操作简便的比色分析法。即:利用亚硝酸根催化溴酸钾氧化过量的碘化钾生成I3-,基于I3-对半胱胺保护的金纳米粒子(cyst-AuNPs)的刻蚀作用,调控了cyst-AuNPs催化“过氧化氢与四甲基联苯胺(TMB)反应”的催化活性,探索建立一种检测NO2-的新型比色探针。
1 实验部分
1.1 主要仪器
日本岛津公司生产的2700型紫外可见分光光度计;北京格瑞恩科技发展公司生产的SY-1220型恒温水浴箱;上海梅特勒-托利多仪器有限公司生产的ME204电子分析天平;美国Miliipore公司生产的Driect-55UV型纯水机。
1.2 主要试剂及配制方法
亚硝酸根标准储备液:0.16 mg·mL-1,准确称取0.060 1 g亚硝酸钠(优级纯,上海阿拉丁生化科技股份有限公司),用超纯水溶解后定容于250 mL茶色容量瓶,摇匀,冰箱保存;亚硝酸标准工作液:1.0 μg•mL-1,移取62.5 μL亚硝酸根储备液于10 mL比色管中,加超纯水至刻度,现配现用;氯金酸:2.4×10-2mol•L-1;半胱胺盐酸盐(cyst):213 mmol•L-1;3,3′,5,5′-四甲基联苯胺(TMB)乙醇溶液:10 mmol•L-1;NaAc水溶液:0.20 mol•L-1;HAc水溶液:0.20 mol•L-1;pH值=4.0 NaAc-HAc缓冲溶液:取18.0 mL 0.20 mol•L-1NaAc水溶液和82.0 mL 0.20 mol•L-1HAc水溶液混合而得;过氧化氢储备液:0.10 mol•L-1,现配现用;过氧化氢工作液:1.0×10-3mol•L-1,现配现用;硼氢化钠水溶液:10 mmol•L-1,现配现用;KBrO3水溶液:0.10 mol•L-1;H2SO4水溶液:0.10 mol•L-1;KI水溶液:0.40 mol•L-1。
1.3 cyst-AuNPs的合成
参照文献[23]合成,并做些改动。向洁净的三角瓶中加入2.34 mL浓度为2.4×10-2mol•L-1的氯金酸,补加超纯水40 mL,放入搅拌子搅拌,向烧杯中加入500 μL浓度为213 mmol•L-1的半胱胺盐酸盐溶液,继续搅拌20 min后,逐滴加入90 μL浓度为10 mmol•L-1硼氢化钠水溶液,滴加完毕继续搅拌15 min,得酒红色溶液,无菌密封冰箱保存。
1.4 实验方法
在5.0 mL离心管中依次加入NO2-标准工作液、0.10 mol•L-1H2SO4水溶液120 μL、0.10 mol•L-1KBrO3水溶液50 μL、0.40 mol•L-1KI水溶液200 μL,用超纯水稀释至1.0 mL,并做空白试液(A0)。室温下孵育时间(t1)30 min后,加入100 μL cyst-AuNPs溶液,预孵育时间(t2)15 min,再依次加入550 μL NaAc-HAc缓冲溶液(pH值4.0,0.20 mol•L-1)、300 μL 10 mmol•L-1TMB、200 μL 1.0×10-3mol•L-1过氧化氢,定容至3.0 mL,于30 ℃水浴中反应时间(t3)30 min,测定655 nm处吸光度值A,计算ΔA=A0-A。
2 结果与讨论
2.1 cyst-AuNPs的吸收光谱及催化活性
图1是cyst-AuNPs吸收光谱图。制得的cyst-AuNPs呈现酒红色,在521 nm处有强吸收,吸收峰的半峰宽较窄,初步说明合成的cyst-AuNPs颗粒均匀,稳定性好。
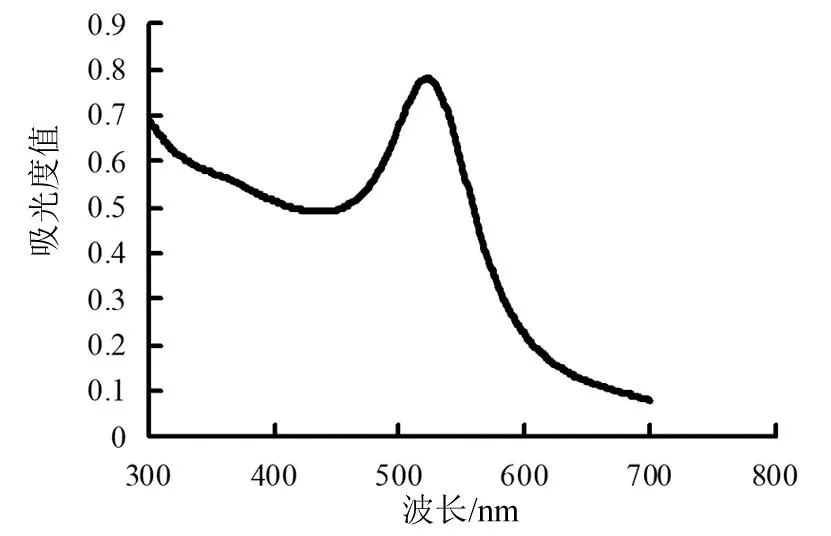
图1 cyst-AuNPs的吸收光谱图
图2是不同体系的吸收光谱图。TMB独立存在时无明显吸收峰(见图2曲线1),TMB与过氧化氢反应后体系在655 nm处有TMB氧化态的特征吸收峰,但是强度弱(见图2曲线2),这是因为TMB与过氧化氢反应极为缓慢。加入cyst-AuNPs后,体系在655 nm处的吸收值明显增大(见图2曲线5),溶液微深蓝色,说明cyst-AuNPs能够有效催化过氧化氢氧化TMB。当体系存在不同质量浓度NO2-时,体系在655 nm处的吸收降低,并且随着NO2-质量浓度的增加体系吸收值减小(见图2曲线3与4)。这是因为随着NO2-质量浓度的增加,体系生成的I3-增多,导致有更多的cyst-AuNPs被刻蚀,引起cyst-AuNPs催化活性降低。
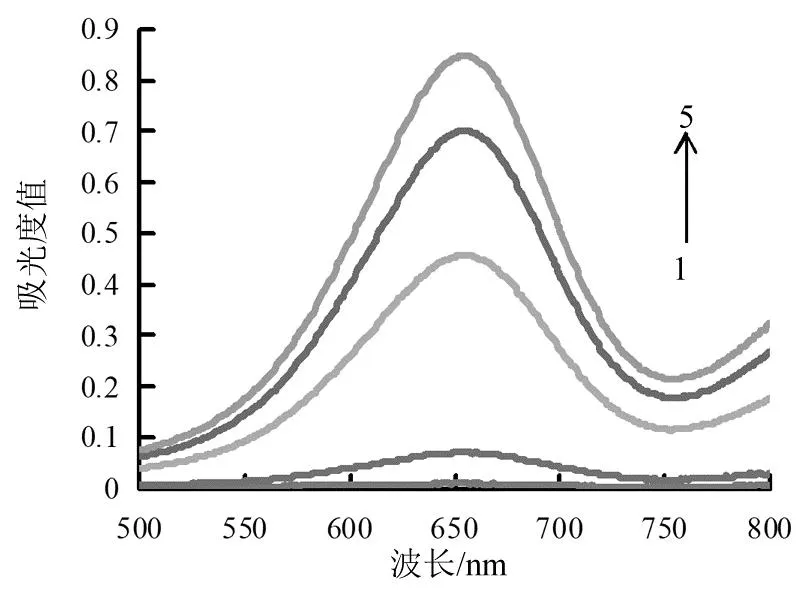
1.TMB;2.H2SO4+KBrO3+KI+NaAc-HAc+TMB+H2O2;3.H2SO4+KBrO3+KI+cyst-AuNPs+NaAc-HAc+TMB+H2O2+0.108 μg•mL-1 NO2-;4.H2SO4+KBrO3+KI+cyst-AuNPs+NaAc-HAc+TMB+H2O2+0.033 3 μg•mL-1 NO2-;5.H2SO4+KBrO3+KI+cyst-AuNPs+NaAc-HAc+TMB+H2O2+0.00 μg•mL-1 NO2-;cyst-AuNPs:100 μL+TMB:1.0 mmol•L-1 +H2O2:0.066 7 mmol•L-1 +pH值4.0
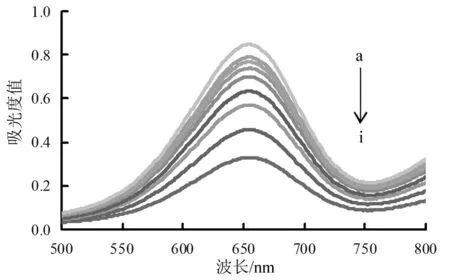
cyst-AuNPs:100 μL+TMB:1.0 mmol•L-1 +H2O2:0.066 7 mmol•L-1 +pH值4.0+NO2-(a到i:0,0.008 33,0.016 7,0.025 0,0.033 3,0.041 7,0.075 0,0.108,0.142 μg•mL-1)
图3是有不同NO2-质量浓度时体系的吸收光谱图。由图3可见,随着NO2-质量浓度增加,体系产生的I3-越多,有更多的金纳米粒子被刻蚀,金纳米粒子模拟酶催化活性被抑制,TMB被氧化的数量减少,体系在655 nm处的吸收值减小,体系的吸收值线性下降。实验选择655 nm为测定波长。
2.2 测定条件优化
研究表明,痕量的NO2-对溴酸钾氧化碘化钾有强烈的催化作用[24],当有过量碘化钾存在时,体系形成I3-,I3-对cyst-AuNPs有刻蚀作用,引起cyst-AuNPs模拟酶的催化活性被抑制。本工作主要对cyst-AuNPs模拟酶的催化反应条件进行优化。
2.2.1 cyst-AuNPs溶液用量影响
固定其他条件,通过改变cyst-AuNPs溶液用量以考察cyst-AuNPs溶液用量对测定体系影响,结果见图4。
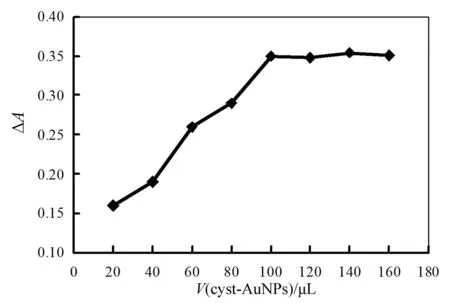
图4 cyst-AuNPs溶液用量影响
由图4可见,随着cyst-AuNPs溶液用量增加,体系的吸光度差值逐渐增大,当用量为100 μL时,吸光度差值达到最大值,此时测定灵敏度最高;随后吸光度差值增长比较缓慢,因此实验选择cyst-AuNPs溶液用量为100 μL。
2.2.2 缓冲溶液pH值影响
固定其他条件,改变缓冲溶液pH值以考察缓冲溶液pH值的影响,结果见图5。
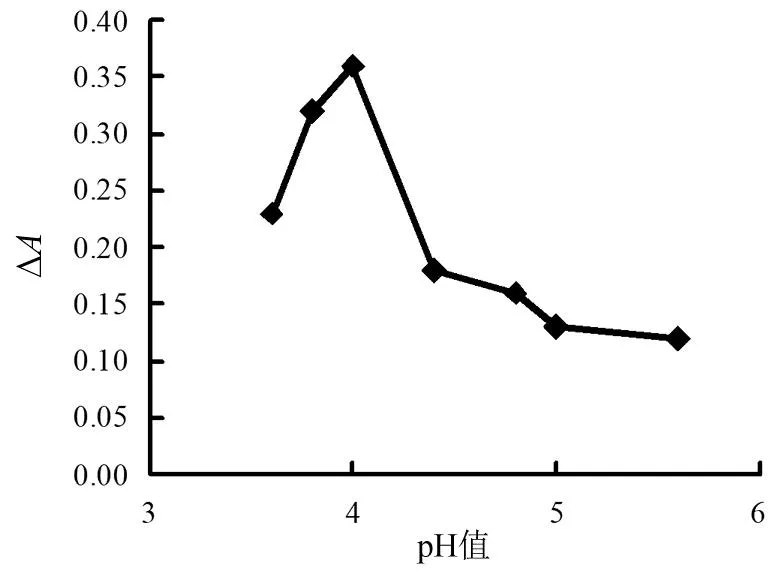
图5 缓冲溶液pH值影响
由图5可见,随着pH值增大,体系的吸光度差值快速增大,但当pH值=4时,体系的吸光度差值开始迅速下降。这是因为酸性环境能够保持cyst-AuNPs表面形成大量的正电荷而维持其稳定性,pH值增大,cyst-AuNPs表面电荷减少,稳定性降低,影响cyst-AuNPs催化活性。所以实验取缓冲溶液pH值=4比较合适。
2.2.3 缓冲溶液用量影响
固定其他条件,改变缓冲溶液用量以考察缓冲溶液用量的影响,结果见图6。
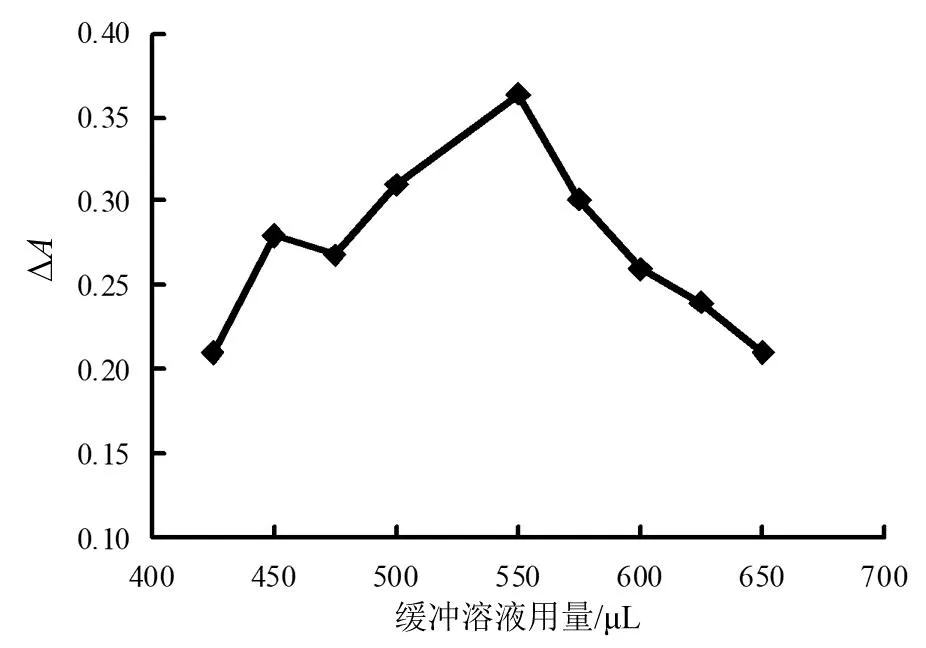
图6 缓冲溶液用量影响
由图6可见,用量400~550 μL时,吸光度差值逐渐上升。当缓冲溶液的用量大于550 μL时,吸光度差值开始降低,所以缓冲溶液用量取550 μL比较合适。
2.2.4 TMB用量影响
固定其他条件,改变TMB用量以考察其对体系的影响,结果见图7。
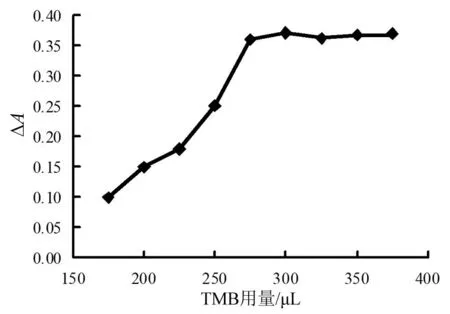
图7 TMB用量影响
由图7可见,TMB的用量为150~270 μL时,吸光度差值增长的比较的快,300 μL以后,吸光度差值增加的比较缓慢。所以TMB用量取300 μL比较合适。
2.2.5 H2O2用量影响
固定其他条件,改变H2O2用量以考察其对体系的影响,结果见图8。
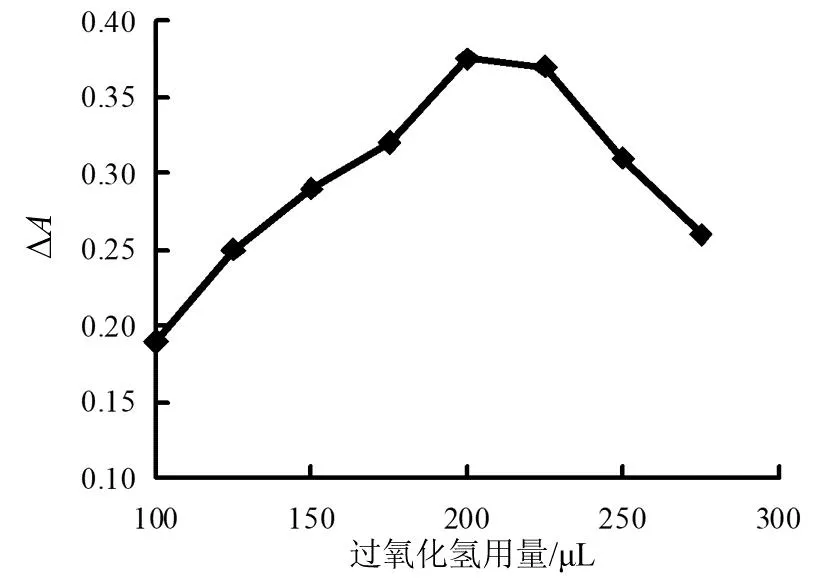
图8 过氧化氢用量影响
由图8可见,过氧化氢的用量为200 μL之前时,吸光度差值逐渐增长,到200 μL以后,吸光度差值逐渐减小。所以过氧化氢用量200 μL比较合适。
2.2.6 温度的影响
固定其他条件,通过改变纳米酶催化反应温度以考察其对体系的影响,结果见图9。
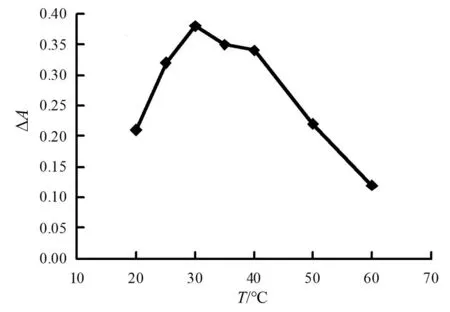
图9 纳米酶催化反应温度的影响
由图9可见,纳米酶催化反应温度为20~30 ℃时,吸光度差值逐渐递增,到30 ℃以后,吸光度差值开始减小。这是因为较高温度下会加快过氧化氢分解,cyst-AuNPs活性降低。所以实验取30 ℃比较合适。
2.2.7 时间(t3)影响
固定其他条件,通过改变纳米酶催化反应时间(t3)以考察其对体系的影响,结果见图10。
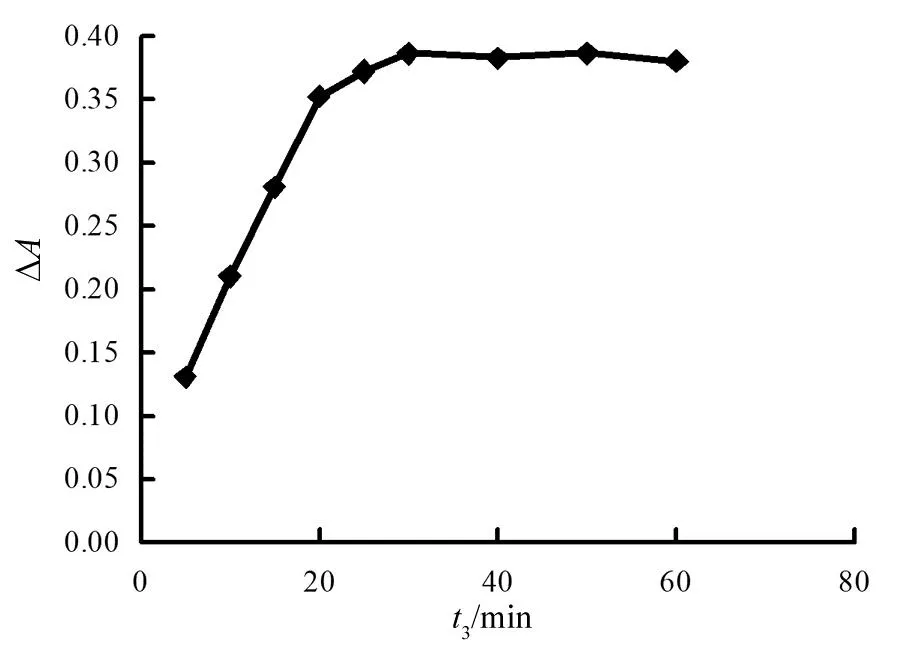
图10 纳米酶催化反应时间(t3)影响
由图10可见,反应时间(t3)30 min之前,吸收光差值逐渐递增,当30 min之后,吸收光差值趋于平缓。随着反应时间的进行,体系生成的I3-增多,导致有更多的cyst-AuNPs被刻蚀,引起cyst-AuNPs催化活性降低。当30 min时,反应基本完成了。
2.3 线性方程及检出限
参照实验方法,分别测定不同质量浓度NO2-(0,0.008 33,0.016 7,0.025 0,0.033 3,0.041 7,0.075 0,0.108,0.142 μg•mL-1),测定不同质量浓度NO2-的吸收值A,计算ΔA,结果发现ΔA值与体系不同质量浓度NO2-有较好线性关系,检测方法的线性方程为ΔA= 0.024 9 + 3.474ρ,相关系数R2为0.987 7,线性范围为0.008 33~0.142 μg•mL-1,检出限(3S/K)为0.005 8 μg•mL-1。
2.4 干扰实验
实验对常见共存物质进行干扰实验。当NO2-含量为0.075 μg•mL-1,相对误差在10%以内时,1 000倍的K+、Na+、Ca2+、Mg2+、F-、Cl-、Br-、NO3-、CO32-、HPO42-、H2PO4-、Ac-;500倍的Zn2+、Pb2+;300倍的Mn2+、Al3+、Ni2+;100倍的Cd2+;50倍的V(Ⅴ);25倍的Fe3+;10倍的Cu2+;5倍的Hg2+、Ag+不干扰NO2-检测。
2.5 样品测定
水样品经过滤后,取适量样品用本法进行测定,并做加标试验,结果见表1。
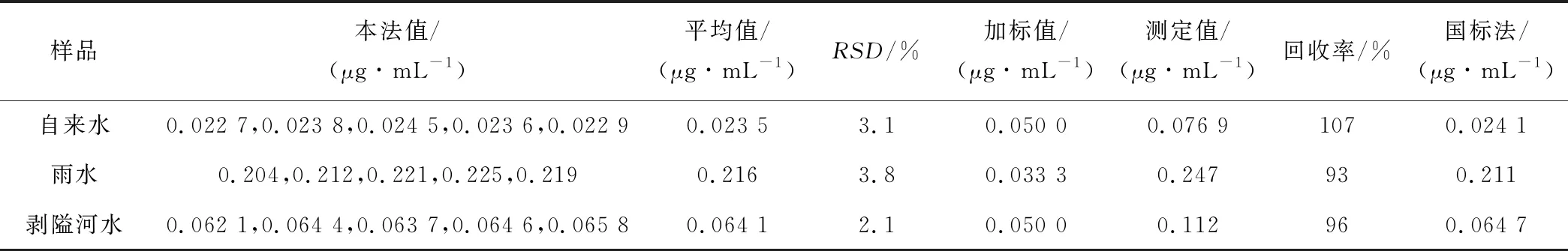
表1 样品测定及加标试验结果
本法测定结果与国标法[25]基本一致。
3 结论
基于cyst-AuNPs纳米酶催化活性、NO2-的催化氧化反应以及I3-刻蚀作用原理,将纳米酶催化反应与NO2-的催化氧化反应相结合,构建高灵敏检测NO2-的“双催化反应”体系。在优化测试条件下,NO2-的质量浓度与体系吸收变化量ΔA有线性关系,据此建立了灵敏检测0.008 33~0.142 μg•mL-1NO2-的光度分析法。本法用于测定环境水样品中NO2-的含量,结果满足NO2-含量测定要求。
