复合发酵剂对发酵鱼肉香肠品质、风味及其多肽抗氧化活性的影响
2024-01-03冯美琴李天翊
冯美琴,李天翊,孙 健,
(1.金陵科技学院动物科学与食品工程学院,江苏 南京 210038;2.南京农业大学食品科学技术学院,肉品质量控制与新资源创制全国重点实验室,江苏 南京 210095)
鱼肉因具有肉质紧实鲜美、营养均衡、高蛋白低脂肪的特点而深受全世界消费者的欢迎,鱼肉蛋白消化率高的同时还具有特殊的保健功效,其中含有的牛磺酸对人体肝脏有解毒作用,还能调节人体的血压[1]。但是,自溶酶和微生物活动会导致鱼肉迅速变质,一般在捕获后有限时间内作为新鲜食材在市场上售卖[2],尤其是淡水鱼类,腥味重、凝胶性能差和易腐败变质,与海水鱼相比具有更低的加工利用比例和产品附加值,这制约了淡水鱼的加工利用和增值转化,是当前迫切需要解决的问题[3-4]。
发酵香肠是一种经过微生物发酵后具有独特风味的传统肉类发酵制品,具有营养价值高、风味独特、贮存时间长的特点。然而传统自然发酵生产周期长、成品质量不稳定、具有潜在的安全隐患[5]。人工接种的微生物发酵剂可用于引导发酵过程、抑制病原微生物的生长和潜在有害化合物(如生物胺)的合成[2],确保最终产品的安全性。同时,微生物发酵剂也可以改善产品的品质,Hu Yingying等[6]的研究发现植物乳杆菌(Lactobacillus plantarum)显著增加了低盐干发酵香肠的剪切力,而弯曲乳杆菌能够显著增加低盐干发酵香肠的亮度值,二者接种之后都能改善香肠的颜色、质地、香气风味。乳杆菌、乳球菌、葡萄球菌等作为发酵香肠的主要微生物,能够促进香肠中碳水化合物、蛋白质的分解和脂肪的分解氧化从而促进发酵香肠风味的形成[7-8]。王德宝等[9]研究发现清酒乳杆菌与木糖葡萄球菌复合发酵剂显著增加了羊肉发酵香肠风味物质的种类和含量,赋予香肠独特的香味。Wang Ji等[10]发现植物乳杆菌MSZ2促进发酵肉制品中2-十一醛、E-2-辛烯醛、辛醛、E,E-2,4-癸二烯醛的生成。Gao Pei等[11]在发酵米糟草鱼时发现,戊糖片球菌(Pediococcus pentasaceus)主要促进游离氨基酸的生成,进而促进挥发性风味物质的产生。近年来,从肉制品中获得的抗氧化肽因其安全性高、易吸收、活性强引起研究者们的广泛关注。课题组从中式传统香肠中分离出植物乳杆菌CD101和模仿葡萄球菌(Staphylococcus simulans)NJ201,将这两种菌作为功能性发酵剂接种于发酵香肠,可以显著提高发酵香肠多肽的体外抗氧化能力,并且在体内环境中能有效减少小鼠血清和肝脏的氧化损伤,具有良好的抗衰抗氧化作用[12]。
因此,将接种发酵香肠技术和鱼肉加工结合以期延长鱼肉产品的保质期、改善风味。而且胡永金[13]发现植物乳杆菌-15、干酪乳杆菌-1.001、木糖葡萄球菌-12及混合菌可以使鲢鱼鱼糜品质得到很好的改善,这也为利用发酵剂解决淡水鱼类加工难题提供可能。此外,相比于单一发酵剂,混合发酵剂更能有效抑制香肠在发酵成熟中过度氧化,甚至抑制酪胺的产生[9,14]。所以本实验将植物乳杆菌CD101和模仿葡萄球菌NJ201作为混合发酵剂接种到草鱼鱼糜制作而成的鱼肉香肠中进行发酵,以自然发酵作为对照,探究复合发酵剂对鱼肉香肠pH值、颜色、质地、风味、多肽抗氧化性的影响。以期为鱼肉香肠发酵提供一定的理论依据,也为淡水鱼附加值的增加提供一定的思路。
1 材料与方法
1.1 材料与试剂
1.1.1 菌株
植物乳杆菌CD101(NCBI编号MG798695);模仿葡萄球菌NJ201(NCBI编号MG798688)。
1.1.2 原料与试剂
草鱼鱼糜、猪肠衣 江苏省苏食肉品有限公司南京分公司;盐、蔗糖、姜粉、五香粉、白胡椒粉等 江苏南京苏果超市。
葡萄糖 甘汁园糖业;亚硝酸钠 杭州龙山化工有限公司;异抗坏血酸钠 郑州拓洋实业有限公司;甲醇溶液(色谱级)安徽天地高纯溶剂有限公司;其他试剂均为分析纯。
1.2 仪器与设备
OptiMairTM垂直流超净工作台 新加坡艺思高科技有限公司;HVE-50自动高压灭菌锅 日本Hirayama公司;WH-2微型涡旋混合仪 上海沪西分析仪厂有限公司;螺旋接种仪、自动影像分析菌落计数仪 法国Interscience公司;ICP260生化培养箱 德国Memmert公司;GM200刀式研磨仪 德国Retsch公司;T25匀浆机德国IKA公司;TC 12E绞肉机 意大利Sirman公司;VF608灌肠机 德国Handtmann公司;KBF 720恒温恒湿箱 德国Binder公司;Avanti J-E高速冷冻离心机美国Beckman Coulter公司;RE-52AA旋转蒸发器上海亚荣生化仪器厂;HH-42水浴锅 常州国华电器有限公司;ES2030冷冻干燥机、L-8900A氨基酸自动分析仪 日本Hitachi公司;Spectral Max M2e多功能酶标仪 美谷分子仪器(上海)有限公司;PTF-A300型万分之一电子天平 美国HZ公司;SIM-F124制冰机日本三洋电子有限公司;CR-400便携式色差仪 日本Konica Minolta公司;TA-XT2i质构仪 英国Stab Micro System公司;TSQ9000气相色谱-三重四极杆质谱联用仪美国Thermo Fisher Scientific公司。
1.3 方法
1.3.1 发酵剂的活化
将植物乳杆菌CD101在MRS液体培养基上以恒温37 ℃的条件培养20 h,模仿葡萄球菌NJ201在甘露醇盐琼脂液体培养基上以恒温30 ℃的条件培养20 h;活化2 次,吸取所需体积的菌液12 000×g、4 ℃离心5 min,舍弃上清液,然后用无菌生理盐水反复洗涤沉淀数次,重悬备用。
1.3.2 香肠发酵
参考曹辰辰等[15]的方法并稍作修改。新鲜草鱼鱼糜称质量,其他成分以肉质量为基础添加:食盐2%、蔗糖1%、葡萄糖1%、亚硝酸钠0.015%、异抗坏血酸钠0.05%、姜粉0.1%、白胡椒粉0.1%、五香粉0.1%。接菌组香肠的发酵剂菌量配比为植物乳杆菌CD101∶模仿葡萄球菌NJ201=1∶1,接种量为2×107CFU/g。工艺流程:原料肉→漂洗→绞肉→搅拌与发酵剂混匀→灌肠→恒温发酵→干燥成熟。以不添加任何发酵剂的自然发酵香肠为对照组,以接种发酵剂的香肠为接种组。在恒温恒湿箱中,第1天以30 ℃、相对湿度80%的条件发酵,第2~4天以15 ℃、相对湿度75%的条件发酵3 d,最后第5~21天以12 ℃、相对湿度72%的条件成熟17 d得到发酵鱼肉香肠样品。
1.3.3 发酵过程pH值的测定
在发酵过程中,分别在第0、1、4、9、21天取样,用手持pH计插入香肠内部测定各发酵时间的香肠pH值,每根香肠重复测定3 次。使用前用标准缓冲液进行校正,记录发酵过程中pH值的变化。
1.3.4 色差
在发酵过程中,分别在第0、1、4、9、21天取样,使用便携式色差仪测定发酵香肠的色度值,色差仪使用前用标准白板进行校正。将发酵香肠切成1 cm厚的圆柱体,测试中选择L*、a*和b*模式表示结果,记录发酵过程中颜色值的变化。
1.3.5 质构特性测定
参考任国艳等[16]的方法并稍作改动。将香肠去掉肠衣之后切成若干个1.0 cm3的正方体,测定时将每个肉块放在质构仪测试平台中央,每组样品均进行8 次平行实验。选用P/1000型探头,测定参数:测定前探头速率120 mm/min,测试速率60 mm/min,测定后探头速率300 mm/min。2 次测定时间间隔2 s,测定应变量为75%,起始力为1 N。测定硬度、弹性、内聚性和咀嚼性。
1.3.6 粗肽粉的提取
参考Xing Lujuan等[17]的方法,并略作修改。从发酵第21天的香肠中取样进行多肽提取。将对照组和接种组去掉肠衣后绞碎各称取25 g提取多肽。样品加入100 mL(pH 7.2)磷酸盐缓冲溶液,冰浴匀浆3 次(18 000×g,10 s),4 ℃静置2 h后12 000×g、4 ℃离心20 min。取上清液,经纱布过滤后加入3 倍体积40%乙醇溶液,静置过夜(12 h)。之后继续12 000×g、4 ℃离心20 min,上清液经抽滤后滤液使用旋转蒸发仪(50 ℃、50 r/min)浓缩去除乙醇,剩余肽液放入冷冻干燥机冻干60 h,得到粗肽粉,于-20 ℃密封保存备用。
1.3.7 1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)自由基清除能力的测定
参照Shimada等[18]的方法,并略作修改。用冻干的粗肽粉和超纯水配制质量浓度为5.0 mg/mL的肽液,并以谷胱甘肽(glutathione,GSH)为阳性对照组。0.5 mL肽液中加入0.5 mL以95%乙醇溶液溶解的0.2 mmol/L DPPH自由基溶液,混匀,于室温放置30 min后,测定混合物在517 nm波长处的吸光度,95%乙醇溶液替换DPPH自由基溶液为空白组,95%乙醇溶液替换肽液为对照组。肽液对DPPH自由基的清除能力计算如式(1)所示:
1.3.8 2,2′-联氮双(3-乙基苯并噻唑啉-6-磺酸)(2,2′-azino-bis(3-ethylbenzothiazoline-6-sulfonic acid),ABTS)阳离子自由基清除能力的测定
参考Zaky等[19]的方法并略作修改。等体积ABTS溶液和氧化剂配制ABTS阳离子自由基工作液,黑暗中反应14 h。用磷酸缓冲溶液稀释工作液25 倍后,取200 μL溶液与10 μL样品混合,室温反应4 min,在734 nm波长处测定吸光度。以超纯水代替肽液作为空白组,以GSH为阳性对照。肽液对ABTS阳离子自由基的清除能力计算如式(2)所示:
1.3.9 羟自由基清除能力的测定
参考冯美琴等[12]的方法。向0.6 mL 5 mmol/L邻二氮菲溶液中加入0.4 mL磷酸盐缓冲液(0.2 mol/L pH 7.4)混匀,加入0.6 mL 5.0 mg/mL肽液及0.6 mL乙二胺四乙酸(15 mmol/L),混匀后加入0.6 mL FeSO4溶液(5 mmol/L),混匀后加入0.8 mL 0.1% H2O2溶液,涡旋混匀后于37 ℃静置1 h,测定样品在536 nm波长处的吸光度记为A样品;超纯水替换样品测得的吸光度记为A损伤;超纯水代替H2O2测得吸光度记为A未损伤。羟自由基清除能力计算如式(3)所示:
1.3.10 挥发风味物质的测定
参考曹辰辰等[15]的方法并稍作修改。以C7~C30烷烃作为混标,采用固相微萃取法进行样品处理。将发酵香肠去掉肠衣绞碎后取5 g置于20 mL顶空瓶中,加入10 μL内标2,4,6-三甲基吡啶溶液(30 μL用甲醇溶液定容至100 mL)压盖,将老化后的50/30 μm CAR/PDMS/DVB萃取头插入样品瓶顶空部分,于60 ℃吸附30 min,吸附后的萃取头取出插入气相色谱进样口,于250 ℃解吸3 min,同时启动仪器采集数据。
色谱条件:使用TR-5 MS 毛细管柱(30 m×0.25 mm,0.25 μm),以氦气为载气,流速1 mL/min。升温程序:在40 ℃保持3 min,以5 ℃/min的升温速率升至90 ℃,不保持,再以10 ℃/min的速率升温至230 ℃,保持6 min。
质谱条件:离子源温度200 ℃,电离方式为电子电离,电子能量70 eV,发射电流120 μA,扫描质量范围m/z30~550。根据峰面积归一法计算每种风味化合物的相对含量。
1.3.11 游离氨基酸的测定
参考Qi Jun等[20]的方法并略作修改。去除肠衣后的香肠绞碎,称取4 g加入20 mL 0.03 g/mL的磺基水杨酸溶液,10 000 r/min冰浴匀浆3 次,每次20 s。4 ℃、12 000×g离心15 min。取4 mL上清液加入2 mL正己烷静置直到出现明显分层,弃去上层取下层溶液经0.22 μm水系滤膜过滤后用全自动氨基酸分析仪测定。
1.4 统计分析
本实验每个指标中每个处理组设置3 个重复,统计分析数据使用SAS V8软件中的Duncan’s Multiple-Range Test和单因素方差分析,结果以表示,均用GraphPad Prism 9.0或Origin 2020作图。以P<0.05为差异显著。
2 结果与分析
2.1 发酵过程中pH值的变化
如图1所示,对照组和接种组的pH值都呈现先下降后上升的趋势。在发酵开始前,即第0天时,两组pH值均在6.4~6.5之间,但因接种乳杆菌,接种组已经显著略低于对照组。发酵开始后的第1天,pH值都开始显著下降(P<0.05),对照组和接种组分别降低至5.02和4.89。发酵后的2~4 d,对照组pH值基本保持不变,略有上升,而接种组pH值继续显著降低到最低水平4.69。4 d之后,对照组和接种组pH值都开始出现显著回升,直至21 d发酵成熟时分别达到6.47和5.72。
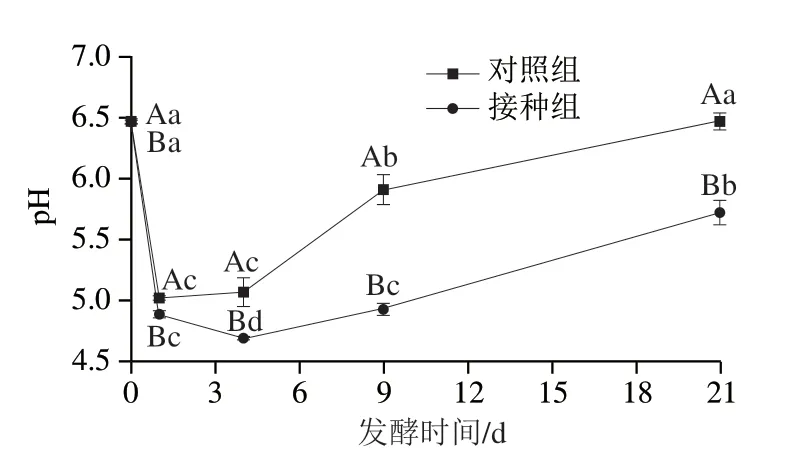
图1 发酵鱼肉香肠发酵期间pH值的变化Fig.1 Changes in pH of fermented fish sausages during fermentation
在整个发酵成熟过程中,接种组pH值始终显著低于对照组,这与课题组之前[21-22]的研究结果一致。香肠在发酵初期的pH值显著下降,主要是因为乳酸菌通过分解糖类进行代谢产生大量的乳酸及其他有机酸[23]。而接种组具有明显更低的pH值,是因为接种的植物乳杆菌CD101在发酵阶段适宜温湿度下具有快速产酸的能力[24]。研究表明,发酵初期迅速下降的pH值有利于抑制其他有害微生物的生长,降低蛋白质结合水的能力,加快干燥进程[25-26]。较低的pH值也能让香肠具有独特风味,促使蛋白质凝固,提高香肠的稳定性和安全性[27-28]。所以乳酸菌数量较多、产酸能力更强的接种组或许具有更好的品质。发酵后期的pH值回升可能是因为微生物产生的蛋白酶降解蛋白质生成肽、胺等碱性物质[29]。
2.2 发酵过程中色差测定结果
对照组和接种组在发酵成熟过程中颜色的变化主要由L*、a*、b*三个指标表示。L*值为亮度值,代表肉色的明暗度,与含水量有关;a*值为红度值,能够表现香肠的偏红程度和肌红蛋白的变化;b*为黄度值,反映香肠的偏黄程度,与脂肪氧化和蛋白变性有关[30]。由表1可以看出,L*值受发酵时间和不同处理作用影响显著(P<0.05),两组均呈现先上升后下降的趋势,可能是因为发酵后水分流失而平均散布在肉品表面上[13],使得在发酵初期L*值迅速上升。之后随着干燥进程的推进,香肠中的水分逐渐减少导致亮度值又显著下降,最终成品接种组肉色显著亮于对照组肉色。
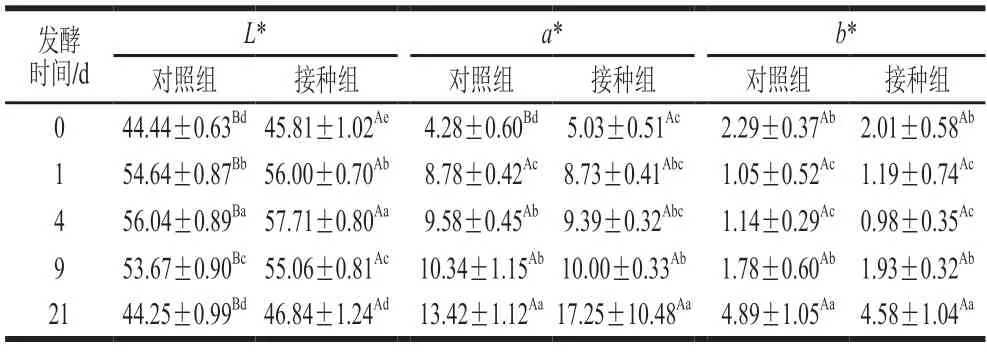
表1 发酵鱼肉香肠发酵期间色差变化情况Table 1 Changes in color difference of fermented fish sausages during fermentation
接种组的a*值和b*值都未发生显著变化(P>0.05),a*值和b*值都随着发酵时间的延长而显著上升,而且在21 d,接种组的a*/b*值显著大于对照组,说明肉色更红更鲜艳,这可能是因为添加的模仿葡萄球菌NJ201促进亚硝酸盐分解,有助于亚硝基肌红蛋白生成,从而有利于香肠具有更好的色泽[31-32]。所以,复合发酵剂能够显著提升发酵鱼肉香肠的亮度,并对色泽产生有利影响。
2.3 发酵过程中质构特性测定结果
从表2可以看出,复配发酵剂的接种对鱼肉香肠的质构特性有显著影响,尤其是在硬度和咀嚼性方面,都显著高于对照组,这与慕婷婷等[33]的研究结果相同,这可能是因为复合发酵剂在发酵过程中水解蛋白质、脂质等物质,使香肠的蛋白质变性,在鱼肉内部形成紧密的凝胶网络结构[34]。而在弹性方面,接种组显著低于对照组,这与王帆[4]和王秀丽[22]等的结果相反。两组内聚性并无显著差异,这与曹辰辰[35]的发现一致。质构的结果表明,复合发酵剂能够显著提升鱼肉香肠的硬度和咀嚼性,使其更加干燥,有利于稳定性和安全性的提升。

表2 不同处理对发酵鱼肉香肠质构特性的影响Table 2 Textural characteristics of fermented fish sausages produced by inoculated and natural fermentation
2.4 发酵鱼肉香肠多肽的抗氧化能力
本实验以DPPH自由基清除率、ABTS阳离子自由基清除率和羟自由基清除率表征发酵鱼肉香肠中提取粗肽的抗氧化能力。由图2可以看出,阳性对照GSH的DPPH自由基清除率和ABTS阳离子自由基清除率分别为94.33%和93.06%,均达到90%以上的较高水平,羟自由基清除率也达到39.03%,三者均显著高于对照组和接种组。而粗肽液的质量浓度在5 mg/mL时,复合发酵剂的接种显著提升多肽的抗氧化能力(P<0.05)。在DPPH自由基清除率方面,接种组的50.7%显著高于对照组的27.6%,达到GSH的一半以上。在ABTS阳离子自由基清除率方面,接种组的35.59%也显著高于对照组的26.97%,达到GSH的1/3以上水平。在羟自由基清除率方面,接种组的15.6%同样显著高于对照组的4.25%,达到GSH的1/3以上水平并且是对照组的3 倍以上。这说明复合发酵剂能够显著增强鱼肉香肠多肽的抗氧化能力,提高清除自由基的能力,这与Yu Di等[36]的研究结果类似。Luan Xiaoxu等[37]发现接种植物乳杆菌CD101的发酵香肠DPPH自由基清除率显著高于未接种组。Geeta等[38]也发现接种发酵剂有效提高鸡肉香肠的DPPH自由基清除能力。Karwowska等[39]发现接种乳酸菌的羊肉会产生更强的ABTS阳离子自由基清除活性。一些研究发现[40-41],多肽的抗氧化能力与多肽的氨基酸组成和氨基酸序列的疏水性有关,接种组香肠多肽更强的抗氧化能力可能与其具有更多的疏水性氨基酸有关,这在游离氨基酸的测定结果中也得到印证。Yu Di等[36]的研究结果也显示香肠多肽含有更高比例的疏水性氨基酸或许有更高的抗氧化活性。Liu Dongmei等[42]也发现多肽序列N端的疏水性氨基酸有利于其抗氧化活性。
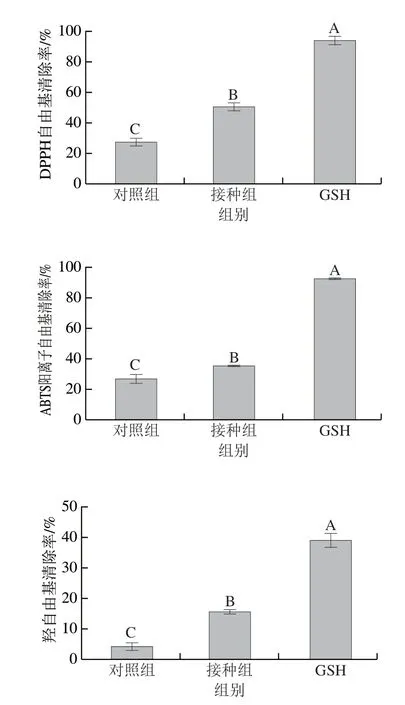
图2 不同处理对发酵鱼肉香肠多肽抗氧化能力的影响Fig.2 Effect of inoculated and natural fermentation on the antioxidant capacity of polypeptides from fermented fish sausages
2.5 发酵鱼肉香肠挥发性风味物质测定结果
本实验筛选了与Meanlib、NISTDemo和Wiley Library定性匹配度大于700的数据。从表3可以看出,对照组和接种组的发酵鱼肉香肠共检测出55 种挥发性风味物质,包括酮类物质2 种、醇类物质3 种、酸类物质6 种、酯类物质12 种、碳氢化合物23 种和其他类物质9 种。发酵鱼肉香肠中主要的风味物质是酯类物质和碳氢化合物。其中,对照组检测出32 种风味物质,碳氢化合物含量较多。接种组检测出48 种风味物质,酮类、酸类和酯类含量较多。

表3 不同处理对发酵鱼肉香肠挥发性风味物质含量的影响Table 3 Effect of inoculated and natural fermentation on the content of volatile flavor substances in fermented fish sausages μg/kg
2 种酮类物质都只在接种组中检测到,2-丁酮具有一定的甜味气息,而3-羟基丁酮有黄油味,2 种物质的相对含量都较高,对香肠的风味有重要贡献[43]。香肠产生的大部分醇类物质来源于微生物对碳水化合物或脂肪的代谢,接种组更多的醇类物质含量也说明复合发酵剂具有一定的脂肪分解活性[44]。酸类物质在发酵香肠中属于比较重要的风味物质,能与醇类物质发生酯化反应生成酯类物质,促进酯类物质的生成[45]。接种组产生更多的酸类物质,而且多为长链脂肪酸,这可能与接种的植物乳杆菌有关,柴秋儿等[46]的研究结果表明植物乳杆菌能够将亚油酸转化为共轭亚油酸。
酯类物质是构成发酵香肠风味的重要物质,例如乙酯类可以为香肠提供果香味和奶油香味[45]。在酯类物质含量上,接种组具有绝对优势,其中具有甜的水果和蜂蜜似花香香气的苯丙酸乙酯含量显著高于对照组。4-甲基戊酸乙酯能为接种组香肠提供类似苹果的果香。甲酯物质能够提供芳香气味,内酯类化合物能够赋予产品各种果香气息[45]。碳氢化合物的阈值较高,对香肠气味的贡献度较低。另外,醛、酮类物质是脂肪氧化的结果,可能是因为鱼肉脂肪含量过低的缘故,这两类物质检出极少。
总体来看,复合发酵剂促进了阈值较低、对香肠风味贡献度较高的酮类、酸类和酯类的生成,为鱼肉香肠提供一定的甜味和果香,使香肠风味更加丰富。
2.6 发酵鱼肉香肠游离氨基酸种类及含量测定结果
从表4可以看出,在检测到的13 种游离氨基酸中,除Glu、Cys、Lys以外,接种组的氨基酸含量都显著高于对照组(P<0.05),接种组的游离氨基酸总体含量也有显著优势,是对照组的1.81 倍,表明复合发酵剂具有良好的氨肽酶活性。Ala、Tyr、Arg可能是因为在对照组中含量太少而未能被检出。接种组含有333.2 mg/100 g的必需氨基酸,显著高于对照组的225.17 mg/100 g,这说明接种组可能具有更好的营养价值。
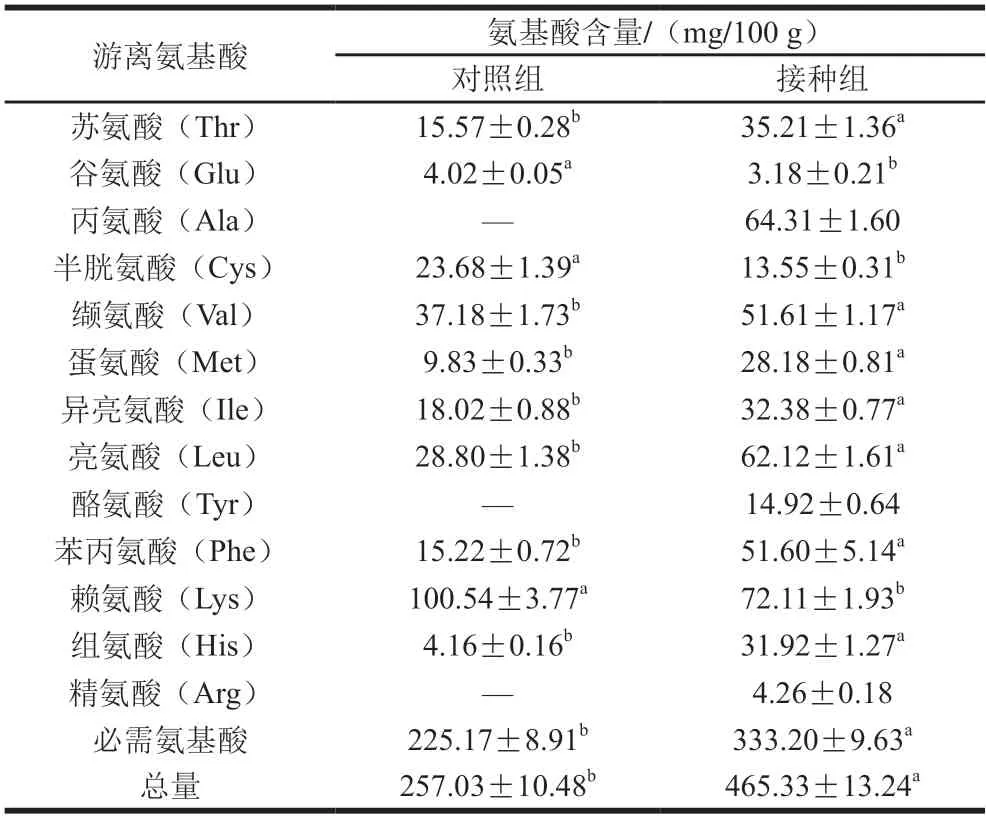
表4 不同处理对发酵鱼肉香肠游离氨基酸种类及含量的影响Table 4 Effect of inoculated and natural fermentation on the types and contents of free amino acids in fermented fish sausages
Val、Leu等游离氨基酸是一些风味化合物重要前体,乳酸菌通过转氨酶可将它们转化为相应的α-酮酸。这些酸经过一系列代谢反应最终成为对发酵香肠典型风味有贡献度的香气化合物[47]。Phe和Ile可以通过Strecker降解反应转化为香肠中重要的风味物质[48]。Ala、Thr也会对香肠的甜味有所贡献。这些氨基酸在接种组中的含量都显著高于对照组,可能使得接种组具有更丰富的风味,这与挥发性风味结果相呼应。此外,接种组中Met、Tyr、His、Lys、Cys等具有抗氧化活性的氨基酸含量大多显著高于对照组,这有利于增强接种组香肠肽段的抗氧化能力[49],此结果也与接种组多肽抗氧化能力显著高于对照组的结果一致。
3 结论
本实验接种植物乳杆菌CD101和模仿葡萄球菌NJ201组成的混合菌种发酵剂制作发酵鱼肉香肠,将自然发酵香肠作为对照,通过测定pH值、质构、色差、挥发性风味物质、抗氧化能力等指标,探究功能性发酵剂对发酵鱼肉香肠品质、风味及多肽抗氧化活性的影响。结果表明:接种功能性发酵剂能够使香肠在发酵期间具有更低的pH值,提高香肠的稳定性和安全性,同时能提高香肠产品的硬度和咀嚼性、提升亮度和色泽,使之拥有更好的品质。功能性发酵剂还可以显著提升香肠多肽的抗氧化能力,接种后香肠多肽的DPPH自由基、ABTS阳离子自由基、羟自由基清除率分别提升了23.1%、8.62%、11.35%。功能性发酵剂通过促进更多风味物质的生成,改善和丰富香肠的风味,赋予更强烈的甜味和果香。同时接种发酵剂促进发酵鱼肉香肠游离氨基酸的释放,这些氨基酸有利于增强香肠的抗氧化能力、营养性和改善风味。
