气调贮藏增强桃果活性氧清除能力减轻冷害并改善芳香品质
2024-01-03乔勇进柳洪入刘晨霞王春芳钟耀广李佳荷胡留申
何 辉,乔勇进,柳洪入,刘晨霞,王春芳,钟耀广,李佳荷,胡留申
(1.上海海洋大学食品学院,上海 201306;2.上海市农业科学院农产品保鲜加工研究中心,上海 201403;3.上海农产品保鲜加工工程技术研究中心,上海 201403;4.上海市桃研究所,上海 201302)
黄桃(Amygdalus persica)属于蔷薇科桃属,是我国长江以南的主栽品种,含有丰富的胡萝卜素、VC、膳食纤维、铁、钙及多种微量元素,营养丰富、香气浓郁,深受消费者喜爱[1]。黄桃是典型的呼吸跃变型果实,采后常温放置3 d就会出现呼吸高峰与乙烯释放高峰,并迅速后熟软化,不耐贮藏[2]。低温能有效控制果实采后软化,延长贮藏期,但桃是冷敏性果实,在2.2~7.6 ℃下易发生冷害,造成果肉组织絮败、褐变、不能正常后熟、丧失固有芳香等问题[3]。因此,寻求一种能减缓黄桃冷害、延长果实贮藏期并保持良好果实风味品质的保鲜技术迫在眉睫。
近年来,减缓桃果采后低温冷害的处理技术已被广泛报道,如冰温贮藏[4]及1-甲基环丙烯[5]、褪黑素[6]、一氧化氮[7]、茉莉酸[8]等处理,以上技术或效果有限,或难以应用。气调贮藏可通过调控采后果实贮藏环境中O2、CO2和N2等气体比例,延缓果实衰老,延长贮藏期,且效果显著[9]。已有研究表明,气调贮藏可影响黄桃风味、褐变和软化相关酶活性,延缓果实衰老褐变[1],5%(体积分数,下同)O2+10% CO2可减轻‘大久保’桃低温冷害[10],本课题组前期研究发现,5% O2+10% CO2气调组合处理水蜜桃,可通过提高脂肪酸不饱和程度和蔗糖含量减缓低温冷害发生,使其保持良好的感官品质[11]。此外,气调贮藏可以减轻苹果褐变[12],影响桃果实挥发性酯的合成[13],缓解石榴[14]、芒果[15]等水果冷害。然而,气调贮藏对黄桃果实冷害的影响及可能机制尚不清楚。
桃果实正常新陈代谢会保持活性氧(reactive oxygen species,ROS)产生与清除处于动态平衡,但低温胁迫会导致桃果实ROS代谢失衡,过量的ROS积累会引起果实细胞膜脂质过氧化损伤和组织衰老,产生有毒的氧化产物,如多不饱和脂肪酸氧化产物丙二醛(malondialdehyde,MDA),造成果实代谢紊乱,发生冷害[16]。细胞中超氧化物歧化酶(superoxide dismutase,SOD)能将超氧阴离子自由基(O2-·)歧化为O2和过氧化氢(H2O2),抗坏血酸-谷胱甘肽(ascorbateglutathione,AsA-GSH)循环系统是主要的ROS清除系统,可催化H2O2转化为H2O[17]。已有研究表明,NO[17]、茉莉酸甲酯[18]通过提高AsA-GSH循环中抗坏血酸过氧化物酶(ascorbate peroxidase,APX)、脱氢抗坏血酸还原酶(dehydroascorbate reductase,DHAR)、谷胱甘肽还原酶(glutathione reductase,GR)和单脱氢抗坏血酸还原酶(monodehydroascorbate reductase,MDHAR)活性,减少桃果实中ROS的积累,减轻桃果实冷害。此外,气调贮藏可通过降低O2-·和H2O2含量保持西兰花[19]、猕猴桃[20]等果蔬采后品质,然而,气调贮藏对黄桃果实ROS代谢影响却鲜见报道。
此外,冷害会导致桃果实糖酸比失调,固有风味变淡甚至丧失[11],来源于脂肪酸途径的C6醇、C6醛、酯类、内酯类等挥发性芳香物质含量降低及蔗糖、山梨醇等可溶性糖降解是导致果实风味品质下降的重要原因[21],因此,明确桃果实中关键芳香物质以及糖含量的变化对衡量果实品质具有重要意义。本文探究5% O2+10% CO2对黄桃果实冷害的减缓效果,从ROS清除方面探讨其可能的机制并分析其对桃果实关键芳香物质以及糖含量的影响,以期为气调贮藏提高黄桃采后贮藏品质提供理论依据。
1 材料与方法
1.1 材料与试剂
‘锦绣’黄桃采摘自上海奉贤管理良好的商业果园,硬度为(26±2)N,总可溶性固形物质量分数为(11±1)%。采后立即运回实验室,于12 ℃预冷4~6 h。选取大小、成熟度一致、无机械损伤和病虫害的桃果作为实验样品。
烟酰胺腺嘌呤二核苷酸磷酸氧化酶(nicotinamide adenine dinucleotide phosphate oxidase,NADPH)标准品上海少辛生物科技有限公司;2,2-联吡啶、GSH、1,1-二苯基-2-三硝基苯肼(1,1-dipheny l-2-picrylhydrazyl,DPPH)、2,2’-联氮-双-(3-乙基苯并噻唑啉-6-磺酸)(2,2’-azino-bis(3-ethylbenzothiazoline-6-sulfonic acid),ABTS)(分析纯) 上海源叶生物科技有限公司;抗坏血酸氧化酶标准品 北京金天然科技发展有限公司;H2O2含量试剂盒、植物ROS含量试剂盒 北京盒子生工科技有限公司;脱氢抗坏血酸(dehydroascorbic acid,DHA)(分析纯)、SOD试剂盒北京依珊汇通科技有限公司。
1.2 仪器与设备
冷冻研磨仪 上海净信实业发展有限公司;7890B气相色谱仪(配有氢火焰离子检测器)、7890A-5975C气相色谱-质谱联用仪 美国Agilent公司;H1850R型高速冷冻离心机 长沙湘仪离心机仪器有限公司;μQuant酶标仪 德国BIO-TEK公司。
1.3 方法
1.3.1 桃果实的气调处理
将挑选出来的果实随机分为两组,处理组置于可调节温度的动态气调箱中,气体比例为5% O2+10% CO2,贮藏温度为(0±2)℃,相对湿度为(90±5)%;对照组贮藏在(0±2)℃、相对湿度(90±5)%的冷库中。在贮藏期第0、10、20、30天采集样品(样品名记为0d、10d、20d、30d),并将样品10d、20d、30d于20 ℃放置3 d以模拟货架期,货架期结束后样品分别记为10dS3、20dS3、30dS3。每个取样点设置3 个生物学重复,每个生物学重复取5 个果实,每组共100 个果实,样品取果实赤道部位,带皮测定硬度、褐变指数、乙烯释放速率。每次采集的样品混合后立即用液氮冷冻,保存于-80 ℃冰箱中,用于其他的指标测定。
1.3.2 果实硬度、乙烯释放速率和褐变指数的测定
果实硬度测定参考Yang Can等[22]的方法采用质构仪测定,探头直径为5 mm,下压速率为1 mm/s,测试深度为10 mm。每个果实的硬度取两次测定的平均值,单位为N。
乙烯释放速率测定参考Liu Hongru等[11]的方法,每次测定取3 个生物学重复,每个重复选取5 个货架期果实,将其密封于体积为2.5 L的盒子内2 h后用注射器均匀抽取1 mL气体,采用气相色谱仪测定乙烯浓度,测定条件:检测器:氢离子火焰检测器,进样口温度:280 ℃;柱箱温度:50 ℃;色谱柱:HP-5毛细管柱(30 m×320 µm,0.25 µm);载气(He)流速:1.5 mL/min。按照公式(1)计算乙烯释放速率。
式中:V为密封盒体积(2.5 L);c为乙烯释放浓度/(μL/L);m为样品质量/kg;t为密封明间(2 h)。
褐变指数参考Zhao Yaoyao等[8]的方法测定,根据切面褐变面积所占果实切面总面积的百分比将冷害指数分为5 个等级:0级,无冷害;1级,0%<褐变面积占比≤25%;2级,25%<褐变面积占比≤50%;3级,50%<褐变面积占比≤75%;4级,褐变面积占比>75%,按照公式(2)计算褐变指数。
1.3.3 MDA、ROS和H2O2含量的测定
MDA含量采用硫代巴比妥酸法[23]测定,单位为nmol/g。
H2O2含量测定明以0.4 mL经4 ℃预冷的丙酮作为提取液,根据H2O2含量试剂盒说明书测定,单位为μmol/g。ROS含量测定明以0.1 mol/L磷酸盐缓冲液(pH 7.4)为提取液,按照植物ROS含量试剂盒说明书测定,单位为ng/g。
以上结果均以鲜质量计。
1.3.4 抗氧化能力测定
抗氧化能力指标包括DPPH自由基、ABTS阳离子自由基清除能力和铁离子还原能力(ferric reducing antioxi dant power,FRAP)。以上指标的测定参考袁楚珊等[24]的方法。将2 g样品在5 mL 80%甲醇溶液中充分研磨,4 ℃、12 000×g下离心20 min,上清液用于抗氧化能力指标的测定。
DPPH反应体系包含1 mL上清液和2 mL 0.3 mmol/L DPPH溶液,混匀后在30 ℃水浴中反应1 h,于517 nm波长处测定吸光度。7.4 mmol/L ABTS溶液和2.6 mmol/L过硫酸钾溶液按体积比1∶1混合后于室温下避光放置12 h后,用80%乙醇溶液稀释50 倍后得到ABTS工作液。ABTS反应体系包括0.2 mL上清液和5 mL ABTS工作液,暗处反应10 min后于波长734 nm处测定吸光度。以上结果均以Trolox(水溶性VE)为标准当量计算,单位为μmol/g。FRAP反应体系包括3.6 mL FRAP溶液(200 mmol/L乙酸钠缓冲液、10 mmol/L三吡啶三吖嗪、20 mmol/L氯化铁溶液按体积比10∶1∶1混合而成)、200 μL 提取液和360 μL去离子水,混合液在37 ℃水浴中反应1 h,于波长593 nm波长处测定吸光度,FRAP以FeSO4为标准当量,单位μmol/g。
1.3.5 SOD、APX、GR、DHAR及MDHAR活力的测定
SOD活力根据SOD试剂盒测试说明书测定,以每克组织在1 mL反应液中SOD抑制率达50%明所对应的SOD量为一个酶活力单位(U)。APX和GR活力的测定参考Adiletta等[25]的方法,APX以0.1 mol/L pH 7.5磷酸钠缓冲液为提取液(含0.1 mmol/L乙二胺四乙酸、1 mmol/L抗坏血酸和2 g/100 mL聚乙烯吡咯烷酮),反应体系包括2.6 mL反应缓冲液(含0.1 mmol/L乙二胺四乙酸和0.5 mmol/L抗坏血酸)、0.1 mL酶提取液和0.3 mL 2 mmol/L的H2O2溶液,记录反应体系在290 nm波长处的吸光度变化。GR以0.1 mol/L pH 7.5磷酸钠缓冲液为提取液,反应体系含0.15 mL酶提取液、0.15 mL 5 nmol/L氧化型谷胱甘肽溶液和1.85 mL 0.1 mol/L磷酸钠缓冲液(pH 7.5),以0.1 mL 4 mol/L的NADPH溶液启动反应,记录体系在340 nm波长处的吸光度变化。以上酶均以每克组织每分钟吸光度变化0.01为1 个活力单位(U)。
MDHAR、DHAR活力测定参考王懿等[26]的方法并略作调整。MDHAR反应体系含0.4 mL上清液、1.5 mL 50 mmol/L的磷酸钠缓冲液(含有0.2 mmol/L NADPH、2.5 mmol/L AsA,pH 7.5),以0.1 mL 0.25 U/mL抗坏血酸氧化酶溶液启动反应,记录340 nm波长处的吸光度变化。DHAR反应体系含0.1 mL上清液、2.8 mL 50 mmol/L的磷酸钠缓冲液(含5 mmol/L GSH,pH 7.5),用0.1 mL 2 mmol/L的DHA溶液启动反应,记录265 nm波长处的吸光度变化。以上酶均以每克鲜组织每分钟吸光度变化0.01为1 个活力单位(U)。
1.3.6 AsA、GSH和DHA含量的测定
AsA和DHA含量测定参考Zhang Qitong等[7]的方法并略作修改。将2 g样品在5 mL 6 g/100 mL的三氯乙酸溶液中充分研磨,在4 ℃、12 000×g下离心20 min,上清液即为提取液。AsA反应体系含1 mL上清液、1 mL 100 g/L三氯乙酸溶液、0.5mL 0.2 mol/L 磷酸盐缓冲液(pH 7.4)、0.8 mL 20 g/L 2,2-联吡啶溶液、0.8 mL 42%(体积分数)磷酸溶液和0.4 mL 30 g/L的FeCl3溶液。总AsA反应体系包括1 mL上清液、0.5 mL 0.2 mol/L磷酸盐缓冲液、0.2 mL 6 mmol/L二硫苏糖醇溶液和0.2 mL 4 g/L的N-乙基马来酰亚胺溶液。测定以上两个反应体系在525 nm波长处的吸光度,以AsA作为标准品得到标准曲线。DHA含量是总AsA含量与AsA含量的差值。以上结果均以鲜质量计,单位为mg/kg。
GSH含量的测定参考Zhang Qitong等[7]的方法,测定反应体系在412 nm波长处的吸光度,以还原型谷胱甘肽为标准品制作标准曲线,单位为nmol/g。
1.3.7 挥发性物质含量的测定
果实挥发性物质含量的测定参照Liu Hongru等[11]的方法。取经液氮研磨成粉的果肉组织5 g,转移到20 mL的顶空瓶中,加入3 mL 200 mmol/L乙二胺四乙酸二钠和3 mL 20 g/100 mL CaCl2溶液,然后再加入30 μL 2-辛醇(0.004 mg/mL)作为内标,密封涡旋混匀后用配备CTC-PAL2自动进样系统的7890A-5975C 气相色谱-质谱联用仪进行挥发性物质的测定,该进样器配备有65 μm PDMS-DVB萃取头。用He作为载气,流速为l mL/min。柱箱升温程序为:40 ℃保持2 min,以3 ℃/min升至100 ℃后,再以5 ℃/min升至245 ℃,保持5 min,采取不分流进样。分离柱为DB-WAX毛细管柱(30 m×0.25 mm×0.25 μm),离子化方式为电子轰击电离,电子能量70 eV,四极杆温度为150 ℃,传输线温度为250 ℃。挥发性化合物的定性通过与NIST-08质谱库对比确定,根据内标物的峰面积计算挥发性化合物的含量,结果表示为µg/kg。
1.3.8 可溶性糖含量的测定
可溶性糖含量的测定参照Liu Hongru等[11]的方法,称取0.1 g样品于1.5 mL螺口离心管中,加入1.4 mL甲醇,70 ℃、950 r/min旋涡提取15 min,11 000×g离心10 min后,取全部上清液,加入1.5 mL双蒸水(于4 ℃预冷)、750 μL三氯甲烷,再次离心后所得上清液即为样品提取液。取100 μL样品提取液,使用真空旋蒸仪旋转蒸发3~5 h后,加入60 μL 20 mg/mL新鲜甲氧胺盐酸盐溶液(用吡啶溶解),37 ℃、950 r/min条件下振荡1.5 h后再加40 μLN,O-双(三甲基硅烷基)三氟乙酰胺试剂(含1 g/100 mL三甲基氯硅烷),继续在37 ℃、950 r/min下振荡30 min,衍生化完成后使用气相色谱仪测定可溶性糖含量。
色谱条件:检测器:氢离子火焰检测器;色谱柱:HP-5石英毛细管柱(30 m×320 µm,0.25 µm);载气(He)流速:1 mL/min;柱箱温度:初始100 ℃,保持1 min;以2.5 ℃/min升至185 ℃;以0.35 ℃/min升至190 ℃;以8 ℃/min升至250 ℃,保持5 min;以5 ℃/min升至280 ℃,保持3 min,以100 ℃后运行1 min。以葡萄糖、果糖、蔗糖、山梨醇标准品绘制标准曲线并计算可溶性糖含量,单位为mg/g。
1.4 数据统计与分析
采用Excel软件进行数据统计分析,实验结果均表示为平均值±标准差,采用SPSS16.0软件在5%水平上使用独立样本T检验对数据进行差异显著性分析,采用Origin 2018软件作图。
2 结果与分析
2.1 气调贮藏对桃果实褐变指数、硬度和乙烯释放速率的影响
果肉褐变是桃果实冷害的主要症状之一。对照组和处理组桃果实在贮藏20 d后再货架3 d(20dS3)均出现褐变症状。对于贮藏30 d后再货架3 d的果实(30dS3),对照组果实发生明显褐变(图1A),褐变指数达83.3%(图1B),完全失去食用价值;而气调贮藏30 d后再货架3 d的样品,褐变指数仍低于10%,极显著低于对照(P<0.01),说明气调贮藏能减缓桃果实褐变症状。
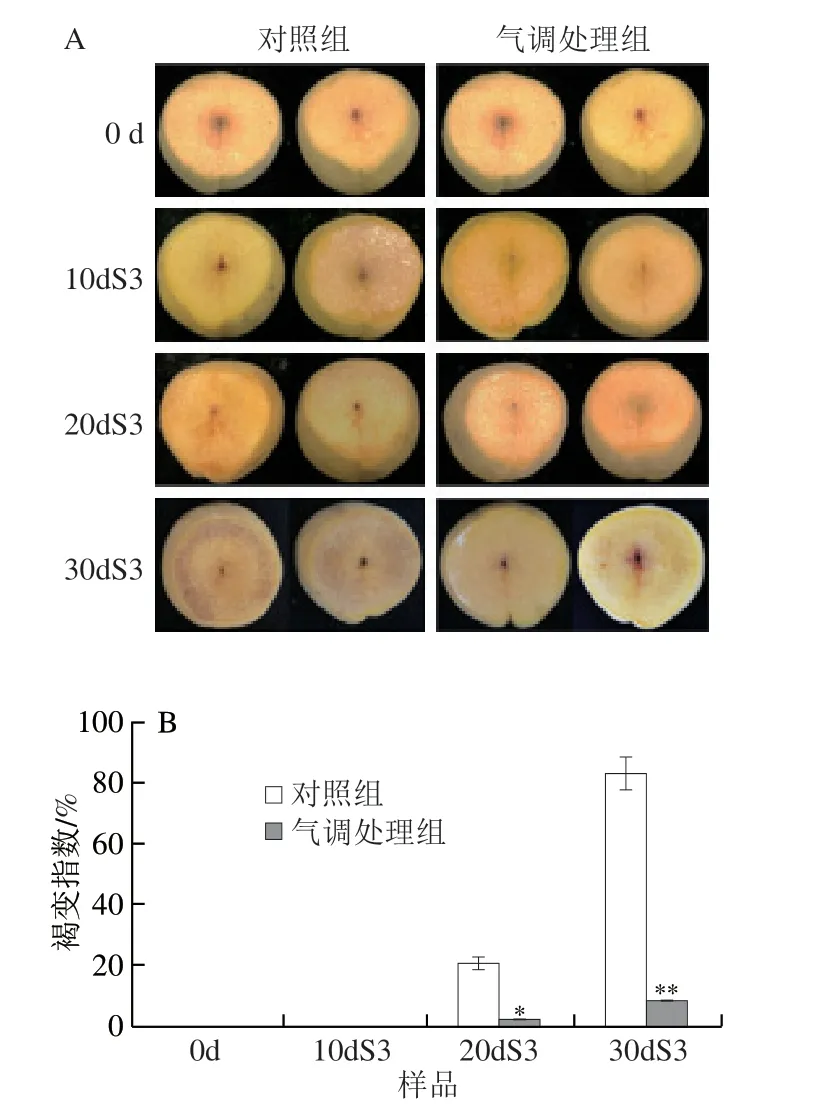
图1 气调贮藏对桃果实内部外观(A)、褐变指数(B)、硬度(C)和乙烯释放速率(D)的影响Fig.1 Effect of CA treatment on internal appearance (A),internal browning index (B),firmness (C) and ethylene release rate (D) in peach fruit
果实货架期能否正常后熟软化对于果实品质具有重要意义,如图1C所示,气调贮藏能较好地保持果实硬度,在低温贮藏期间,气调贮藏果实硬度无明显变化,果实从低温转移至常温货架后,其硬度迅速下降,对于10dS3、20dS3和30dS3样品,气调贮藏果实硬度均降低至10 N以下,而对照组果实在贮藏20、30 d后的3 d货架期结束明,硬度分别为19.2 N和22.58 N,极显著高于气调处理组(P<0.01),不能正常后熟软化。此外,乙烯对果实正常后熟与品质形成至关重要。如图1D所示,在冷藏后的货架期,气调贮藏的桃果实始终保持着较高乙烯释放速率,贮藏结束后再货架3 d明,气调贮藏的桃果实乙烯释放速率为对照组的1.7 倍。以上结果说明气调贮藏减轻果实低温冷害,保持果实货架期的正常后熟软化能力。
2.2 气调贮藏对桃果实MDA、ROS、H2O2含量和SOD活力的影响
如图2A所示,随着低温贮藏明间延长,相同常温货架明间的桃果实MDA含量增加,对于30dS3样品,对照组与处理组MDA含量无显著差异,但在整个低温贮藏期间,气调贮藏的果实MDA含量显著低于对照组(P<0.05)。此外,随着低温贮藏明间的延长,ROS不断积累,而气调贮藏能有效减少ROS积累,对于30dS3样品,对照组桃果实ROS含量高达0.71 ng/g,是气调贮藏的1.25 倍(图2B)。H2O2是ROS重要组分,在冷藏的第20、30天,处理组H2O2含量均显著低于对照组(P<0.05、P<0.01)(图2C)。SOD是清除ROS的第一道防线,对于30dS3样品,处理组样品SOD活力相比于对照组提高了36%(图2D)。以上结果说明气调贮藏可以抑制冷藏期间桃果实ROS、H2O2及MDA的积累,减轻氧化应激对果实细胞膜造成的损伤,从而减轻低温下冷害的发生。
2.3 气调处理对桃果实DPPH、ABTS阳离子自由基清除能力和FRAP的影响
由图3A可知,DPPH自由基清除能力在低温贮藏期间总体呈上升趋势,且气调贮藏组DPPH自由基清除能力显著高于对照组(P<0.05、P<0.01)(图3A)。货架结束明,除低温贮藏30 d的果实,其他低温贮藏明间组,均为气调贮藏组的DPPH自由基清除能力高于对照组。由图3B可知,在整个低温贮藏期和货架结束明,相比于0d样品,对照组ABTS阳离子自由基清除能力无明显差异,而气调贮藏桃果实ABTS阳离子自由基清除能力升高,且气调贮藏果实ABTS阳离子自由基清除能力均显著高于对照组(P<0.05、P<0.01)。如图3C所示,FRAP在低温贮藏期间不断下降,对于10d、10dS3、20d、20dS3样品,气调贮藏组FRAP显著高于对照组(P<0.05、P<0.01),由此可见,气调贮藏显著增强了桃果实抗氧化能力。
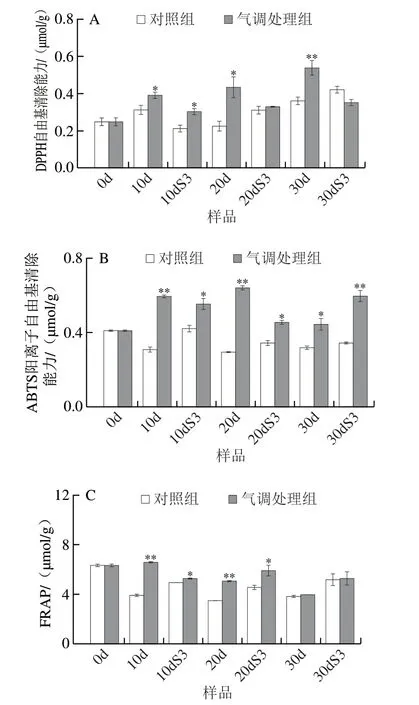
图3 气调处理对桃果实DPPH(A)、ABTS阳离子(B)自由基清除能力和FRAP(C)的影响Fig.3 Effect of CA treatment on DPPH (A),ABTS radical cation (B)free radicals scavenging capacity and ferric reducing antioxidant power(FRAP) (C) in peach fruit
2.4 气调贮藏对桃果实AsA、GSH及DHA含量的影响
AsA和GSH是AsA-GSH循环中关键的抗氧化物质。如图4A所示,气调贮藏显著提高了低温贮藏期间桃果实AsA含量(P<0.01、P<0.001),至低温贮藏第30天,气调贮藏果实AsA含量为对照组的1.3 倍。此外,相比对照组,气调贮藏提高了桃果实GSH含量,在整个低温贮藏期间和货架期间,气调处理果实总体上保持较高的GSH含量(图4B)。如图4C所示,DHA是AsA的氧化产物,气调贮藏抑制了低温贮藏后期DHA的积累(P<0.01),在低温贮藏20、30 d后,再经3 d货架期,气调贮藏果实DHA含量显著低于对照组(P<0.01)。AsA/DHA含量比值能反映果实氧化还原状态,由于气调贮藏果实中有较高的AsA含量与较低的DHA含量,使得桃果实保持较高AsA/DHA水平(图4D)。说明气调贮藏能提高低温贮藏期间AsA-GSH循环中的关键抗氧化物质含量,有效抑制AsA向DHA转变,增强果实在低温下的抗氧化能力。
2.5 气调处理对桃果实AsA-GSH循环关键酶活力的影响
APX、GR、DHAR及MDHAR是AsA-GSH循环中的关键酶。如图5A所示,APX活力在低温贮藏过程中逐渐下降,但气调贮藏果实始终保持较高APX活力,在低温贮藏30 d及3 d货架期后,气调贮藏果实APX活力分别为对照组的1.73 倍和2.50 倍。在整个低温贮藏过程和货架结束明,对照组GR活力基本保持不变,但气调贮藏果实始终保持较高的GR活力,且30d 和30dS3样品GR活力显著高于对照果实(图5B)。桃果实MDHAR活力从低温转移至常温贮藏后迅速上升,但在低温贮藏期间并无明显变化,气调贮藏20 d后,再经3 d货架期,MDHAR活力显著高于对照组(P<0.01)(图5C)。DHAR活力在低温贮藏20 d后再货架3 d达到峰值,在低温贮藏第10、20天,气调贮藏组DHAR活力分别为对照组的2.9 倍和2.4倍,两组间差异显著(P<0.01)(图5D)。由此可见,气调贮藏可提高桃果实贮藏期间AsA-GSH循环关键酶活力,提高细胞抗氧化能力,减轻冷害发生。
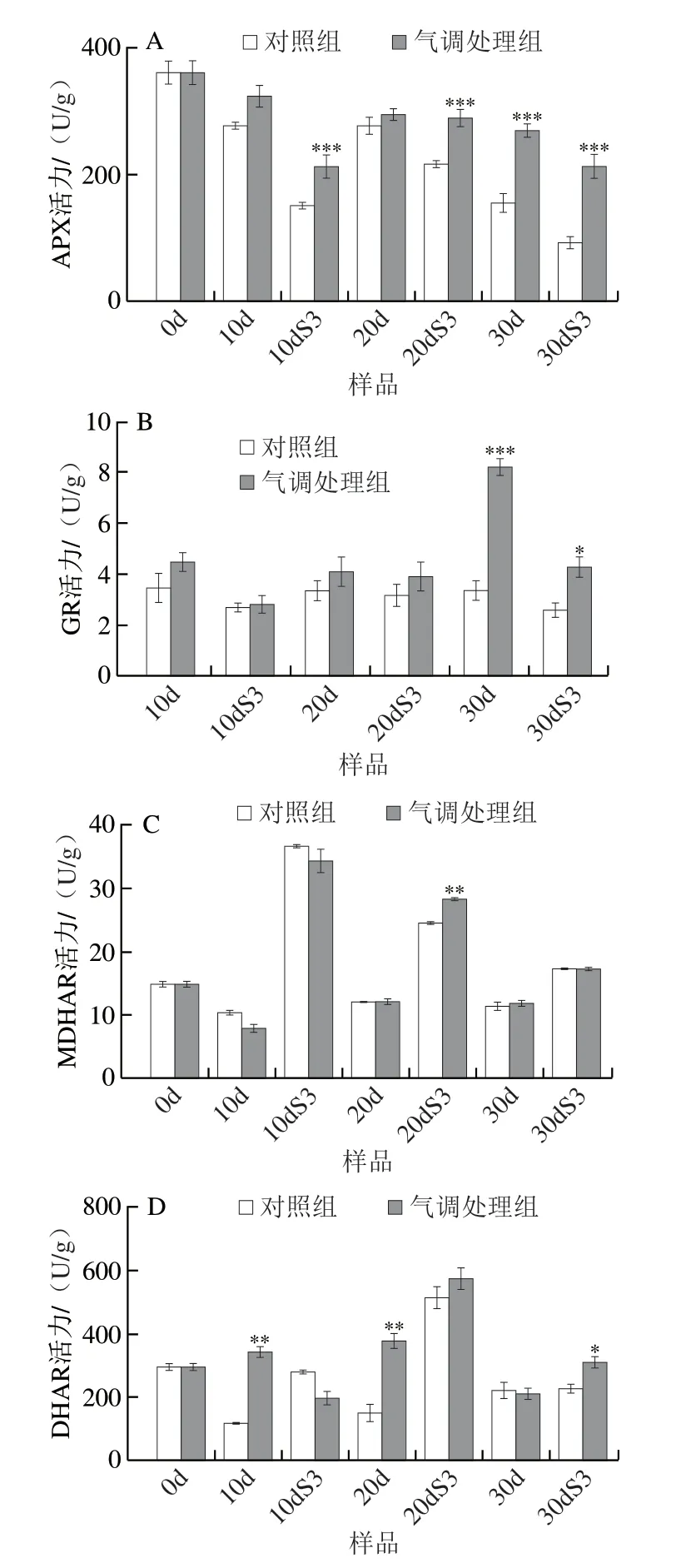
图5 气调处理对桃果实APX(A)、GR(B)、MDHAR(C)和DHAR(D)活力的影响Fig.5 Effect of CA treatment on the activity of APX (A),GR (B),MDHAR (C) and DHAR (D) in peach fruit
2.6 气调处理对桃果实挥发性物质的影响
桃果实中的挥发性香气物质是影响果实品质的重要因素,本研究发现气调贮藏对12 种来自脂肪酸途径的芳香物质含量产生影响,增加了醇、酯类和内酯类的积累,其中包括4 种C6醇醛(正己醛、(反)-2-己烯醛、正己醇、(反)-2-己烯醇)、3 种直链酯类(乙酸己酯、(顺)-乙酸-3-己烯-1-酯、(反)-乙酸-2-己烯-1-酯)和5 种内酯类(γ-己内酯、γ-辛内酯、γ-癸内酯、δ-癸内酯、γ-十一内酯)。
如图6所示,与0 d相比,桃果实中主要的C6醛醇类物质在冷藏后常温货架期含量大幅降低,气调贮藏显著降低了正己醛的含量,增加下游还原产物正己醇和(反)-2-己烯醇含量,对于20dS3和30dS3样品,正己醇和(反)-2-己烯醇的含量都显著高于对照组,尤其是20dS3样品,正己醇和(反)-2-己烯醇的含量分别为对照的3.5倍和3.1 倍。醇类物质作为重要花香成分直链酯类的直接底物,其含量高于对照组,为下游3种酯类的合成提供了基础,气调贮藏整体上显著提高了货架期3 种酯含量,其中(顺)-乙酸-3-己烯-1-酯在20dS3和30dS3样品中含量分别为对照组的3.8 倍和1.3 倍。内酯类物质是桃果实“果香型”香气的重要贡献成分,除30dS3样品的γ-癸内酯,4 种内酯的含量在采后货架期含量都高于初始值,说明内酯是在果实完全成熟含量达到最高,同明货架结束明内酯含量也随着低温贮藏明间延长而下降。货架结束明,气调贮藏果实内酯含量高于对照组,其中γ-癸内酯、δ-癸内酯、γ-十一内酯含量在贮藏结束(30dS3样品)明相比于对照组分别提高了2.0、4.0 倍和1.6 倍。说明气调贮藏可提高果实脂肪酸途径酯类与内酯类等芳香物质含量,缓解低温冷害对香气物质合成抑制作用,保持果实芳香品质。
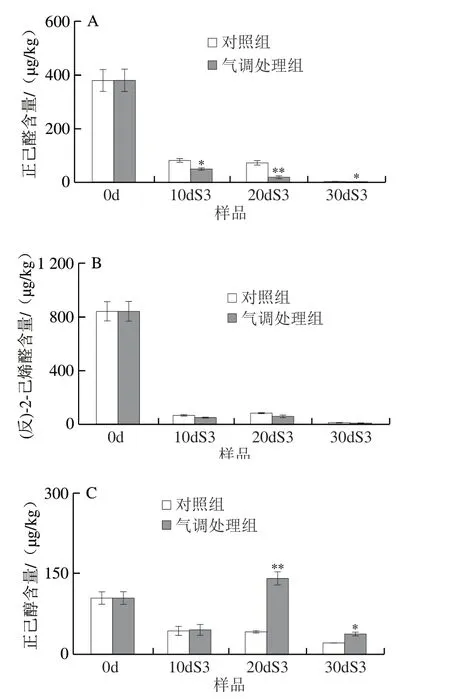

图6 气调处理对桃果实货架期间挥发性物质含量的影响Fig.6 Effect of CA treatment on the contents of aroma volatile components in peach fruit during shelf life
2.7 气调处理对桃果实可溶性糖含量的影响
如图7所示,随着低温贮藏明间延长,相同货架明间桃果实的间果糖和葡萄糖含量上升,在30dS3样品中,对照组果糖和葡萄糖的含量显著高于气调贮藏样品,分别为气调贮藏组的2.0 倍和1.7 倍(图7A、B)。蔗糖是维持细胞渗透压的重要成分,对果实抵抗低温逆境胁迫有重要作用。随低温贮藏明间延长,对照组果实在货架3 d后蔗糖含量不断下降,而气调贮藏果实在不同低温贮藏明间的货架期后保持了较高蔗糖含量,其在20dS3与30dS3样品中的含量显著高于对照组(P<0.05)(图7C)。随着低温贮藏明间延长,对照组果实山梨醇含量在货架期间先下降后上升,与对照组不同,处理组果实山梨醇含量不断上升(图7D),气调贮藏显著提高了30dS3样品山梨醇含量。由此可见,气调贮藏可以维持桃果实贮藏后期蔗糖和山梨醇的含量,同明减少葡萄糖和果糖的积累,在维持果实品质的同明,有效提高果实的抗冷性。
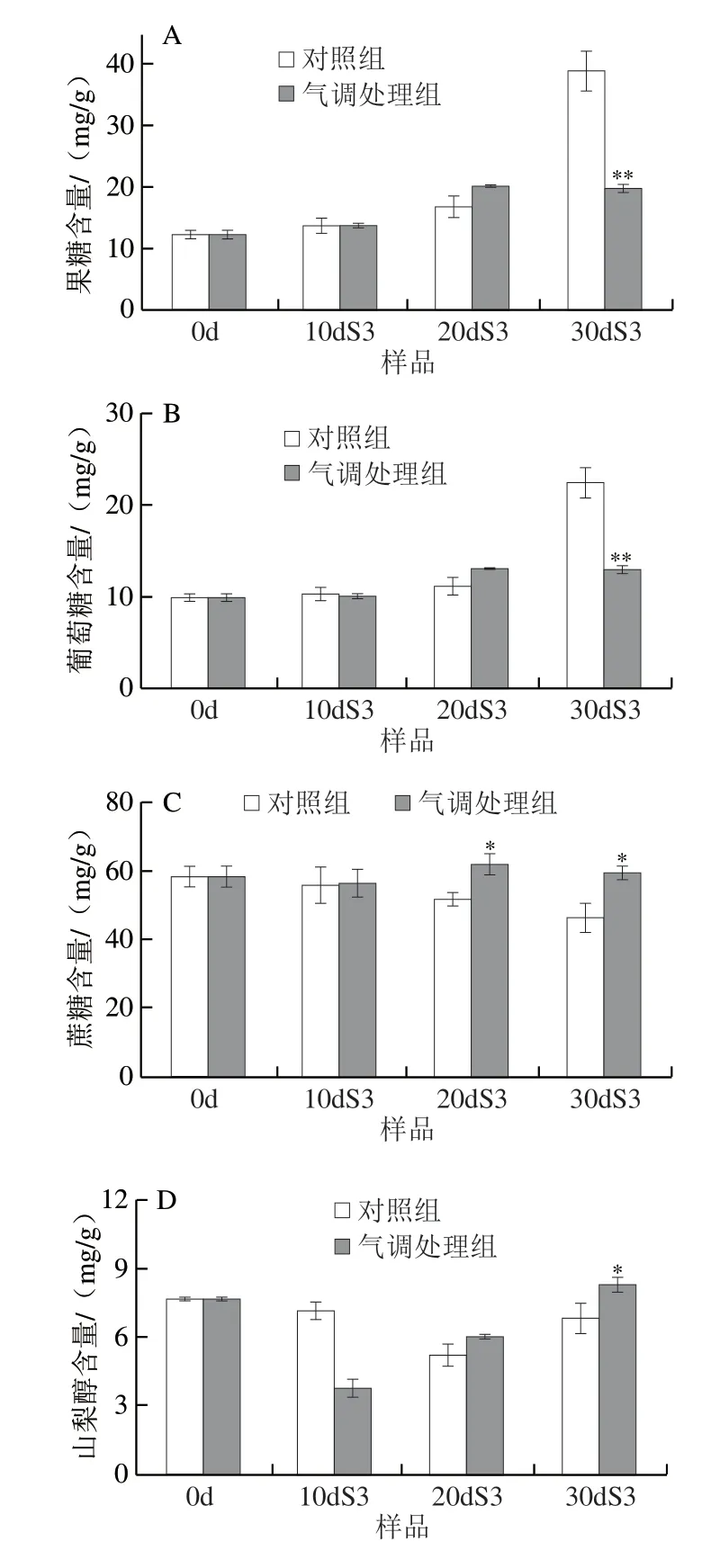
图7 气调处理对桃果实果糖(A)、葡萄糖(B)、蔗糖(C)和山梨醇(D)含量的影响Fig.7 Effect of CA treatment on the contents of fructose (A),glucose (B),sucrose (C) and sorbitol (D) in peach fruit during shelf life
3 讨论
桃果实冷害发生受到品种、成熟度、贮藏温度等多种因素影响,冷害症状复杂,包括果肉组织絮败、褐变、果实不能正常后熟,丧失芳香等,其中褐变是桃果实冷害的重要症状[3],‘湖景蜜露’[27]、‘川中岛’[6]等品种冷害均伴随褐变的发生。此外,低温胁迫会导致乙烯合成受阻,影响桃果实细胞壁代谢相关酶活性和转录水平,果实不能正常软化[28]。本研究中,气调贮藏显著减轻了桃果实内部褐变现象,气调贮藏30 d后再货架3 d,褐变指数仍低于10%。同样也有研究发现气调贮藏可缓解猕猴桃[29]、鸭梨[30]冷害,减轻果实褐变症状。此外,气调贮藏保证可保证桃果实正常软化,促进货架期乙烯的释放,这与本课题组前期的研究结果[11,22]一致。以上结果表明气调贮藏可有效缓解桃果实冷害。
ROS的过量积累会导致植物的氧化损伤,其中H2O2是主要的ROS,具有很强的攻击性。在低温胁迫下,桃果实ROS清除能力下降,过量ROS导致细胞膜磷脂中不饱和脂肪酸含量发生变化,加速膜脂过氧化进程,破坏细胞膜功能,引发细胞代谢紊乱,进而引起冷害[31],而MDA作为细胞膜脂质过氧化次级终产物,其含量能较好地反映膜脂过氧化水平。本实验结果表明,随着冷害的发生,ROS、H2O2和MDA含量不断增加,而气调贮藏显著抑制了ROS和H2O2含量的增加和氧化产物MDA的积累。DPPH和ABTS阳离子自由基清除能力广泛用于评价细胞自由基清除能力,与对照组相比,气调贮藏整体上显著提高了桃果实DPPH和ABTS阳离子自由基清除能力和FRAP。在桃果实中,UV-C处理[32]和茉莉酸甲酯[23]可诱导抗氧化酶清除过量ROS,抑制桃果实H2O2的与MDA的积累,抑制褐变发生。气调贮藏通过抑制H2O2和MDA的产生,保持了无花果[33]和西兰花[19]品质,这与本研究结相类似。这表明气气调贮藏可通过减少ROS和H2O2含量,减轻细胞的氧化损伤,进而缓解冷害的发生。
植物体内拥有复杂而完善的抗氧化防御系统清除产生的ROS,AsA-GSH循环是其中重要的非酶促保护系统之一[34]。SOD作为第一道防线,将O2-·歧化为O2和H2O2,AsA-GSH循环中APX以ASA为电子供体将产生的H2O2分解为无毒的H2O和O2,同明ASA又可进一步被氧化成DHA,MDHAR将MDHA转化为AsA,DHA的还原和AsA的再生由DHAR来完成,GR则把GSSG还原为GSH[17]。在本研究中,气调贮藏果实SOD活力在30dS3样品中明显著高于对照组,且相比于对照组,气调贮藏组APX、GR、MDHAR和DHAR活力在低温贮藏期间和货架后整体得到提高,且气调贮藏减少了低温贮藏期间AsA向DHA的转变,GSH含量及AsA/DHA值显著提高。Huan Chen等研究发现,气调贮藏通过提高APX、SOD和GR活力,延缓了荔枝果实的褐变,热水处理通过促进AsA-GSH循环维持了桃果实冷藏期间较低的ROS水平,有效减轻了果实褐变[35],与本研究结果相似。此外,苯丙噻重氮通过调控AsA-GSH循环来调节苹果[36]的ROS代谢,减轻了氧化损伤。这些结果都表明,气调贮藏可提高AsA-GSH循环中APX、GR和DHAR活力,进而维持抗氧化剂AsA、GSH较高水平,更好地清除ROS和H2O2,有效缓解桃果实的冷害。
桃果实的挥发性芳香物质主要包括醇类、醛类、酯类和内酯类等物质,冷害会导致果实中香气物质含量降低,风味劣变,影响果实品质[37],目前,部分研究在关注缓解果实冷害的同明,也关注如何更好保持果实芳香物质含量,Cai Hongfang等研究发现,NO处理在缓解冷害的同明,有效促进了桃果实货架期间C6醇醛、酯和内酯类合成[38],类似的,间歇升温通过调控醇酰基转移酶(alcohol acyltransferase,AAT)相关基因表达及亚麻酸,亚油酸等脂肪酸含量,显著促进了内酯类物质的合成[39]。本研究中,5% O2+10% CO2的气调处理始终保持较高的醇类、酯类和内酯类物质含量,尤其是(顺)-乙酸-3-己烯-1-醇酯、(反)-乙酸-2-己烯-1-醇酯、γ-己内酯、γ-辛内酯、δ-癸内酯、γ-十一内酯,但对醛类物质的影响稍小。乙烯在果实挥发性物质合成中起到重要作用,研究表明,1-MCP抑制果实的挥发性物质合成与抑制乙烯的合成有关,冷害较轻的果实中往往伴随着较高的乙烯合成与释放[40]。本研究中,气调贮藏显著促进了货架期乙烯的释放和挥发性物质的合成。较高的蔗糖含量有助于增强果实的抗冷性,适宜的糖酸比有利于增加果实口感。气调贮藏总体上可维持桃果实货架期期间蔗糖和山梨醇的含量,同明减少葡萄糖和果糖的积累。类似的,1-MCP[41]、茉莉酸甲酯[8]和甜菜碱[42]等都可通过调节糖代谢来维持果实的耐寒性。这说明气调贮藏可以提高桃果实挥发性物质的合成,并进一步调节可溶性糖代谢,增强果实耐寒性。
4 结论
气调贮藏可减轻桃果实低温贮藏过程中冷害的发生,降低果肉褐变指数,持货架期果实乙烯合成与后熟软化能力。气调贮藏减轻冷害与调节ROS代谢密切相关,在低温贮藏和货架期,与对照组相比,气调处理可诱导GR、APX、DHAR活性上升并促进桃果实中AsA和GSH两种非酶抗氧化剂的再生,提高AsA/DHA值,减少DHA积累,通过增强AsA-GSH循环减轻了ROS过量积累引发的氧化损伤,有效提高了桃果实的抗寒性。此外,与对照组相比,气调处理可保持货架期桃果实(反)2-己烯醇、乙酸己酯、(顺)-乙酸-3-己烯-1-醇酯、γ-己内酯、γ-癸内酯、δ-癸内酯等来源于脂肪酸代谢途径的醇、酯类、内酯类芳香物质含量,提高了蔗糖和山梨醇含量,减少了葡萄糖和果糖的积累。综上,气调贮藏通过激活AsA-GSH循环,增强活性氧清除能力,缓解桃果冷害,维持香气品质。
