奥马珠单抗治疗儿童过敏性疾病的安全性分析Δ
2024-01-03孙华君上海市儿童医院上海交通大学医学院附属儿童医院药学部上海200062
曾 娜,李 捷,孙华君 (上海市儿童医院/上海交通大学医学院附属儿童医院药学部,上海 200062)
近年来,随着环境、气候及生活方式等的变化,过敏性疾病的全球发病率呈上升趋势,影响着全球约40%的人群,已成为目前重点防治的疾病之一[1]。2016年,我国有40.9%的0~24月龄婴幼儿正在或既往出现过过敏症状,其过敏性疾病的总患病率为12.3%[2]。过敏性哮喘、变应性鼻炎、特应性皮炎、慢性荨麻疹及食物过敏等过敏性疾病严重影响了儿童的生活质量,甚至危及其生命,给其家庭和社会带来了沉重的精神和经济负担。
免疫球蛋白E(immunoglobulin E,IgE)介导的Ⅰ型过敏反应在过敏性疾病的发病过程中发挥着关键性的作用。奥马珠单抗是人源性抗IgE 单克隆抗体,可通过靶向结合血液循环中的游离IgE来下调效应细胞表面的IgE高亲和力受体,从而阻断IgE介导的过敏性炎症级联反应[3]。该药于2003年被美国FDA批准用于治疗IgE介导的儿童(≥6 岁)和成人中、重度持续性过敏性哮喘,2014年被批准用于治疗>12岁人群慢性荨麻疹,2020年被批准用于治疗成人鼻息肉。奥马珠单抗于2018年在我国获批上市,用于治疗≥6岁儿童的中、重度哮喘。尽管有临床研究证实了奥马珠单抗用于儿童过敏性疾病的有效性和安全性[4-5],但由于该药在我国上市时间较短,加之其获批适应证有限且临床应用经验不足,因此该药的安全性受到临床的广泛关注。此外,2007年美国FDA要求在奥马珠单抗说明书中标注过敏反应黑框警告。考虑到国内鲜有关于儿童人群使用奥马珠单抗长期安全性的研究报道,本研究拟分析该药用于儿童过敏性疾病的短期和长期安全性,旨在为该药的临床应用提供参考。
1 资料与方法
1.1 资料来源
通过医院信息系统,收集2019年2月-2023年7月于我院接受奥马珠单抗治疗的过敏性疾病患儿的临床资料。本研究方案经医院伦理委员会批准,伦理审查批件号为2023R081-E01。
1.2 纳入与排除标准
纳入标准包括:(1)年龄6~18岁;(2)符合中国儿童各种过敏性疾病的诊断标准。排除标准包括:对奥马珠单抗活性成分或其他任何辅料有过敏反应的患儿。
1.3 资料提取
本研究采用医院集中监测法进行调查分析,收集患儿的基本情况(包括性别、年龄等)、过敏原检测结果、血清总IgE 水平、奥马珠单抗应用情况和不良事件发生情况;同时,针对治疗结束患儿收集停药后第12个月的电话随访信息。
1.4 不良反应判定标准
参考《药物过敏诊断和预防方案中国专家共识》[6],按反应出现时间的长短分为速发型(用药后到症状发作1~6 h)和迟发型(用药后到症状发作>6 h)超敏反应;根据患儿症状严重程度和最终结局将超敏反应的风险等级分为I~Ⅳ度。根据Naranjo 评估量表[7],不良事件与药品的因果关系包括“肯定”“很可能”“可能”“可疑”,本研究将“肯定”“很可能”“可能”判定为奥马珠单抗不良反应。
1.5 数据处理
本研究采用描述性分析,非正态分布计量资料以M(P25,P75)表示,计数资料以例数或率表示。
2 结果
2.1 患儿的一般情况
本研究共收集到30 例患儿资料,其中男性18 例(60.0%)、女性12例(40.0%);年龄为9.8(8.4,11.5)岁;过敏性疾病类型以过敏性哮喘(90.0%)为主,其中有19例(63.3%)同时患有≥2 种过敏性疾病;30 例患儿的血清特异性过敏原检测均为阳性,过敏原以屋尘螨/粉尘螨最多(93.3%);30 例患儿的血清总IgE 水平为560(288,1 030)IU/mL。结果见表1(同一患儿可能同时存在多种过敏原)。
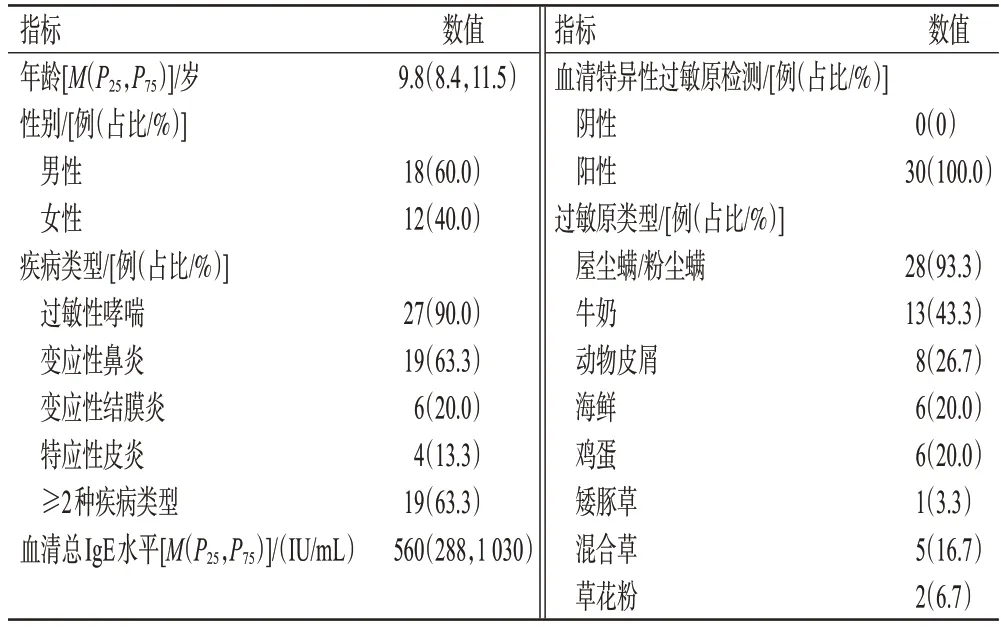
表1 患儿的一般情况(n=30)
2.2 奥马珠单抗应用情况
我院患儿奥马珠单抗的初始用药剂量是依据相关诊疗指南[8-9]、奥马珠单抗药品说明书并结合临床经验而制定的,其中26例为150 mg皮下注射,1例为225 mg皮下注射,3例为300 mg皮下注射;经主管医师评估,所有患儿均根据症状变化调整用药剂量和频次。
截至2023年7月,30例患儿共皮下注射奥马珠单抗245次,其中男性141次(57.6%),女性104次(42.4%);接受150 mg剂量63次,225 mg剂量21次,300 mg剂量119次,375 mg 剂量8 次,450 mg 剂量30 次,600 mg 剂量4次,累计注射473 针次(超过150 mg,至少分为2 针次用药)。
30 例患儿中,有3 例治疗不足16 周即终止治疗,其中1例因速发型超敏反应终止,2例因疗效不确切终止。
2.3 不良反应发生情况
30例患儿中,有4例发生了4例次速发型超敏反应,发生率为13.3%;其中,Ⅰ度2 例次,Ⅱ度2 例次。结果见表2。

表2 4例患儿的基本情况
患儿1,男性,于首次注射奥马珠单抗后即刻发生速发型超敏反应(Ⅱ度),表现为突发四肢瘫软,唇色发白,但无抽搐。临床予以吸氧处理并行心电指脉氧监护,此时心率为45~60 次/min,呼吸为18 次/min,氧饱和度为100%,血压为45/93 mmHg(1 mmHg=0.133 kPa),血糖为5.4 mmol/L。患儿上述症状约15 s 后自行缓解,患儿意识清楚,可回答问题。随后,临床给予0.9%氯化钠注射液250 mL 静脉滴注,地氯雷他定干混悬剂5 mg 口服抗过敏治疗;10 min 后复测患儿血压为66/110 mmHg,口唇红润,精神反应可,呼吸平稳,全身无皮疹,持续监测2 h,病情平稳后准予出院,后续未再使用奥马珠单抗。该患儿既往无过敏史,用药前未服用其他药物和特殊食物,根据Naranjo 评估量表判定其速发型超敏反应与奥马珠单抗的因果关系为“很可能”。
患儿2,女性,于首次注射奥马珠单抗后1 h 发生速发型超敏反应(Ⅱ度),表现为喘息伴气促、胸闷明显,呈端坐呼吸,稍烦躁且言语不成句,未吸氧下的氧饱和度为90%,双肺闻及哮鸣音。临床立即予以三联雾化(吸入用布地奈德混悬液1 mg+吸入用硫酸沙丁胺醇溶液5 mg+吸入用异丙托溴铵溶液0.25 mg)、吸氧等对症治疗后缓解。约1 h后,停氧监测示患儿氧饱和度>95%,心率为80~90次/min,持续监测2 h,病情平稳后出院。该患儿既往无过敏史,当天早上8点服用了醋酸泼尼松片10 mg(剂量由20 mg,qd 减至10 mg,qd,为减量的第1天),10点注射奥马珠单抗后1 h出现哮喘急性发作。该患儿后续再次使用奥马珠单抗后未再出现类似反应,根据Naranjo评估量表判定哮喘急性发作与奥马珠单抗的因果关系为“可能”。
患儿3,男性,于第5次注射奥马珠单抗(停药9个月后首次用药)后即刻发生速发型超敏反应(Ⅰ度),表现为头晕、心率下降,心率为37~62次/min,持续约15 s后自行缓解,未予干预;随后,心率逐渐恢复至72 次/min,血压为110/65 mmHg,持续监测2 h,病情平稳后出院,后续未再使用奥马珠单抗。该患儿既往无过敏史,用药前也没有服用其他药物和特殊食物,且前4次使用奥马珠单抗后均未发生不良事件,根据Naranjo 评估量表判定头晕和心率下降与奥马珠单抗的因果关系为“很可能”。
患儿4,男性,于第3 次注射奥马珠单抗后2 h 发生速发型超敏反应(Ⅰ度),表现为口腔疼痛;临床检查口腔未见疱疹和溃疡,故未予处理。出院后,予以开喉剑喷雾剂对症治疗。该患儿后续再次使用奥马珠单抗后未再出现类似反应,根据Naranjo 评估量表判定口腔疼痛与奥马珠单抗的因果关系为“可能”。
2.4 随访情况
30 例患儿中,有9 例患儿仍在奥马珠单抗治疗期间,21例患儿结束奥马珠单抗治疗。停药后12个月,对这21例患儿进行的电话随访结果显示,患儿身体状况良好,未发生恶性肿瘤、蠕虫感染、血清病样反应、动脉血栓栓塞等不良反应。
3 讨论
IgE介导的过敏反应是儿童过敏性疾病发生的主要发病机制,是过敏性疾病临床治疗的重要靶点。奥马珠单抗是重组DNA 衍生的人源化单克隆抗体,能够特异性地结合IgE 分子的恒定区,并剂量依赖性地降低血液中游离IgE水平,抑制IgE与肥大细胞、嗜碱性粒细胞等效应细胞表面的高亲和力IgE 受体结合,减少炎症细胞的激活和炎症介质的释放,从而阻断炎症级联反应的发生,改善患者的过敏症状[8];此外,游离IgE的减少还可直接导致高亲和力IgE 受体表达下调,进一步阻止效应细胞活化[10]。由此可见,奥马珠单抗可多途径减缓和阻断过敏性变态反应的发生,是可用于IgE 介导的过敏性疾病治疗的靶向药物。
有研究报道,在抗IgE治疗的过程中,奥马珠单抗几乎不会引起其他有害的免疫应答,不会产生溶细胞作用和明显的不良反应,使用后的不良反应发生率和类型与安慰剂相似,且不随治疗时间的延长而增加[11]。2019年,欧洲药品管理局公布的奥马珠单抗相关不良反应报告提及,≥12岁青少年以注射部位头痛、肿胀、红斑和瘙痒较为常见,还可出现轻微关节痛、疲劳、头晕等;6~<12岁儿童以头痛、发热和上腹痛较为常见。国内一项针对15例中、重度过敏性哮喘患儿的临床研究显示,患儿在接受奥马珠单抗治疗期间(共16 周),1 例出现一过性头痛,2例出现一过性皮疹[12]。一项纳入49例≥12岁中、重度过敏性哮喘患儿的临床研究显示,在为期16周的治疗时间内,上述患儿共注射了奥马珠单抗208针次,共累计发生不良反应5次,其中1例15岁患儿在首次用药(剂量600 mg)后2 h 即出现了大汗、头晕、恶心,并发生了继发性高血压[13]。另一项临床研究纳入了23 例过敏性疾病患儿,其累计注射奥马珠单抗92 针次,仅1 例17岁过敏性哮喘合并变应性鼻炎患儿在首次注射(剂量300 mg)和第3次注射(剂量300 mg)1 h后出现了皮肤瘙痒,上述症状均自行缓解[14]。本研究纳入的30 例患儿中,4 例发生了4 例次速发型超敏反应,根据Naranjo 评估量表分析,2例很可能为奥马珠单抗所导致,2例可能由奥马珠单抗引起,其临床表现与国外报道一致[15]。本研究观察到的4例次速发型超敏反应的临床表现尚未有相关报道。由于奥马珠单抗由5%的小鼠多肽组成,因此对于人体而言属于异种蛋白,不能排除抗奥马珠单抗抗体产生的可能,理论上也存在针对小鼠序列发生IgE介导速发型超敏反应的可能。目前尚未在接受奥马珠单抗治疗的患者中测得抗奥马珠单抗的抗体。有研究认为,这可能是奥马珠单抗制剂中添加了聚山梨酯等特定辅料而引起的速发型超敏反应[16]。奥马珠单抗引起速发型超敏反应的具体机制仍有待进一步研究。
单克隆抗体药物属于蛋白制剂,具有免疫原性和抗体活性双重特性,较高的免疫原性可致患者发生过敏反应。过敏反应通常是速发反应,但奥马珠单抗诱发的不良反应发生时间分布跨度大,且同一个患者可发生多次[17]。本研究中,4 例患儿的发生时间均为注射奥马珠单抗后2 h 内,这与国外报道相吻合[18],其中有2 例分别发生在第3 次和第5 次用药后。因此,在使用奥马珠单抗时,临床应加强患儿药学监护,用药后应持续观察2 h。停药后12 个月的随访结果显示,奥马珠单抗用药后的长期安全性较好。
此外,张红盼等[17]研究发现,奥马珠单抗引起的血清病样反应、皮肌炎、静脉血栓等严重不良反应多发生在用药3个月后。奥马珠单抗药品说明书明确指出,过敏反应可发生于首次注射后,也可发生在治疗1年后;其他原因(如食物、花草或药物等)导致的过敏史被认为是使用奥马珠单抗发生过敏反应的危险因素。因此,在应用奥马珠单抗之前,临床应详细询问患儿的既往过敏史,充分评估不良反应发生风险,并做好严重不良反应的预防措施,还应加强对长期用药者严重不良反应的监测,以确保患儿用药安全。
综上所述,奥马珠单抗用于儿童过敏性疾病的不良反应发生率较低,多为速发型超敏反应,且以轻度为主,长期用药的安全性较好。本研究存在的局限性为纳入的样本量有限且观察时间较短,后续将扩大样本量,持续随访,以全面分析奥马珠单抗在我国儿童人群中的安全性。
