飞龙掌血对胶原诱发关节炎大鼠心血管损害的干预作用及机制Δ
2024-01-03李月兴陈波洋陈云志贵州中医药大学基础医学院贵阳550025
李月兴,陈波洋,李 倩,陈 帅,陈云志 (贵州中医药大学基础医学院,贵阳 550025)
类风湿性关节炎(rheumatoid arthritis,RA)是一种全身性自身免疫性疾病,除累及关节外,还涉及血管炎、心脏病、类风湿结节等众多关节外表现[1]。临床数据显示,多数RA 患者兼有包括动脉粥样硬化、心肌梗死等在内的心血管并发症,故死亡风险较高[2]。中性粒细胞是RA患者关节滑液中含量较高的免疫细胞,在受炎症因子、活性氧等异物刺激后,可活化为中性粒细胞胞外诱捕网(neutrophil extracellular traps,NETs)。NETs作为一种被瓜氨酸化组蛋白H3(citrullinated histone H3,CitH3)、髓过氧化物酶(myeloperoxidase,MPO)等颗粒蛋白修饰的DNA网状物,有助于机体炎症的控制;但当体内NETs含量过高时,跟随其释放到细胞外的组蛋白和蛋白酶等会加剧RA患者的免疫紊乱,并破坏内皮细胞,从而造成循环系统损害[3]。
维生素D(vitamin D,VD)是体内磷钙代谢的关键信号分子,可在RA 等多种自身免疫性疾病中发挥免疫调节作用。25-羟基维生素D3[25-hydroxyvitamin D3,25(OH)D3]是VD的血清标志物,可在25-羟基维生素D-1α羟化酶(25-hydroxyvitamin D-1α-hydroxylase,CYP27B1)的催化下转化成VD的主要活性形式--1α,25-二羟基维生素D3[1α,25-dihydroxy-cholecalciferol,1α,25(OH)2D3],与维生素D受体(vitamin D receptor,VDR)结合,参与炎症控制、心血管保护等生物学过程[4]。研究显示,血清VD 水平与RA、心血管疾病的发病风险呈负相关[5-6];补充VD 可延缓RA 的进展,并可通过抑制NETs 关键酶--还原型烟酰胺腺嘌呤二核苷酸磷酸(reduced nicotinamide adenine dinucleotide phosphate,NADPH)氧化酶的形成而起到保护血管内皮的作用[5-7]。
飞龙掌血为芸香科植物飞龙掌血Toddaliaasiatica(L.)Lam.的干燥根皮,是我国贵州、云南等地的常用民族药材。该药性温,味辛、微苦,可散瘀止血、祛风除湿、消肿解毒,常用于治疗风湿痹症[8]。研究表明,飞龙掌血能通过平衡调节性T 细胞和辅助性T 细胞17(T helper cell 17,Th17)的表达来调控白细胞介素17(interleukin-17,IL-17)、单核细胞趋化蛋白1(monocyte chemotactic protein-1,MCP-1)、超氧化物歧化酶(superoxide dismutase,SOD)等炎症及氧化应激指标的分泌/表达,从而发挥对关节炎及相关心血管疾病的改善作用[9-11]。有研究指出,Th17、IL-17、MCP-1、SOD 等炎症、氧化应激指标编码基因的表达与VD、NETs存在一定的关联[12-14],但飞龙掌血能否通过VD 和NETs 来调控RA 患者相关炎症、氧化应激指标的分泌/表达,进而影响其心血管损害的作用过程尚不明晰。基于此,本研究拟从VD和NETs的角度出发,初步探讨飞龙掌血对胶原诱发关节炎(collagen-induced arthritis,CIA)模型大鼠心血管损害的干预效果及潜在机制,以期为飞龙掌血在RA 并发症中的临床应用提供参考。
1 材料
1.1 主要仪器
Multiskan MK3 型酶标仪购自美国Thermo Fisher Scientific 公司;DYY-7C 型电泳仪电源、DYCZ-24DN 型垂直电泳槽均购自北京六一仪器厂;RM2016 型轮转式切片机购自德国Leica公司;JB-P5型包埋机购自武汉俊杰电子有限公司;BX53 型生物显微镜购自日本Olympus公司。
1.2 主要药品与试剂
飞龙掌血药材(批号210301)购自贵阳市德昌祥药房,由贵州中医药大学药学院蒋志滨副教授鉴定为芸香科植物飞龙掌血T.asiatica(L.)Lam.的干燥根皮。甲氨蝶呤片(阳性对照药,批号036210906,规格2.5 mg)购自上海上药信谊药厂有限公司;牛Ⅱ型胶原(货号L22S11C125306)购自上海源叶生物科技有限公司;弗氏不完全佐剂(货号SLCH4885)购自美国Sigma-Aldrich公司;VD 滴剂(通路验证试剂,批号129214211,规格为每粒含VD3400 单位)购自国药控股星鲨制药(厦门)有限公司;MPO、IL-6、25(OH)D3酶联免疫吸附测定(ELISA)试剂盒(批号分别为ML-E-20221022710、MLE-20221023761、ML-E-20221022898)均购自上海酶联生物科技有限公司;兔甘油醛-3-磷酸脱氢酶(GAPDH)多克隆抗体(批号AB-P-R001)购自杭州贤至生物科技有限公司;兔CYP27B1、MPO 多克隆抗体(批号分别为PB0577、BA0544)均购自武汉博士德生物工程有限公司;兔CitH3多克隆抗体、兔VDR单克隆抗体(批号分别为NB100-57135、NBP2-66778)均购自美国Novus Biologicals 公司;兔IL-6 多克隆抗体(批号DF6087)购自美国Affinity公司;兔肽酰基精氨酸脱亚氨酶4(peptidylarginine deiminase 4,PAD4)单克隆抗体(批号ab214810)购自英国Abcam公司;辣根过氧化物酶(HRP)标记的羊抗兔IgG 二抗(批号A0208)购自碧云天生物技术有限公司。
1.3 实验动物
本研究所用实验动物为8 周龄的SPF 级雌性SD 大鼠(70只),体重为(200±10)g。所有动物均购自并饲养于贵州中医药大学实验动物研究所,动物生产许可证号为SCXK(黔)2021-0003。本实验方案经贵州中医药大学实验动物伦理审查委员会批准,编号为20210100。
2 方法
2.1 飞龙掌血药液的制备
取飞龙掌血药材,共3 份,分别以8 倍水浸泡0.5 h后,煎煮30 min×2 次;合并提取液,过滤,浓缩,得质量浓度分别为0.054、0.108、0.216 g/mL(以生药量计)的药液,备用。
2.2 分组、造模与给药
将大鼠随机分为正常组(9只)和造模组(61只)。取造模组大鼠,按如下方法[15]造模:将牛Ⅱ型胶原用乙酸溶解制成胶原溶液(2 mg/mL)后,与弗氏不完全佐剂等体积混合,制得胶原乳液。于实验第0天在大鼠背部、尾根部和双足进行多点注射(每处0.1 mL),即初次免疫;于第7 天在其背部、尾根部不同部位再次注射(每处0.1 mL),即二次免疫。于造模后(第8 天)随机选择数只大鼠进行关节炎指数评分--无皮肤发红和关节肿胀症状,记0 分;脚踝或足部轻微发红、肿胀,记1 分;脚踝和足部均轻微发红、肿胀,记2分;脚踝和跖骨关节中度发红、肿胀,记3分;全足严重发红、肿胀,记4分;尾部红斑和前肢肿胀各记0.5 分;总分为5 分,评分大于4 分则判定为CIA模型复制成功[16]。
将造模成功的54只大鼠随机分为模型组,甲氨蝶呤组(阳性对照,1.5 mg/kg,每周2次,剂量参考相关文献[17]设置),VD组[通路验证,1 000单位/(kg·d),每天1次,剂量参考相关文献[18]设置],飞龙掌血低、中、高剂量组[0.54、1.08、2.16 g/(kg·d),以生药量计,每天1 次,剂量参考成人临床常用剂量并根据大鼠体表面积折算而得,中剂量为临床等效剂量],每组9只。各药物组大鼠灌胃相应药液,正常组和模型组大鼠灌胃等体积生理盐水(每天1次),连续4周。
2.3 大鼠足跖肿胀情况观察及取材
造模后,于给药前对各组大鼠进行关节炎指数评分,并分别于给药前和末次给药后用游标卡尺测量大鼠右后肢足跖厚度。测量结束后,以1%戊巴比妥钠麻醉大鼠,取其腹主动脉血,静置后以3 000 r/min 离心15 min,收集上层血清,于-80 ℃下保存,备测。取血后,处死各组大鼠,快速收集其左后肢踝关节组织,以4%多聚甲醛固定,右后肢踝关节于-80 ℃下保存,备测;取大鼠心脏组织,横切一分为二,上部于-80 ℃下保存,下部以4%多聚甲醛固定,备测;取大鼠腹主动脉组织,以4%多聚甲醛固定,备测。
2.4 大鼠踝关节、心脏及腹主动脉组织的病理学观察
采用苏木精-伊红(hematoxylin-eosin,HE)染色法观察。取“2.3”项下每组5只大鼠以4%多聚甲醛固定的踝关节组织适量,脱钙后依次以75%、85%、95%、100%乙醇梯度脱水,经石蜡包埋后切片,再依次用苏木精、伊红染色,经二甲苯透明后,以中性树胶封片,使用显微镜对其踝关节进行组织形态学观察及图像采集。
取“2.3”项下每组5只大鼠以4%多聚甲醛固定的心脏和腹主动脉组织各适量,按前述方法脱水、包埋、切片、染色、透明后封片,使用显微镜对其心脏及腹主动脉进行组织形态学观察及图像采集。
2.5 大鼠血清中MPO、IL-6、25(OH)D3含量检测
采用ELISA 法检测。随机选取每组5 只大鼠冻存的血清样本,按照相应试剂盒说明书方法操作,使用酶标仪检测其血清中MPO、IL-6、25(OH)D3含量。
2.6 大鼠心脏组织中PAD4、VDR蛋白表达水平检测
采用免疫组织化学(immunohistochemistry,IHC)法检测。取“2.4”项下每组3只大鼠的心脏组织切片,经枸橼酸抗原修复溶液孵育15 min 后,以山羊血清封闭,滴加PAD4、VDR 一抗(稀释比例均为1∶100),于4 ℃下孵育过夜;用磷酸盐缓冲液清洗3次后,加入相应二抗,室温孵育30 min;再次清洗后,以DAB 显色液显色,再以Mayer’s 苏木精复染,经乙醇梯度脱水后,以二甲苯透明,风干后封片,使用显微镜进行观察。采用Image-Pro Plus 6.0 软件对IHC 图进行光密度分析,计算阳性区域(即黄褐色或棕褐色区域)的平均光密度用以表示PAD4、VDR蛋白的表达水平。
2.7 大鼠心脏组织中CitH3、MPO、IL-6、CYP27B1 蛋白表达水平检测
采用Western blot 法检测。取“2.3”项下每组3 只大鼠的冻存心脏组织,解冻后剪取适量,用含PMSF 的裂解液匀浆后,于冰上裂解30 min,在4 ℃下以12 000 r/min离心5 min,取上清液,使用BCA法测定蛋白浓度并作变性处理。取变性蛋白适量,进行聚丙烯酰胺凝胶电泳(电压依次为80、120 V)分离并转膜(电流为200 mA),用脱脂奶粉封闭;洗膜后,加入CitH3、MPO、IL-6、CYP27B1、GAPDH一抗(稀释比例均为1∶1 000),于4 ℃下孵育过夜;洗膜后,加入相应二抗(稀释比例为1∶600),室温孵育2 h;洗膜后,加入化学发光试剂进行显影并成像。使用Image-Pro Plus 6.0软件分析条带灰度值,以目的蛋白与内参蛋白(GAPDH)的灰度值比值表示目的蛋白的表达水平。
2.8 统计学方法
采用SPSS 26.0软件对数据进行统计分析。所有数据均以±s表示,符合正态分布数据的多组间比较采用单因素方差分析,组间两两比较采用LSD-t检验;不符合正态分布数据的多组间比较采用Kruskal-Wallis检验,组间两两比较采用Bonferroni检验。检验水准α=0.05。
3 结果
3.1 飞龙掌血对CIA模型大鼠足跖肿胀度的影响
正常组大鼠四肢未见明显红肿。与正常组比较,大鼠在造模完成后足跖肿胀明显,关节炎指数评分和足趾厚度均显著增加(P<0.01)。与模型组比较,经药物干预后,甲氨蝶呤组、飞龙掌血中剂量组大鼠的足跖厚度均显著减少(P<0.01);VD组大鼠的足趾厚度虽有所减少,但与模型组比较差异无统计学意义(P>0.05)。结果见表1、图1。
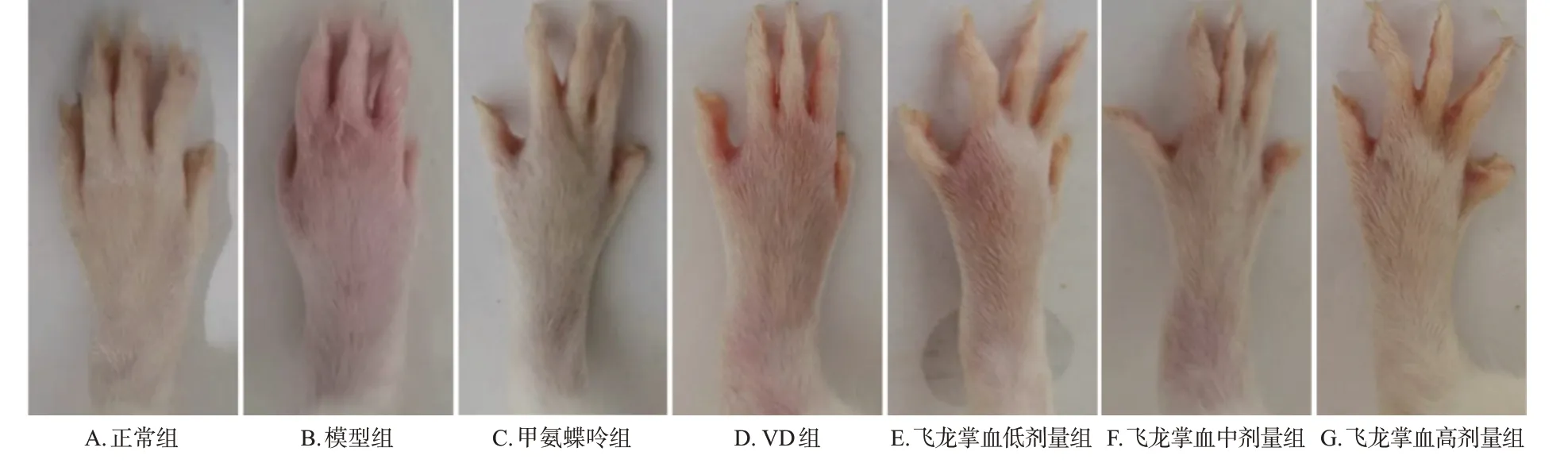
图1 各组大鼠的足部照片
表1 各组大鼠关节炎指数评分和足跖厚度比较(±s,n=9)
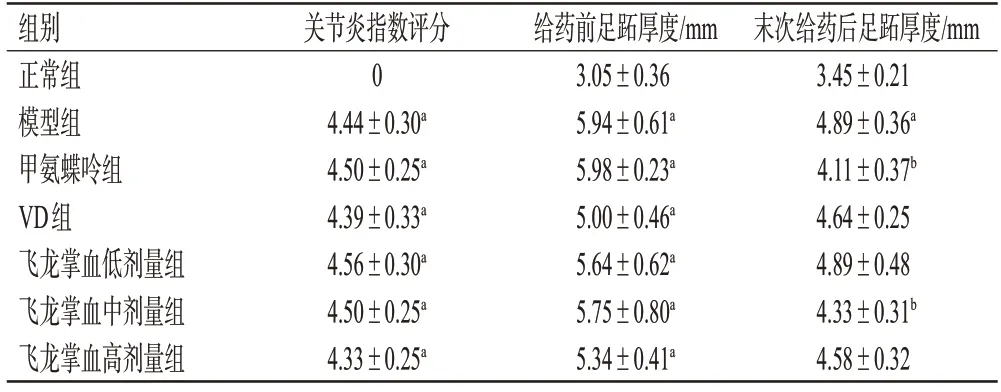
表1 各组大鼠关节炎指数评分和足跖厚度比较(±s,n=9)
a:与正常组比较,P<0.01;b:与模型组比较,P<0.01。
组别正常组模型组甲氨蝶呤组VD组飞龙掌血低剂量组飞龙掌血中剂量组飞龙掌血高剂量组关节炎指数评分0 4.44±0.30a 4.50±0.25a 4.39±0.33a 4.56±0.30a 4.50±0.25a 4.33±0.25a给药前足跖厚度/mm 3.05±0.36 5.94±0.61a 5.98±0.23a 5.00±0.46a 5.64±0.62a 5.75±0.80a 5.34±0.41a末次给药后足跖厚度/mm 3.45±0.21 4.89±0.36a 4.11±0.37b 4.64±0.25 4.89±0.48 4.33±0.31b 4.58±0.32
3.2 飞龙掌血对CIA模型大鼠踝关节、心脏、腹主动脉组织病理形态的影响
3.2.1 踝关节组织
正常组大鼠踝关节滑膜组织结构清晰完整;模型组大鼠踝关节组织衬里下层可见明显的炎症细胞(以淋巴细胞为主)浸润和纤维组织增生(以成纤维细胞、纤维细胞增多为主);甲氨蝶呤组和VD组大鼠衬里下层的炎症细胞浸润较模型组明显减少,飞龙掌血各剂量组大鼠的上述症状较模型组有不同程度好转,且以中剂量组效果最佳(仅在衬里下层观察到极少量炎症细胞浸润和纤维组织增生)。结果见图2。
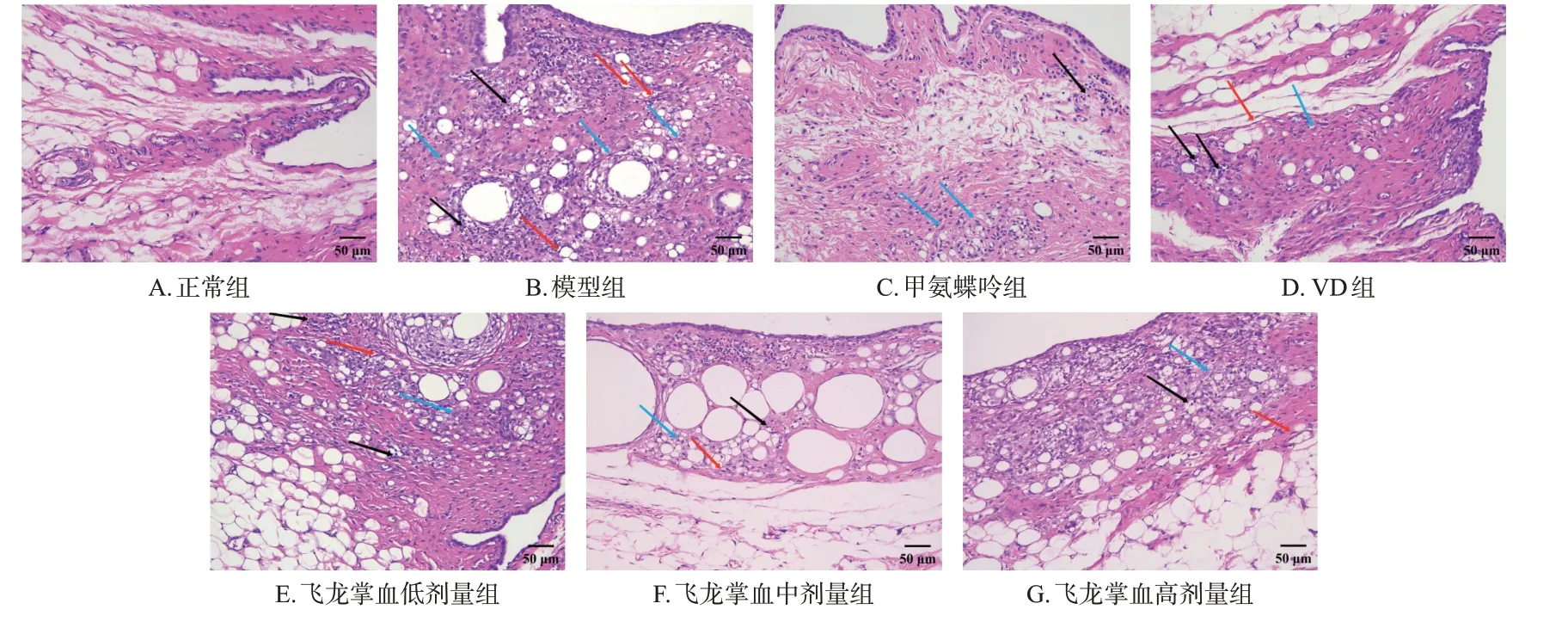
图2 各组大鼠踝关节组织病理学观察的显微图(HE染色)
3.2.2 心脏组织
正常组大鼠的心肌纤维走向明确,排列整齐;模型组大鼠有极少的心肌纤维排列紊乱,可见明显的组织空泡和部分周围血管壁增厚;各药物组大鼠心脏组织的上述损伤有不同程度减轻,且以甲氨蝶呤组和飞龙掌血中剂量组效果较佳。结果见图3。
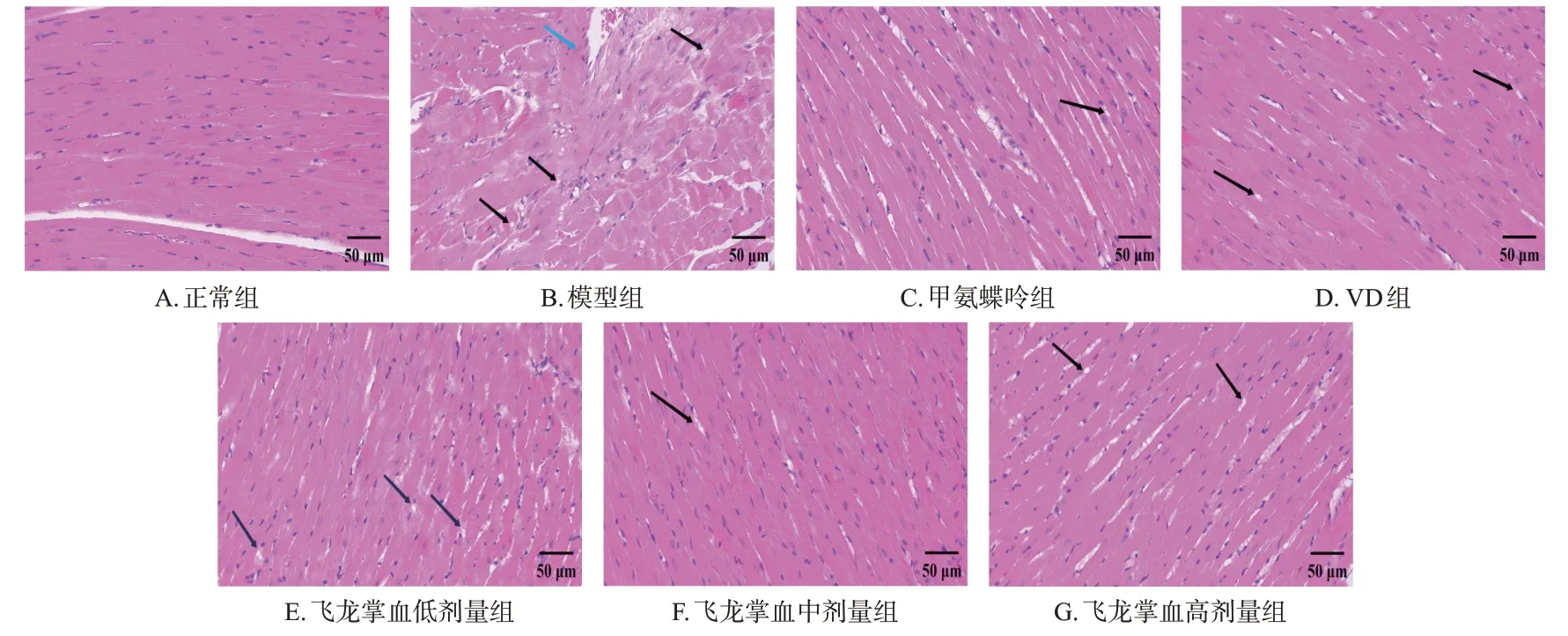
图3 各组大鼠心脏组织病理学观察的显微图(HE染色)
3.2.3 腹主动脉组织
正常组大鼠腹主动脉内皮完整,结构清晰;模型组大鼠腹主动脉组织可见内皮脱落;甲氨蝶呤组、飞龙掌血各剂量组大鼠腹主动脉组织可见不同程度的内皮脱落、中膜增厚、弹性纤维断裂,而VD 组大鼠则未见上述改变。结果见图4。
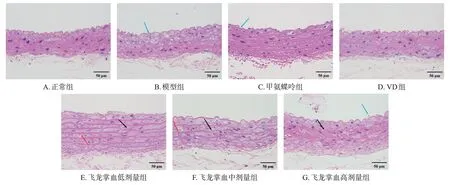
图4 各组大鼠腹主动脉组织病理学观察的显微图(HE染色)
3.3 飞龙掌血对CIA 模型大鼠血清中MPO、IL-6、25(OH)D3含量的影响
与正常组比较,模型组大鼠血清中MPO、IL-6 含量显著升高,25(OH)D3含量显著降低(P<0.01);与模型组比较,VD 组、飞龙掌血中剂量组大鼠血清中MPO 含量,以及各药物组大鼠血清中IL-6 含量(飞龙掌血低剂量组除外)均显著降低,各药物组大鼠血清中25(OH)D3含量(飞龙掌血低剂量组除外)均显著升高(P<0.05或P<0.01)。结果见表2。
表2 各组大鼠血清中MPO、IL-6、25(OH)D3含量比较(±s,n=5)
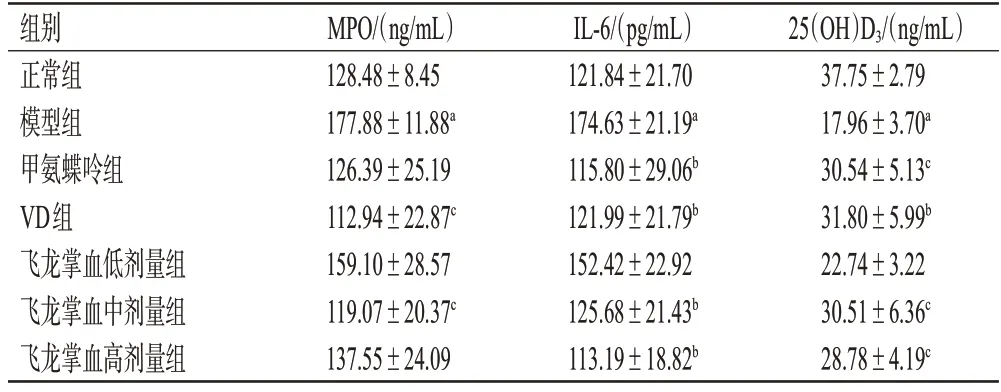
表2 各组大鼠血清中MPO、IL-6、25(OH)D3含量比较(±s,n=5)
a:与正常组比较,P<0.01;b:与模型组比较;P<0.01;c:与模型组比较,P<0.05。
组别正常组模型组甲氨蝶呤组VD组飞龙掌血低剂量组飞龙掌血中剂量组飞龙掌血高剂量组MPO/(ng/mL)128.48±8.45 177.88±11.88a 126.39±25.19 112.94±22.87c 159.10±28.57 119.07±20.37c 137.55±24.09 IL-6/(pg/mL)121.84±21.70 174.63±21.19a 115.80±29.06b 121.99±21.79b 152.42±22.92 125.68±21.43b 113.19±18.82b 25(OH)D3/(ng/mL)37.75±2.79 17.96±3.70a 30.54±5.13c 31.80±5.99b 22.74±3.22 30.51±6.36c 28.78±4.19c
3.4 飞龙掌血对CIA模型大鼠心脏组织中PAD4、VDR蛋白表达的影响
与正常组比较,模型组大鼠心脏组织中PAD4 蛋白的表达显著增强(P<0.01),而VDR 蛋白的表达略有上调,但差异无统计学意义(P>0.05);与模型组比较,甲氨蝶呤组、VD 组和飞龙掌血高剂量组大鼠心脏组织中PAD4 蛋白的表达均显著减弱,而甲氨蝶呤组、VD 组和飞龙掌血中、高剂量组大鼠心脏组织中VDR 的表达均显著增强(P<0.05或P<0.01)。结果见图5~图7。

图5 各组大鼠心脏组织中PAD4蛋白表达的显微图(IHC法)
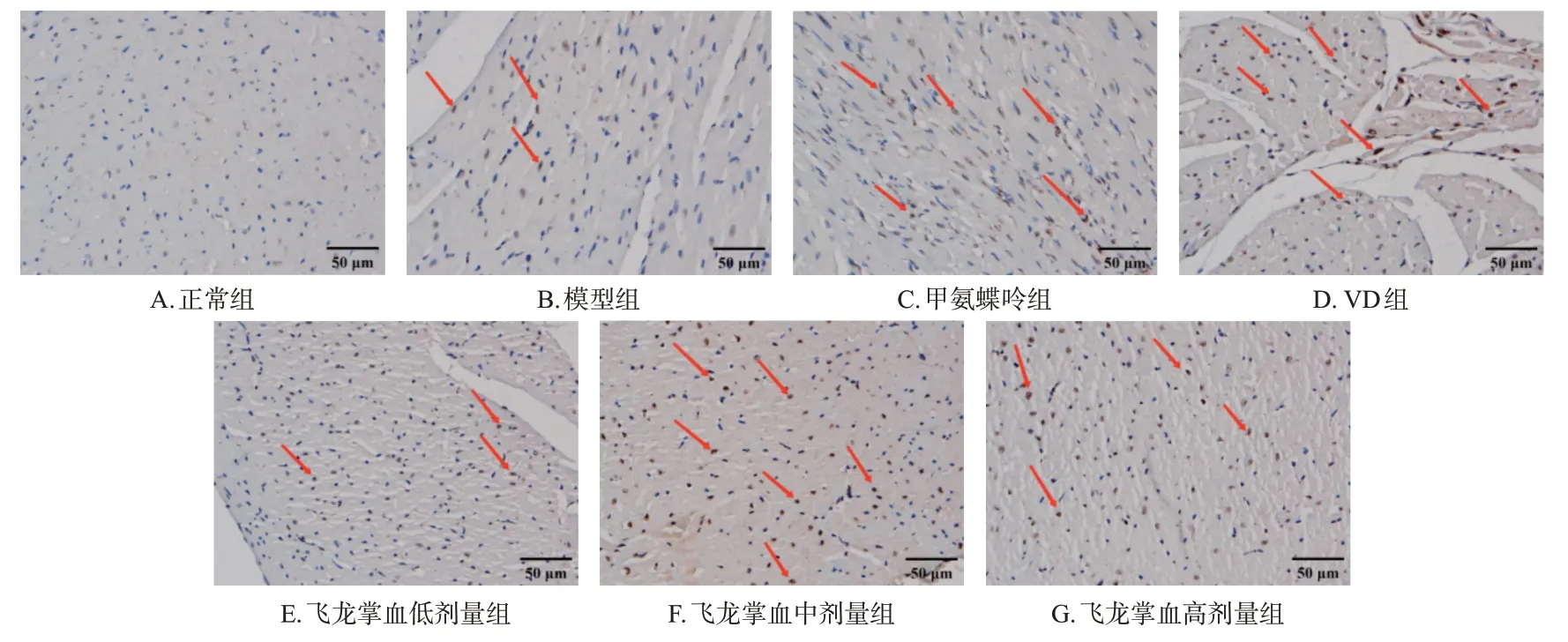
图6 各组大鼠心脏组织中VDR蛋白表达的显微图(IHC法)
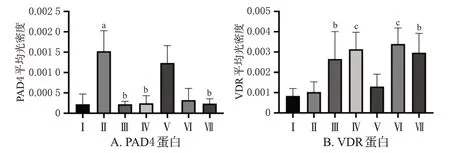
图7 各组大鼠心脏组织中PAD4、VDR 蛋白表达水平比较(±s,n=3)
3.5 飞龙掌血对CIA 模型大鼠心脏组织中CitH3、MPO、IL-6、CYP27B1蛋白表达的影响
与正常组比较,模型组大鼠心脏组织中CitH3、MPO、IL-6 蛋白的表达水平均显著升高(P<0.01),CYP27B1 的表达水平虽有降低但差异无统计学意义(P>0.05);与模型组比较,VD组、飞龙掌血高剂量组大鼠心脏组织中CitH3蛋白的表达水平,以及甲氨蝶呤组、VD 组和飞龙掌血中、高剂量组大鼠心脏组织中MPO、IL-6 蛋白的表达水平均显著降低,而VD 组和飞龙掌血中、高剂量组大鼠心脏组织中CYP27B1 蛋白的表达水平均显著升高(P<0.05或P<0.01)。结果见图8、表3。
表3 各组大鼠心脏组织中CitH3、MPO、IL-6、CYP27B1蛋白表达水平比较(±s,n=3)

表3 各组大鼠心脏组织中CitH3、MPO、IL-6、CYP27B1蛋白表达水平比较(±s,n=3)
a:与正常组比较,P<0.01;b:与模型组比较;P<0.01;c:与模型组比较,P<0.05。
组别正常组模型组甲氨蝶呤组VD组飞龙掌血低剂量组飞龙掌血中剂量组飞龙掌血高剂量组CitH3/GAPDH 0.102±0.009 0.748±0.050a 0.273±0.022 0.205±0.009b 0.664±0.048 0.504±0.096 0.259±0.024c MPO/GAPDH 0.135±0.058 0.742±0.015a 0.314±0.089b 0.297±0.158b 0.579±0.059 0.492±0.107b 0.283±0.115b IL-6/GAPDH 0.082±0.011 0.758±0.070a 0.217±0.041b 0.291±0.073b 0.634±0.074 0.483±0.058b 0.264±0.060b CYP27B1/GAPDH 0.258±0.013 0.109±0.024 0.429±0.021 0.769±0.022b 0.247±0.026 0.745±0.048b 0.584±0.109c
4 讨论
心血管系统作为血液信号的直接接收者,对RA 患者慢性炎症和自身免疫性抗体显著上调的血液环境极其敏感并能最先作出反馈,故心血管系统是RA 患者主要的关节外受累系统,心血管疾病也是RA 患者主要的关节外表现之一[19]。飞龙掌血作为经典苗药,是治疗RA的常用药。现代药理研究表明,其能通过抗炎、抗氧化、调节血脂和改善心脏舒缩功能等多个途径来保护心血管[10-11]。本研究通过足跖厚度和HE 染色观察发现,与正常组比较,大鼠在造模完成后足跖肿胀明显,关节炎指数评分和足趾厚度均显著增加,关节组织衬里下层可见明显的炎症细胞浸润和纤维组织增生,心脏组织中有明显的组织空泡和部分周围血管壁增厚,腹主动脉组织可见内皮脱落,提示CIA 模型复制成功,且大鼠存在一定的心脏损害;经飞龙掌血干预后,大鼠踝关节组织、心脏组织的上述病理改变均有不同程度减轻,且以中剂量组干预效果最佳,但腹主动脉内皮脱落等现象依然存在,提示飞龙掌血能改善RA及相关心脏损害,但同样能诱使腹主动脉产生一定的应激反应;此外,由于中剂量为临床等效剂量,处于最佳疗效窗口,故干预效果较其他剂量更好。
RA患者心血管并发症的发生风险较普通人群高了2 倍,而NETs 介导慢性低度炎症可能是RA 患者心血管并发症风险增加的主要原因之一[2]。研究指出,PAD4蛋白可瓜氨酸化中性粒细胞的核内组蛋白,是RA 患者NETs 形成的主要途径之一;同时,PAD4 蛋白介导的瓜氨酸化可在RA 患者的心肌间质内进行,并诱发进行性心肌功能障碍[20]。当NETs释放后,CitH3蛋白可成为抗环瓜氨酸肽抗体(RA 特异性抗体)的靶标,从而加强机体自身免疫反应;此外,CitH3、MPO等NETs相关蛋白可破坏细胞膜完整性和细胞间连接,从而直接损伤血管内皮;MPO蛋白还可成为自身抗原而引发抗中性粒细胞胞质抗体相关性血管炎;NETs 还可出现在血栓部位而加重血栓形成,造成机体局部缺血[3,21-22]。IL-6作为一种经典的促炎因子,在心肌梗死部位呈高表达,是心脏损害的常见炎症因子[23]。本研究结果显示,模型组大鼠血清中MPO、IL-6 含量明显增高,心脏组织中PAD4、CitH3、MPO、IL-6 蛋白的表达水平亦显著升高;经各剂量飞龙掌血干预后,上述指标得到不同程度的改善,提示飞龙掌血可减少NETs 形成及炎症反应,具有改善CIA 模型大鼠心脏损伤的作用。
VD 信号存在于NETs 形成途径的上游,但RA 患者的VD 水平普遍较低[6]。研究发现,心肌细胞可表达CYP27B1蛋白,后者可催化1α,25(OH)2D3的局部转化;而在正常生理条件下,1α,25(OH)2D3信号被VDR 蛋白接收后可形成VDR-1α,25(OH)2D3复合物,参与受体细胞基因转录的调控[24],故心脏组织中VDR的缺乏是导致心脏肥大的原因之一。低水平25(OH)D3是血管内皮功能异常、动脉粥样硬化等心血管疾病发生的独立危险因素[25],VD缺乏者易发生左心房纤维化,且具有较高的心房颤动发生风险[26]。本研究通过检测VD 相关指标发现,与正常组比较,模型组大鼠血清中25(OH)D3含量显著降低,心脏组织中CYP27B1、VDR蛋白的表达水平虽略有变化但差异均无统计学意义;经不同剂量的飞龙掌血干预后,上述指标均有不同程度的改善,提示飞龙掌血能通过调控VD 代谢途径来改善RA 相关心脏损害。同时,本研究设置了VD 组,意在验证VD 与NETs 的上下游关系,结果显示,补充VD 后,大鼠体内PAD4、CitH3、MPO、IL-6蛋白的表达均受到抑制,提示VD处于NETs上游,可调控NETs的形成。
综上所述,飞龙掌血可通过抑制NETs 的形成及炎症反应的发生来改善RA 症状及相关心脏损害,其机制可能与调节VD 水平有关。但VD 和NETs 两者间的具体调控机制尚未阐明,本课题组将进行相关实验设计以进一步探讨其中关系。
