基于lncRNA MALAT1/Slug/Smad通路调控上皮间质转化探讨白花蛇舌草抑制结肠癌细胞的迁移和侵袭
2024-01-03华杭菊陈武进倪卓娜刘锦洪安虹霖林久茂
华杭菊,陈武进,倪卓娜,刘锦洪,安虹霖,黄 彬,4,林久茂,4*
(1.福建中医药大学附属人民医院,福建 福州 350004;2.福建中医药大学附属第三人民医院,福建 福州 350108;3.福建中医药大学中西医结合研究院,福建 福州 350122;4.福建省中西医结合老年性疾病重点实验室,福建 福州 350122)
大肠癌(包括结肠癌和直肠癌)是我国临床中常见的消化道恶性肿瘤之一,容易出现复发及转移,60%~80%大肠癌患者确诊时属于晚期[1]。目前研究显示:大肠癌发生转移的重要机制之一为上皮间质转化(epithelial-mesenchymal transition,EMT),上游信号锌指转录因子Slug 是导致EMT 的关键调节因子,其介导的Slug/Smad相关通路能够促进EMT的发生,进而促进大肠癌细胞的侵袭和转移[2]。长链非编码RNA(lncRNA)肺癌转移相关转录本1(metastasis-associated lung adenocarcinoma transcript 1,MALAT1)在多种肿瘤中表达异常,对肿瘤细胞转移有重要调控功能[3-4]。研究发现 lncRNA MALAT1 可上调Slug 的表达,提高EMT,从而促进癌细胞转移[5]。白花蛇舌草(Hedyotis DiffusaWilld.,HDW)具有清热解毒、消痈散结等功效,现代研究表明HDW可抑制结肠癌细胞增殖和血管新生,诱导细胞凋亡,逆转多药耐药,且无明显的毒副作用[6-7]。前期研究发现,HDW 可通过抑制转化生长因子-β(transforming growth factor-β,TGF-β)诱导的结直肠上皮间质转化,减少结肠癌细胞的迁移和侵袭[8],但HDW 抑制肿瘤转移的机制尚未完全阐明,对HDW 是否通过调控lncRNA MALAT1/Slug/Smad通路影响EMT 表达,进而抑制大肠癌细胞的迁移和侵袭,还需进一步明确。本实验构建稳定过表达lncRNA MALAT1的人结肠癌HCT-116稳转细胞系,通过HDW 干预,以期进一步明确lncRNA MALAT1/Slug/Smad 通路在大肠癌EMT 和转移中的作用,以及HDW 发挥药效的关键机制。
1 实验材料
1.1 实验细胞 人结肠癌细胞株HCT-116 购自南京凯基生物科技发展有限公司。
1.2 实验试剂 RPMI-1640 培养基、胎牛血清、胰蛋白酶、磷酸盐缓冲液均购自美国Life Technologies公司;Transwell 板、基质胶均购自美国Corning 公
司;四甲基偶氮唑蓝干粉(美国Sigma 公司);TRIzol试剂盒[美国赛默飞世尔科技(中国)有限公司];NE-PER 核蛋白和胞浆蛋白抽提试剂盒(美国Thermo 公司);逆转录试剂盒(大连宝生物工程有限公司);过表达慢病毒lncRNA MALAT1(上海吉凯基因科技有限公司);SDS-PAGE 凝胶配制试剂盒(上海碧云天生物技术有限公司);Slug、Snail、TGF-β、N-钙黏蛋白(N-cadherin)、波形蛋白(Vimentin)、Smad2/3、磷酸化Smad2/3(p-Smad2/3)、E-钙黏蛋白(E-cadherin)、GAPDH 抗体和二抗(HRP)均购自美国CST 公司。
1.3 实验仪器 CO2培养箱、-80 ℃超低温冰箱均购自美国Thermo 公司;超净工作台(苏州净化设备有限公司);多功能酶标仪(奥地利Tecan 公司);倒置显微镜(德国Leica 公司);形态学显微图像分析系统LASV 4.1、Countstar 全自动细胞计数仪均购自美国Life 公司;电泳仪、电泳槽、ChemiDoc XRS+化学发光成像系统均购自美国Bio-Rad 公司。
2 实验方法
2.1 HDW 药液制备 HDW 全草用85%乙醇回流提取3 次并过滤,合并提取液,浓缩至无醇味,提取液在旋转蒸发仪上蒸发得到浸膏,真空干燥后得到干燥粉末,即HDW 提取物。称取HDW 提取物粉末0.5 g,加入高压灭菌超纯水1 mL,配制成0.5 g/mL HDW 药液,置于4 ℃冰箱中保存待用。
2.2 细胞培养 将HCT-116 细胞培养于含有10%FBS、100 U/mL 青霉素和100 µg/mL 链霉素的RPMI-1640 培养基中,置于37 ℃、5% CO2培养箱中培养。每隔1 d 更换RPMI-1640 培养液,每3 d 传代1次。细胞汇合度达到80%左右时应用0.25%胰酶消化并传代。
2.3 细胞分组及病毒转染 取对数生长期HCT-116 细胞按2×105个/孔接种于6 孔细胞板中,每组设3 个复孔,置于细胞培养箱中常规培养。待细胞达80%汇合度时,将细胞分为空白组、药物组、病毒组和药物联合病毒组。空白组和药物组加入不含lncRNA MALAT1的空载慢病毒液,病毒组和药物联合病毒组加入含lncRNA MALAT1 过表达的慢病毒液。感染4 d 后,当感染效率达90%以上时,继续培养48 h。加入1 mg/L 的嘌呤霉素筛选7 d,获得稳定转染的细胞系。
2.4 药物干预 空白组和病毒组用0 mg/mL HDW药液干预,药物组和药物联合病毒组用0.5 mg/mL HDW 药液干预。
2.5 RT-qPCR 法检测细胞lncRNA MALAT1 mRNA相对表达水平 取各组细胞,按2.5×105个/mL 细胞密度接种于6 孔培养板中,每孔2 mL。按“2.4”项下方法干预24 h,使用TRIzol 试剂提取总RNA。应用逆转录试剂盒将RNA 反转录成cDNA,应用逆转录试剂盒进行逆转录反应。具体操作按照试剂盒说明书进行。引物序列由中国宝生物工程(大连)有限公司提供,见表1,lncRNA MALAT1 mRNA 相对表达水平采用2-ΔΔCt方法计算。
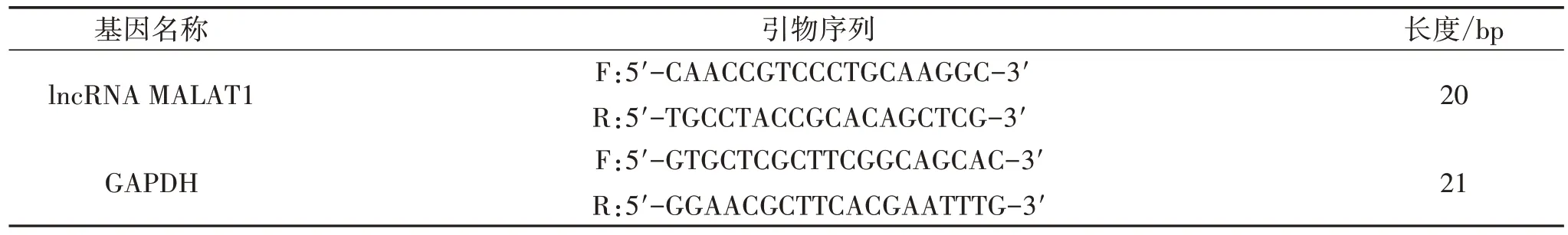
表1 引物序列
2.6 MTT 法检测细胞活力 按1×105个/mL 将细胞接种于96 孔培养板中,每孔100 µL,细胞贴壁后按“2.4”项下方法干预,每组均设8 个复孔。干预培养24 h 后,每孔加入10 µL 的0.5 mg/mL MTT 后继续培养4 h,吸弃液体后加入100 µL DMSO,室温放置10 min,充分振荡混匀后于酶标仪450 nm 波长下检测吸光度OD 值,计算细胞活力。
2.7 划痕实验检测细胞划痕愈合能力 按照2.5×105个/mL 将细胞接种于6 孔培养板中,每孔2 mL,细胞培养至汇合度达到80%~90%时,进行划痕,PBS 溶液清洗2 次,按“2.4”项下方法干预,分别在干预0、6、24 h 后于显微镜下观察细胞划痕修复情况。
2.8 Transwell 实验检测细胞迁移、侵袭能力 按2.5×105个/mL细胞密度接种于6孔板中,每孔2 mL,细胞贴壁后按“2.4”项下方法干预24 h,吸弃各孔溶液后进行消化。用空白培养基重悬细胞,调整细胞密度为2.5×105个/mL,将200 µL 细胞悬液滴加于不用基质胶包被(迁移实验)或预先基质胶包被(侵袭实验)的Transwell 上室,下室加入700 µL 完全培养基,放入恒温箱培育12 h。将小室拿出用4%多聚甲醛固定20 min,用0.1%的结晶紫染色15 min,超纯水漂洗3 次,用棉签将上室未迁移细胞擦拭掉,倒置显微镜下观察,随机取5 个视野拍照,以迁移、侵袭至小室底部的细胞数作为细胞转移能力评价指标。
2.9 Western blot 检测细胞相关蛋白表达量 药物干预同前,干预后弃上清用PBS 清洗,应用 NEPER 核蛋白和胞浆蛋白抽提试剂盒提取蛋白,用BCA 法做蛋白质定量,进行电泳、转膜,一抗加入Slug、Snail、TGF-β、N-cadherin、Vimentin、p-Smad2/3、Smad2/3、E-cadherin(1∶1 000)和β-actin(1∶5 000)一抗,4 ℃下摇床过夜,TBST 溶液清洗3 次,每次5 min。加入对应种属的辣根过氧化物酶标记的二抗(1∶5 000),室温孵育1 h,TBST 溶液清洗3 次,每次5 min。滴加电化学发光(ECL)发光液,在显影板上用ChemiDoc XRS+凝胶成像系统成像,并用Image Lab 软件进行数据分析。
2.10 统计学方法 采用SPSS 23.0 软件进行数据分析。计量资料属于正态分布的以(±s)表示,组间比较采用单因素方差分析,两两比较方差齐时采用LSD-t检验;方差不齐采用Dunnett's T3 进行统计分析。以P<0.05 为差异有统计学意义。
3 结 果
3.1 4 组lncRNA MALAT1 mRNA 相对表达水平比较 与空白组比较,药物组lncRNA MALAT1 mRNA相对表达水平明显降低(P<0.05),病毒组lncRNA MALAT1 mRNA 相对表达水平明显升高(P<0.05);与病毒组比较,药物联合病毒组lncRNA MALAT1mRNA 相对表达水平明显降低(P<0.05)。见图1。
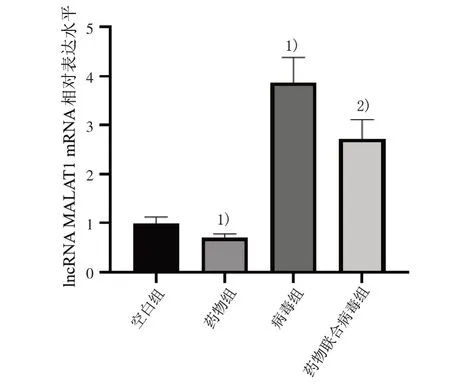
图1 4 组lncRNA MALAT1 mRNA 相对表达水平比较
3.2 4 组细胞活力比较 与空白组比较,药物组细胞活力明显降低(P<0.05),病毒组细胞活力明显升高(P<0.05);与病毒组比较,药物联合病毒组细胞活力明显降低(P<0.05)。见图2。

图2 4 组细胞活力比较
3.3 4 组细胞划痕愈合能力比较 病毒转染后lncRNA MALAT1 mRNA 相对表达水平的提升促进了的HCT-116 细胞的细胞划痕愈合能力。HDW 可以显著性抑制HCT-116 细胞的划痕愈合能力,并且HDW 对过表达lncRNA MALAT1 的HCT-116 的划痕愈合能力仍具有抑制作用。见图3。
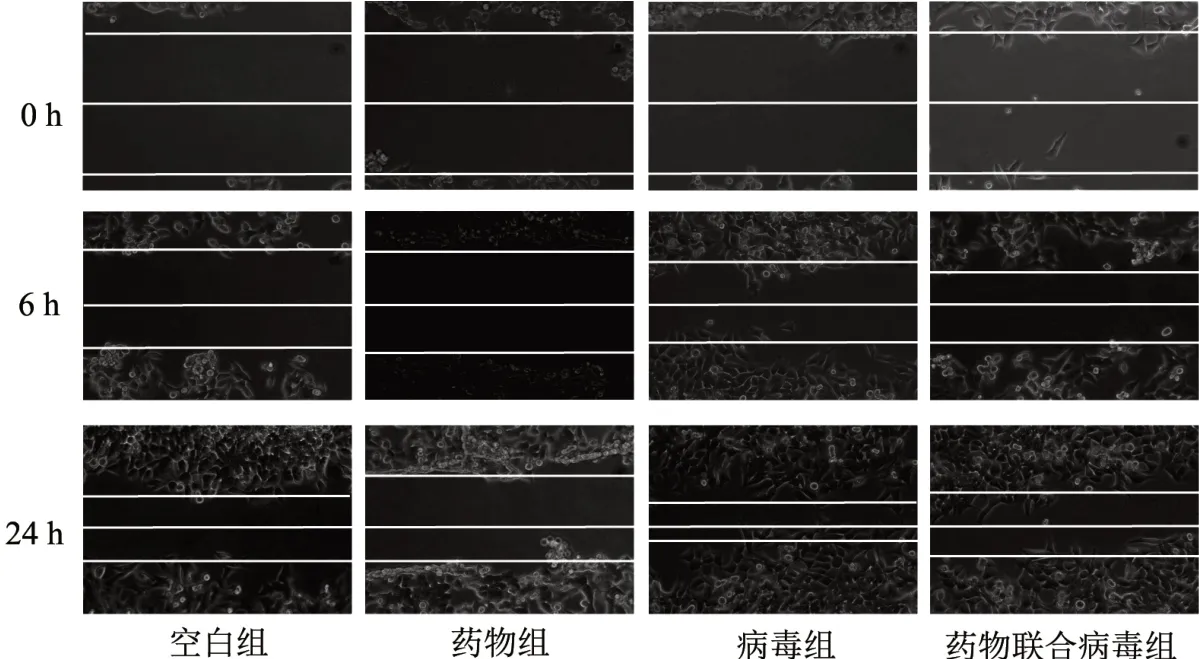
图3 4 组划痕实验细胞形态图(×200)
3.4 4 组细胞迁移、侵袭能力比较 与空白组比较,病毒组HCT-116 细胞迁移和侵袭能力提高。HDW不仅对于正常HCT-116 细胞的迁移、侵袭能力有显著性抑制作用,并且对过表达lncRNA MALAT1 的HCT-116 细胞迁移、侵袭能力仍具有抑制作用。见图4。

图4 4 组Transwell 迁移、侵袭实验图(×200)
3.5 4 组相关蛋白表达量比较 与空白组比较,药物组Slug、Snail、TGF-β、N-cadherin、Vimentin 蛋白表达量和p-Smad/Smad 明显降低(P<0.05),E-cadherin 蛋白表达量明显提高(P<0.05);病毒组Slug、Snail、TGF-β、N-cadherin、Vimentin 蛋白表达量和p-Smad/Smad 明显提高(P<0.05),E-cadherin 蛋白表达量明显降低(P<0.05);与病毒组比较,药物联合病毒组Slug、Snail、TGF-β、N-cadherin、Vimentin蛋白表达量和p-Smad/Smad 明显降低(P<0.05),E-cadherin 蛋白表达量明显提高(P<0.05)。见图5、表2。
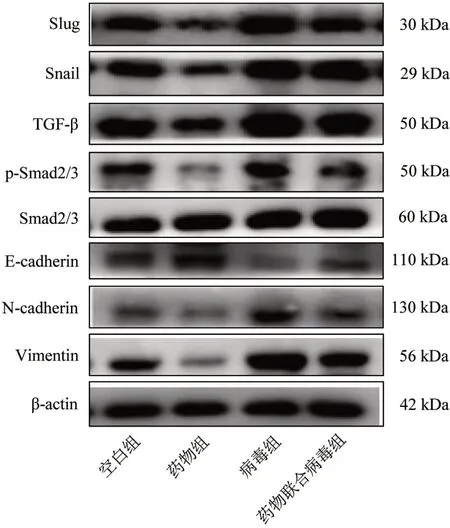
图5 4 组相关蛋白条带图
表2 4 组相关蛋白表达量比较(±s)

表2 4 组相关蛋白表达量比较(±s)
注:与空白组比较,1) P<0.05;与病毒组比较,2) P<0.05。
Vimentin 0.96±0.05 0.49±0.031)1.40±0.071)0.85±0.032)组别空白组药物组病毒组药物联合病毒组Slug 0.98±0.06 0.72±0.031)1.32±0.081)0.83±0.062)Snail 0.94±0.04 0.73±0.091)1.48±0.041)1.11±0.042)TGF-β 0.95±0.04 0.65±0.081)1.43±0.091)0.97±0.052)p-Smad/Smad 0.99±0.06 0.34±0.041)1.03±0.081)0.86±0.052)E-cadherin 0.70±0.041)1.25±0.031)0.43±0.051)0.52±0.042)N-cadherin 0.97±0.03 0.65±0.081)1.40±0.011)0.97±0.062)
4 讨 论
目前大肠癌早期主要以手术为主,晚期以放化疗、免疫治疗及营养支持治疗为主。中医药在大肠癌康复治疗过程中起到重要作用,可增强大肠癌康复过程中放化疗效果,减少免疫、靶向治疗毒副作用,改善大肠癌晚期并发症作用,特别是在预防大肠癌复发、转移过程中起到重要作用[9]。大肠癌属于中医学“肠蕈”“积聚”“肠积”等范畴,其病机为湿热与癌毒郁结大肠,湿热伤肠络,毒邪蕴毒成痈,以湿热瘀毒为主要证候特征,其主要治则是清热利湿、解毒散结、化瘀消痈。HDW 为茜草科耳草属植物,性寒、味微苦、微甘,归胃经、大肠经、小肠经,具有清热解毒、消痛散结、利尿除湿等功效,符合大肠癌的辨证论治。
EMT 是肿瘤发生侵袭转移的重要步骤。EMT的主要分子特征为细胞黏附分子E-cadherin 表达的丧失和N-cadherin、Vimentin 表达升高。EMT 转化过程受到Slug、Snail 等转录因子的调控,Slug 蛋白被认为是EMT 转化过程的重要调控因子[10]。lncRNA 在肿瘤转移中的作用被逐渐重视,并被证实可以抑制包括大肠癌在内的多种肿瘤细胞增殖、迁移和侵袭,lncRNA MALAT1 可上调Snail、TGF-β的表达[11]。进一步与下游转录因子Smad 结合形成复合物转入细胞核内,并与其他转录因子或者辅助蛋白一起调控靶基因转录,使E-cadherin 表达降低,N-cadherin、Vimentin 表达升高,提高EMT 能力,进而使肿瘤细胞的转移能力增强[3-5]。因此,阻断lncRNA MALAT1/Slug/Smad 通路调控EMT 是有效的防治肿瘤转移方式。
本研究构建稳定过表达lncRNA MALAT1 的HCT-116 稳转细胞系,与空白组比较,药物组HDW可下调lncRNA MALAT1 mRNA 相对表达水平,抑制肿瘤细胞的生长,而病毒组中单独过表达lncRNA MALAT1 后促进了肿瘤细胞增殖、迁移能力。此外,lncRNA MALAT1 过表达后再进行HDW 的干预,肿瘤细胞增殖、迁移能力下降,提示MALAT1 是药物的靶点之一。
研究结果显示:lncRNA MALAT1过表达后HCT-116 细胞Slug、Snail、TGF-β、N-cadherin、Vimentin蛋白表达量和Smad2/3 蛋白磷酸化程度明显上调,E-cadherin 蛋白表达量明显下调,而药物组和药物联合病毒组均可以逆转上述相关蛋白的表达。提示lncRNA MALAT1 可通过激活Slug/Smad 通路促进大肠癌的EMT 和转移,而HDW 抑制大肠癌细胞迁移和侵袭的药效关键机制之一是MALAT1/Slug/Smad 信号通路,减少EMT,进而抑制大肠癌细胞的迁移和侵袭。
综上所述,HDW 可明显下调MALAT1进而显著抑制Slug/Smad 通路活化,降低了肿瘤的侵袭性,进而抑制肿瘤转移。但由于人体肿瘤转移过程中免疫、激素调节、营养、环境以及治疗的相互影响,白花蛇舌草准确的抗肿瘤机制需要更深入地研究。
