清达颗粒对血管紧张素Ⅱ诱导的高血压小鼠心脏损伤的保护作用
2024-01-03赵春雨贾沛芝王美玲许瑶瑶林浩伟蔡巧燕
赵春雨,张 铃,2,3,贾沛芝,王美玲,许瑶瑶,林浩伟,蔡巧燕,2,3*
(1.福建中医药大学中西医结合研究院,福建 福州 350122;2.福建省中西医结合老年性疾病重点实验室,福建 福州 350122;3.福建中医药大学陈可冀学术思想传承工作室,福建 福州 350122)
随着饮食与生活结构的改变,高血压成为危害人类健康,引起心脑血管疾病不良预后的首要危险因素[1]。当机体长期处于高血压状态时,心脏会发生功能与结构的病理性改变,形成心肌肥大或纤维化等心脏损伤,继而可能引发心肌缺血、冠状动脉粥样硬化性心脏病、心力衰竭或心肌梗死等严重的并发症[2-3]。因此,预防和控制高血压是遏制我国心脑血管疾病流行的核心策略之一[4]。清达颗粒(Qingda granule,QDG)是陈可冀院士根据70 余年的临床经验方清眩降压汤精简化裁而来[5],主治高血压证属肝阳上亢所致的头晕、头痛、烦躁、失眠等症状。课题组前期研究显示:QDG 能明显降低血管紧张素Ⅱ(angiotensin Ⅱ,Ang Ⅱ)诱导的高血压小鼠血压,同时还能改善自发性高血压大鼠的左心室功能并减轻其心脏炎症反应[5-6]。本研究以皮下埋入微量Ang Ⅱ泵诱导的高血压小鼠模型作为研究对象,探讨QDG 对高血压小鼠心脏损伤的影响,为QDG 的临床应用提供科学依据。
1 实验材料
1.1 实验动物 8 周龄雄性SPF 级C57BL/6 小鼠30 只,购于上海斯莱克实验动物有限公司,实验动物生产许可证号:SCXK(沪)2017-000,饲养于福建中医药大学动物实验中心,许可证号:SYXK(闽)2019-0007。本实验已通过福建中医药大学动物中心伦理委员会审核(2019048)。
1.2 实验药物 QDG 由天麻、钩藤、黄芩和莲子心4 味药物组成(比例为12∶10∶6∶5),其颗粒剂由江阴天江药业有限公司提供,产品批号:1805351,规格:5 g/袋。缬沙坦胶囊(Valsartane,Val)购自北京诺华制药有限公司,产品批号:H20040217。QDG和Val 均使用生理盐水配制成药液,现配现用。
1.3 实验试剂 Ang Ⅱ(英国 Abcam 公司,货号:ab120183);肌酸激酶同工酶(CK-MB)、脑钠肽(BNP)ELISA 试剂盒均购自江苏酶免实业有限公司(货号:MM-43703M2、MM-0060M2);TRNzol(北京天根生化科技有限公司,货号:DP424);逆转录试剂盒(南京诺唯赞生物科技有限公司,货号:R211-02);qPCR 试剂盒(普洛麦格生物技术有限公司,货号:LS2068);天狼星红染色试剂盒(北京索莱宝科技有限公司,货号:G1472)。
1.4 实验仪器 Coda 血压测量仪(美国Kent Scientific 公司);植入式胶囊渗压泵(美国ALzet 公司);7500 荧光定量PCR 仪(美国ABI 公司);生物组织石蜡包埋仪(湖北孝感亚光医用电子技术有限公司);石蜡切片机、偏振光显微镜均购自德国Leica 公司。
2 实验方法
2.1 分组与造模 将30 只雄性C57BL/6 小鼠随机分成对照组、模型组、低剂量组、高剂量组和阳性组,每组6 只。适应性喂养1 周,在小鼠两侧肩胛骨中间偏右做一长约1.5 cm 的横行皮肤切口,使用剪刀沿皮下钝性分离组织,游离至对侧背部皮下,将渗透微型泵埋入至切口皮下,要求渗透微型泵开口朝向尾部,缝合切口,碘伏消毒。对照组小鼠植入预装200 µL 生理盐水的微型泵,模型组和给药组小鼠植入预装200 µL 的3 mg/mL Ang Ⅱ溶液微型泵,3 组均以0.25 µL/h 的速度释放,均持续释放28 d。术后小鼠出现收缩压(SBP)≥140 mm Hg,提示高血压小鼠模型成功建立[7]。
2.2 干预方法 于造模第2 天开始给药干预。低、高剂量组分别按1.3、2.6 mg/(kg·d)给予QDG 药液灌胃,阳性组按10.4 mg/(kg·d)给予Val 药液灌胃,对照组和模型组按12 mL/(kg·d)给予生理盐水灌胃,每日1 次,连续灌胃28 d。
2.3 血压监测 分别于造模后第0、7、14、21、28天检测小鼠尾动脉SBP 和舒张压(DBP)。将小鼠装进固定器中,放于加热板上加热3 min,将大小合适的阻断环和血压检测环套在小鼠尾部。设置好电脑上的Coda 软件后开始测定,每只小鼠测定3 个循环,每个循环记录20 次血压数据,记录所有小鼠的SBP、DBP。
2.4 取材 小鼠干预4周后,测定体质量,异氟烷麻醉后取眼球静脉血,静置30 min,于4 ℃、3 000 r/min下离心 5 min,收集血清,随后放置-80 ℃冰箱,用于ELISA 检测。于冰上取心脏,拍照后观察心脏形态并称重,随后将心脏横向等分切割为3 份,取上下两部分置于液氮中保存,用于qPCR 检测,中间部分置于4% 多聚甲醛中固定,用于天狼星红染色。
2.5 心重指数和心胫比 测量小鼠胫骨长度,计算心重指数和心胫比。
2.6 qPCR 检测心脏组织ANP 和BNP mRNA 相对表达水平 取心脏组织加入TRNzol 提取RNA,根据试剂盒说明书进行逆转录和qPCR。引物由上海生工生物工程合成,见表1。以GAPDH 作为内参,根据2-△△CT计算心钠肽(ANP)和BNP 的mRNA 表达水平。

表1 引物序列
2.7 ELISA 检测血清CK-MB、BNP 水平 将血清从-80 ℃冰箱取出,解冻后按照试剂盒说明书步骤操作,于波长450 nm 处分别检测CK-MB、BNP 的A值,标准品浓度由低到高自左向右作X 轴,A 值作Y轴,用Logit-Log 直线回归绘图并求值。
2.8 天狼星红法观察心脏组织中胶原纤维表达情况 小鼠心脏组织于4%多聚甲醛中固定24 h 后,随后依次置于70%乙醇、80%乙醇、90%乙醇、95%乙醇、无水乙醇Ⅰ、无水乙醇Ⅱ、二甲苯Ⅰ、二甲苯Ⅱ、石蜡Ⅰ、石蜡Ⅱ、石蜡Ⅲ进行梯度脱水,然后包埋成石蜡块。将心脏组织石蜡块切成4 µm 薄片,于37 ℃水中摊开后置于载玻片上。60 ℃烤片2 h后倒序脱蜡,天狼星红染液滴染1 h,然后苏木素染核,风干后用中性树胶封片。偏振光显微镜下观察并拍片,随后用ImageJ 软件分析心脏组织的天狼星红染色平均荧光强度,平均荧光强度与胶原纤维表达量成正比。
2.9 统计学方法 采用SPSS 26.0 软件进行数据分析。计量资料符合正态分布以(±s)表示,组间比较采用单因素方差分析,若方差齐,两两比较采用LSD-t检验;若方差不齐则采用Games-Howell 检验。P<0.05 为差异有统计学意义。
3 结 果
3.1 5 组造模前后血压比较 应用Ang Ⅱ溶液诱导7、14、21、28 d 后,模型组SBP、DBP 均明显高于对照组(P<0.05),给药2 周后,各给药组SBP、DBP较模型组明显降低(P<0.05),其中低、高剂量组SBP、DBP 比较差异无统计学意义(P>0.05),与阳性组相当。见表2、表3。
表2 5 组造模前后SBP 比较(±s)mm Hg
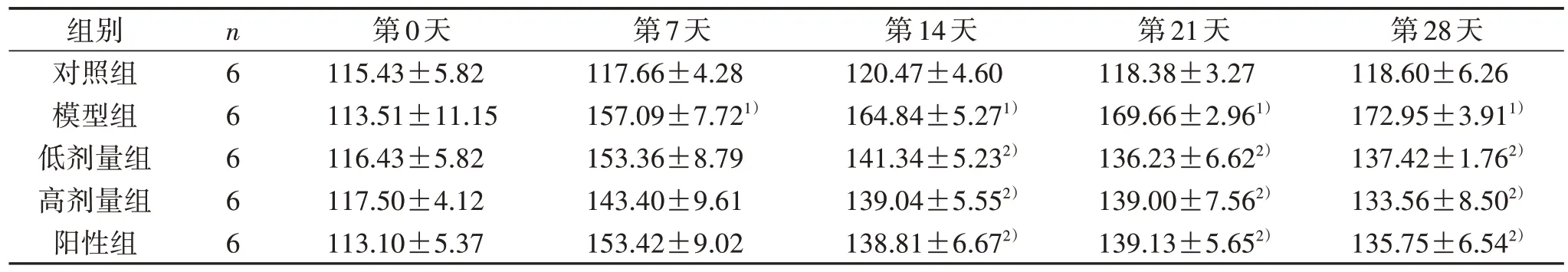
表2 5 组造模前后SBP 比较(±s)mm Hg
注:与对照组比较,1) P<0.05;与模型组比较,2) P<0.05。
第28天118.60±6.26 172.95±3.911)137.42±1.762)133.56±8.502)135.75±6.542)组别对照组模型组低剂量组高剂量组阳性组n66666第0天115.43±5.82 113.51±11.15 116.43±5.82 117.50±4.12 113.10±5.37第7天117.66±4.28 157.09±7.721)153.36±8.79 143.40±9.61 153.42±9.02第14天120.47±4.60 164.84±5.271)141.34±5.232)139.04±5.552)138.81±6.672)第21天118.38±3.27 169.66±2.961)136.23±6.622)139.00±7.562)139.13±5.652)
表3 5 组造模前后DBP 比较(±s)mm Hg
注:与对照组比较,1) P<0.05;与模型组比较,2) P<0.05。
第28天88.83±6.47 132.77±4.891)105.29±4.152)103.56±8.502)105.67±2.872)组别对照组模型组低剂量组高剂量组阳性组n66666第0天83.75±5.25 75.88±6.36 80.35±3.86 77.50±4.12 75.06±5.96第7天84.36±4.90 120.51±11.331)118.89±8.30 113.40±9.61 117.89±9.11第14天86.76±3.74 131.13±8.441)113.29±5.502)115.04±5.552)107.80±6.622)第21天86.34±3.62 131.83±7.921)108.33±8.332)109.01±7.562)108.65±5.732)
3.2 5组心脏形态、心重指数与心胫比比较 与对照组比较,模型组心脏组织明显肥大,心重指数与心胫比均明显提高(P<0.05);与模型组比较,各给药组心脏肥大情况明显被抑制,心重指数及心胫比均明显降低(P<0.05),其中低、高剂量组比较差异无统计学意义(P>0.05),与阳性组相当。见图1、图2。

图1 5 组心脏形态图
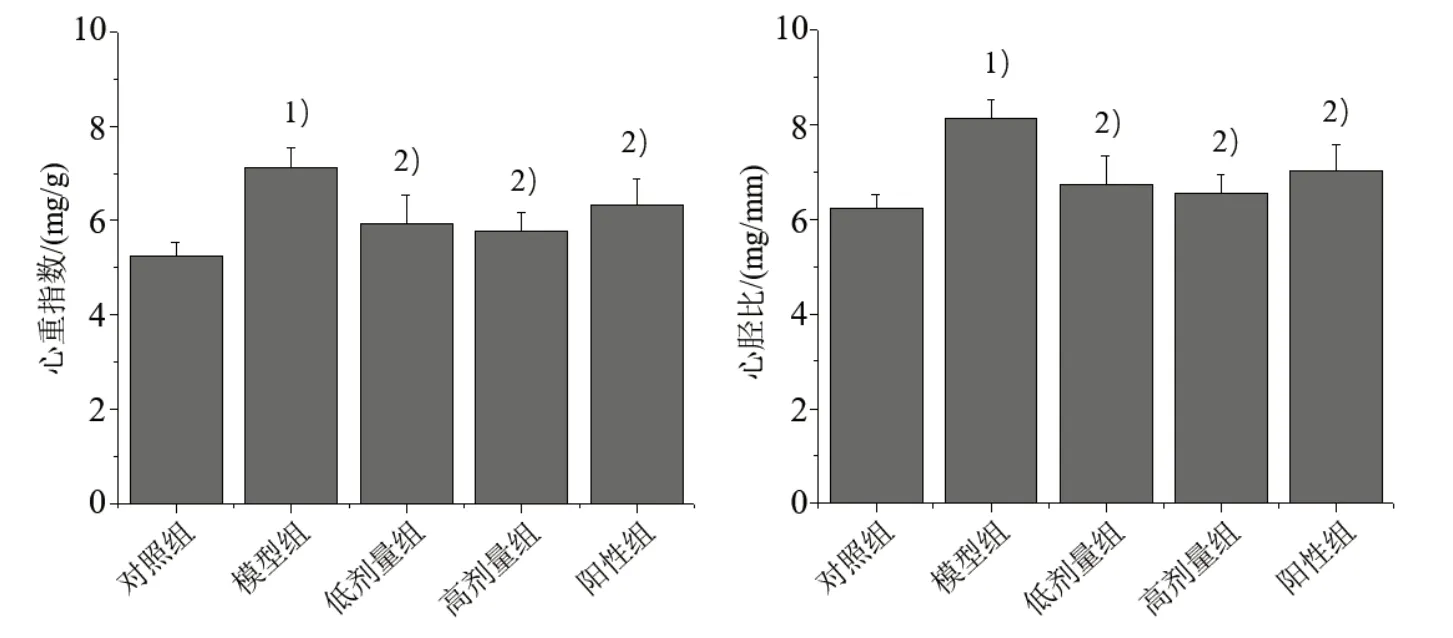
图2 5 组心重指数与心胫比比较
3.3 5 组心脏组织ANP、BNP mRNA 相对表达水平比较 与对照组比较,模型组ANP、BNP mRNA 相对表达水平均明显升高(P<0.05);与模型组比较,各给药组mRNA 相对表达水平均明显降低(P<0.05),其中低、高剂量组mRNA 相对表达水平比较差异无统计学意义(P>0.05),与阳性组相当。见图3。
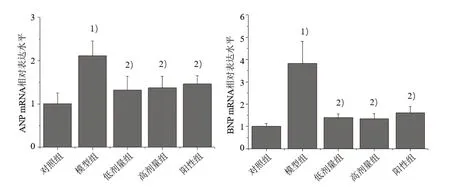
图3 5 组心脏组织ANP、BNP mRNA 相对表达水平比较
3.4 5 组血清CK-MB、BNP 含量比较 与对照组比较,模型组血清 CK-MB、BNP 含量均明显升高(P<0.05);与模型组比较,各给药组血清CK-MB、BNP含量均明显降低(P<0.05),其中低、高剂量组血清CK-MB、BNP含量比较差异无统计学意义(P>0.05),与阳性组相当。见表4。

表4 5 组血清CK-MB、BNP 含量比较 pg/mL
3.5 5 组心脏组织胶原纤维表达量比较 对照组胶原纤维表达较少,与对照组比较,模型组心脏组织的红色或黄色Ⅰ型胶原纤维以及绿色Ⅲ型胶原纤维大面积表达(P<0.05);与模型组比较,各给药组胶原纤维表达量明显减弱(P<0.05),其中低、高剂量组胶原纤维表达量比较差异无统计学意义(P>0.05),与阳性组相当。见图4、图5。
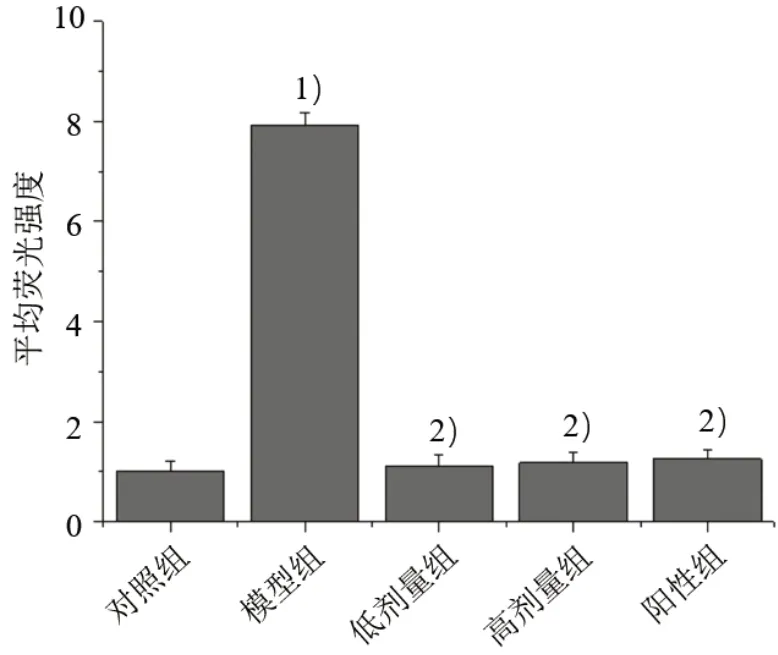
图4 5 组心脏组织平均荧光强度比较

图5 5 组心脏组织天狼星红染色图(×40)
4 讨 论
Ang Ⅱ作为肾素-血管紧张素-醛固酮(RAAS)系统的重要组成成分,在原发性高血压的发病以及心脏损伤中发挥着重要作用[8]。心脏过度泵血时,持续性的压力负荷会诱导心肌细胞适应性肥大,引起心肌肥厚。同时炎症、RAAS 系统和氧化应激反应等激活会进一步导致微循环障碍,引起间质冠状动脉周围的弥漫性胶原纤维沉积,最终导致心肌纤维化[9-11]。高血压导致的左心室肥厚、心肌弥漫性纤维化等心脏损伤[12],是引发恶性心脑血管疾病的重要诱因[13-14]。
高血压引起的心脏损伤,临床表现为呼吸困难、心脏跳动节律异常、胸闷、胸痛等,中医学认为其主要由正气亏虚、情志失调、饮食不当引起气机瘀滞,日久化火,可归属“眩晕”“头痛”“心悸”“胸痹”等范畴[2]。QDG 中天麻和钩藤平肝潜阳、熄风清热;黄芩清肝热;莲子心泄心火。诸药相合,共奏平肝潜阳、清泄心火、舒达肝气之功效,能有效预防并减轻心、脑、肾等靶器官的损伤[15-17]。
ANP、BNP 是由心房肌细胞与心室肌细胞合成并分泌的肽类激素,其主要作用是使血管平滑肌舒张和促进肾脏排钠、排水。当心脏泵血过多导致心房壁受牵拉时,则会刺激细胞释放ANP、BNP[18-21]。ANP、BNP 与心脏压力和容量负荷的增加有关,其表达升高可作为评估心肌肥厚和心功能损伤的有效指标之一[22-23]。CK-MB 是一种细胞内酶,多存在于心肌细胞内,可以敏感反映心肌损伤情况[24]。本研究通过Ang Ⅱ溶液诱导C57BL/6 小鼠,成功建立高血压小鼠模型。结果显示:经Ang Ⅱ溶液诱导下,模型组小鼠SBP、DBP 明显升高,心重指数与心胫比明显增加,心脏组织ANP、BNP mRNA 相对表达水平明显升高,血清CK-MB、BNP 的含量也明显增加,且心脏组织经天狼星红染色后可见胶原纤维表达量增多,提示小鼠经Ang Ⅱ溶液刺激后会造成血压升高和心肌肥大纤维化等心脏损伤。而经药物干预后,小鼠SBP、DBP 均明显降低,ANP、BNP mRNA 相对表达水平明显降低,血清CK-MB 和BNP 含量明显降低,心脏胶原纤维表达量明显减少,提示低、高剂量QDG 均能明显降低血压,抑制心肌细胞肥大和纤维化,改善心脏损伤。
综上所述,QDG 能有效改善高血压引起的心脏损伤,效果与缬沙坦相当,但本研究没有体现出明显的剂量依赖性,低、高剂量组比较差异无统计学意义。因此,后续进一步研究QDG 的药物剂量依赖实验时,要增大高、低剂量间的倍数。今后将结合网络药理学及测序方法继续探讨QDG 调控心脏肥大和纤维化的物质基础及作用机制。
