八宝丹联合顺铂抑制胃癌耐药细胞生长和转移的机制研究
2024-01-03兰炜兰林久茂赵锦燕
兰炜兰,林久茂,赵锦燕*
(1.福建林业职业技术学院,福建 南平 353000;2.福建中医药大学中西医结合研究院,福建 福州 350122;3.福建省中西医结合老年性疾病重点实验室,福建 福州 350122;4.中西医结合基础福建省高等学校重点实验室,福建 福州 350122)
胃癌是消化道最常见的恶性肿瘤之一,虽然临床治疗胃癌水平不断提高,但其5 年生存率仍然很低,主要原因是胃癌的转移和化疗药物产生耐药[1-2]。因此寻找新的治疗策略抑制胃癌转移和逆转耐药性是临床面临的挑战。胃癌转移和耐药是逃避凋亡的过程,而上皮间质转化(epithelial-mesenchymal transition,EMT)的异质性和可塑性在胃癌转移和耐药过程中起关键作用[3],是胃癌细胞获得转移特征的潜在机制。EMT 通过降解胃癌细胞间的黏附结构,从而增强胃癌细胞的侵袭性,并引导胃癌细胞对化疗产生耐药,最终导致治疗失败[4-5]。此外,患者产生耐药后通过改变细胞形态促进胃癌耐药细胞发生EMT,使其更容易发生转移,转移和耐药是相互影响、相互促进的关系[6-8]。因此,深入探究胃癌细胞耐药与其在EMT 中转移的潜在机制,将为肿瘤耐药临床研究提供新的依据。
八宝丹(BBD)具有明显的抗肿瘤的作用,临床上长期用于各种消化道肿瘤的辅助治疗[9-10]。前期研究表明:八宝丹促进胃癌耐药细胞的凋亡和自噬,逆转胃癌多药耐药[11],抑制胃癌耐药细胞生长及转移[12],但其联合化疗药物的作用及机制却不明确。顺铂(cisplatin,DDP)作为常用的一线抗肿瘤药物,其疗效已得到广泛检验,是胃癌最有效的化疗药物之一,尤其是对胃癌晚期患者[13-14],但后期容易出现耐药。因此,本研究初步观察八宝丹联合顺铂对胃癌耐药细胞SGC7901/DDP 生长及迁移、侵袭的影响。
1 实验材料
1.1 实验细胞 胃癌耐药细胞SGC7901/DDP 购自北京北纳创联生物技术研究所。
1.2 实验药物 BBD 购自厦门中药厂股份有限公司(0.3 g/粒,批号:180901),取0.3 g BBD 研磨成粉末,加入12 mL 磷酸盐缓冲液(PBS),超声助溶,配置成25 mg/mL BBD 母液,灭菌摇匀后,冷藏4 ℃备用。顺铂(DDP,MKG2946)购于美国Sigma 公司。取约1 mg DDP 粉末,加入1 mL PBS 溶液溶解摇匀后,制成1 mg/mL DDP 母液,现配现用。
1.3 实验试剂 0.25% 胰蛋白酶、二甲基亚砜(DMSO)均购自美国Gibco 公司;四甲基偶氮唑蓝(MTT)干粉(美国Sigma 公司);PBS(美国Hyclone公司);迁移侵袭板(美国Biocoat 公司);RIPA 裂解液(上海碧云天生物有限公司);GAPDH、E-钙黏蛋白(E-cadherin)、N-钙黏蛋白(N-cadherin)、波形蛋白(Vimentin)、基质金属蛋白酶(MMP)-9、MMP-2抗体、二抗兔抗和鼠抗均购自美国CST 公司。
1.4 实验仪器 超纯水净化系统(美国Millipore 公司);-80 ℃超低温冰箱、低速离心机均购自美国Thermo Fisher Scientific 公司;倒置显微镜(德国Leica 公司);微孔板酶标仪(德国Tecan 公司);低温高速离心机(德国Eppendorf 公司);制冰机(日本Sanyo 公司);干式恒温金属浴(上海培清科技有限公司);小型垂直电泳槽、Trans-blot 小型转印槽转膜仪、超高灵敏度化学发光成像系统均购自美国Bio-Rad 公司。
2 实验方法
2.1 细胞培养 用含有双抗(各100 µg/mL 青霉素和链霉素)和10%胎牛血清(FBS)的RPMI 1640 培养液培养SGC7901/DDP 细胞,为了确保SGC7901/DDP 细胞的耐药性,在培养液中加入1 µg/mL DDP溶液,置于培养箱中培养;待SGC7901/DDP 细胞密度长至约65%~75%时,胰酶消化,离心、弃上清液,重悬,按1∶3 接种传代,在后续干预实验时均不加入1 µg/mL DDP 溶液。
2.2 DDP 和BBD 干预浓度筛选 将对数生长期SGC7901/DDP 细胞消化后接种于96 孔板中,分别加入0、1、2、4、6、8、10、16、32 µg/mL DDP 溶液和0、0.25、0.5、0.75、1.0 mg/mL BBD 溶液干预48 h,弃上清加入100 µL MTT 溶液,37 ℃培养4 h,弃液体加入100 µL DMSO 溶液,避光放置10 min,振匀,在酶标仪570 nm 波长处检测OD 值,通过公式计算细胞活力。
结果显示:2 µg/mL DDP 和0.25 mg/mL BBD开始对SGC7901/DDP 细胞具有抑制作用,随着浓度的增大其抑制作用也增强。结合临床用药都是从小剂量开始和容易产生药物耐受,选择开始起作用的浓度作为联合用药的剂量,见图1。
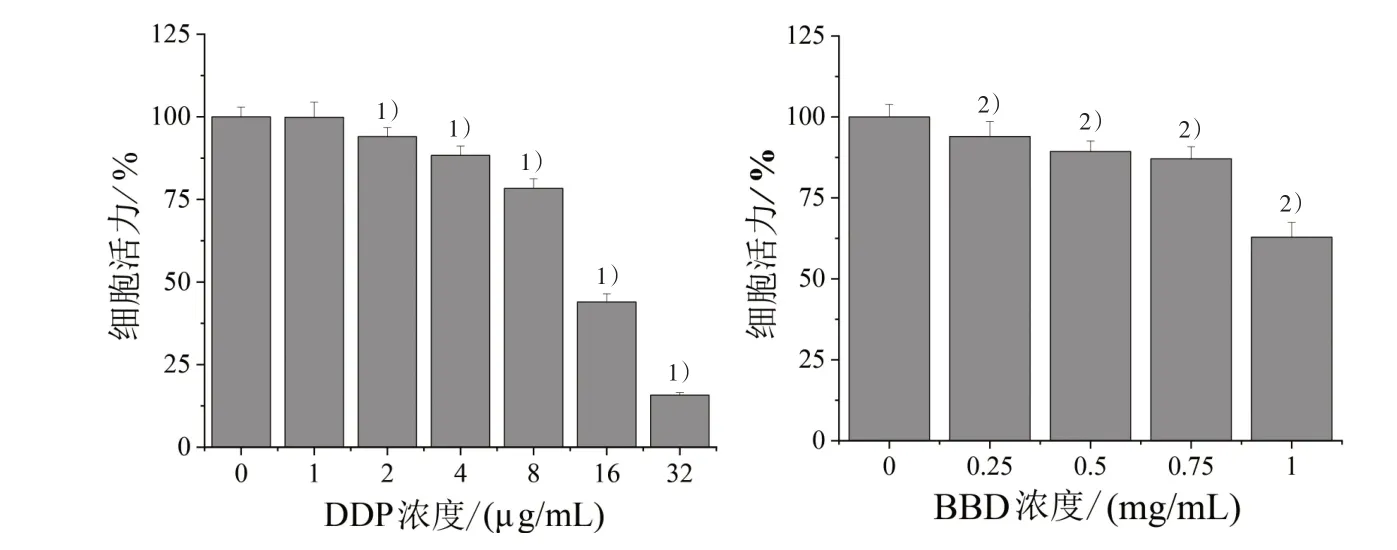
图1 不同浓度DDP 和BBD 对SGC7901/DDP 细胞活力的影响
2.3 细胞分组与干预 将SGC7901/DDP 细胞分为对照组、DDP 组、BBD 组和联合组,对照组加入常规培养基,DDP 组加入2 µg/mL DDP 溶液,BBD 组加入0.25 mg/mL BBD 溶液,联合组加入0.25 mg/mL BBD 溶液和2 µg/mL DDP 溶液,均干预48 h。
2.4 细胞活力检测 将对数生长期的SGC7901/DDP 细胞消化后接种于96 孔板中,按“2.3”项下方法干预48 h,按“2.2”项下MTT法检测4组细胞活力。
2.5 Transwell 迁移和侵袭实验 将SGC7901/DDP细胞按4.0×105个/孔均匀接种于6 孔板中培养,按“2.3”项下方法干预48 h,收集活细胞,用不含FBS培养基将细胞稀释至浓度为2.5×105个/mL 的细胞液,取200 µL 细胞液分别接种于侵袭板或迁移板小室的上层,同时取0.75 mL 含10% FBS 培养基放入下室,置于培养箱中培养24 h。观察下室有无细胞迁入,若有,取出小室,用4%多聚甲醛固定上下室12 min,再用结晶紫染色10 min,用PBS 溶液轻轻清除小室里侧(上室)细胞,待晾干后,倒置显微镜观察并拍照,通过统计5 个视野中迁移板和侵袭板下层的细胞数目来评价SGC7901/DDP 细胞迀移和侵袭能力。
2.6 黏附实验 按“2.3”项下方法干预48 h,经消化后调整细胞浓度,按4.0×105个/孔再次接种于6 孔板孵育6 h,弃上清,PBS 溶液轻轻洗2 遍,甲醛固定,采用0.1%结晶紫染色13 min,显微镜下观察并随机拍照,每组随机取3 张照片统计细胞数目,取均值,作为每组细胞黏附数。
2.7 Western blot 检测迁移和侵袭相关蛋白表达量 按“2.3”项下方法干预48 h,弃上清,用RIPA 液裂解细胞,BCA 法测定蛋白浓度。经加热变性、电泳、转膜,封闭液封闭30 min,PBS 溶液清洗后置于E-cadherin(1∶500)、N-cadherin(1∶500)、Vimentin(1∶500)、MMP-9(1∶500)、MMP-2(1∶500)一抗中4 ℃摇床过夜,PBS 溶液清洗,置于二抗溶液(1∶500)中孵育1 h。PBS 溶液漂洗后加显色液避光反应45 s,ECL 发光液显影,用Bio-Rad 系统成像并保存记录,用ImageJ 软件检测条带灰度值。
2.8 统计学方法 采用SPSS 28.0 软件进行数据分析。计量资料符合正态分布以(±s)表示,组间比较采用单因素方差分析,两两比较采用LDS-t检验。P<0.05 为差异有统计学意义。
3 结 果
3.1 4 组细胞活力比较 见图2。

图2 4 组细胞活力比较
3.2 4 组迁移和侵袭情况比较 给药组干预48 h后,迁移、侵袭细胞数较对照组明显减少(P<0.05);联合组迁移、侵袭的细胞数较BBD 组和DDP 组明显减少(P<0.05)。见图3、图4。
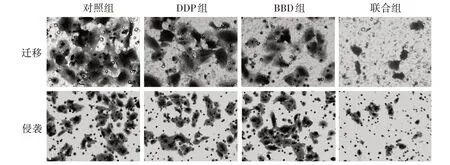
图3 4 组细胞迁移和侵袭图(×200)
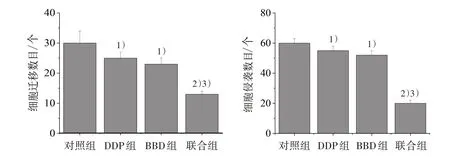
图4 4 组细胞迁移和侵袭数目比较
3.3 4 组细胞黏附力比较 给药组黏附细胞数较对照组明显减少(P<0.05);联合组黏附细胞数较BBD组和DDP组明显减少(P<0.05)。见图5。
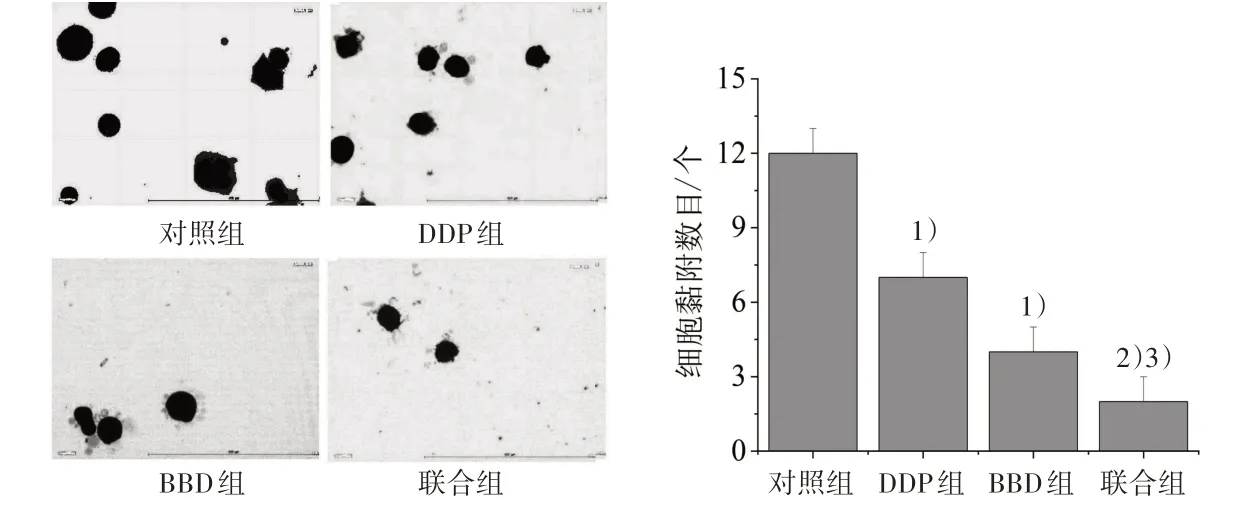
图5 4 组细胞黏附力情况比较(×200)
3.4 4 组迁移和侵袭相关蛋白表达量比较 与对照组比较,DDP 组和BBD 组N-cadherin、Vimentin、MMP-9 蛋白表达量均明显降低(P<0.05),E-cadherin蛋白表达量明显升高(P<0.05);BBD组MMP-2蛋白表达量明显降低(P<0.05)。与DDP 组和BBD组比较,联合组N-cadherin、Vimentin、MMP-9、MMP-2蛋白表达量均明显降低(P<0.05),E-cadherin 蛋白表达量明显升高(P<0.05)。见表1、图6。
表1 4 组迁移和侵袭相关蛋白表达量比较(±s)

表1 4 组迁移和侵袭相关蛋白表达量比较(±s)
注:与对照组比较,1) P<0.05;与DDP 组比较,2) P<0.05;与BBD 组比较,3) P<0.05。
MMP-2 1.00±0.05 1.00±0.05 0.90±0.041)0.73±0.052)3)组别对照组DDP组BBD组联合组N-cadherin 1.00±0.05 0.88±0.051)0.81±0.041)0.46±0.042)3)E-cadherin 1.00±0.05 1.28±0.051)1.38±0.051)1.51±0.062)3)Vimentin 1.00±0.04 0.87±0.041)0.85±0.051)0.53±0.042)3)MMP-9 1.00±0.05 0.90±0.051)0.89±0.041)0.66±0.032)3)
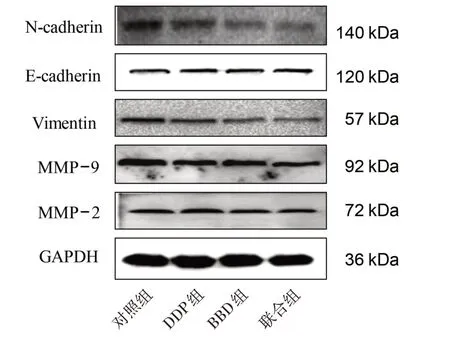
图6 4 组迁移和侵袭相关蛋白条带图
4 讨 论
胃癌根据临床症状归属于中医学“噎嗝”“反胃”“胃脘痛”“癥瘕”“积聚”等范畴,其病因主要与六淫邪毒、饮食不洁、生活起居不规律、情志失调有关,正气虚弱,脾胃损伤也可导致机体的阴阳失调,运化失常,脏腑、气血、经络功能的障碍,从而引起湿毒、气滞、痰凝、血瘀交阻于胃,聚集成块,形成胃癌[11]。因此,胃癌的中医治则主要为清热祛湿、健脾行气、活血化瘀。八宝丹主产于福建,主要由羚羊角、珍珠、牛黄、麝香、蛇胆、三七等中药组成,具有清湿热、利肝胆、散瘀滞之效。
研究发现:发生EMT 的胃癌细胞更容易诱导胃癌细胞发生化疗耐药,而胃癌细胞可通过诱导EMT 来增强胃癌细胞的迁移和侵袭力,使胃癌细胞对化疗药物产生更强的耐药性[15-17]。E-cadherin 是维持上皮完整性黏附连接的一个重要组分,N-cadherin 介导细胞间的黏附,是肿瘤迁移侵袭的一个重要因子。E-cadherin 和N-cadherin 的异常表达会导致肿瘤细胞的侵袭和迁移增加,并导致化疗耐药和治疗失败[18-20]。Vimentin 负责细胞骨架的完整性,其对细胞的灵活性很重要。在间充质细胞研究中发现:抑制E-cadherin 和增强Vimentin 的表达会增加细胞骨架的强度和柔韧性以及迁移和侵入组织的能力,使其在迁移过程中不易受损,且更具灵活性,促进胃癌耐药细胞转移并导致耐药[21-22]。本研究结果显示:八宝丹联合顺铂能明显降低胃癌耐药细胞的迁移和侵袭能力,抑制N-cadherin、Vimentin 蛋白表达,上调E-cadherin 蛋白表达,其联合结果比单一应用八宝丹和顺铂效果好,提示八宝丹联合顺铂可能通过下调N-cadherin、Vimentin 表达来抑制胃癌耐药细胞的迁移和侵袭,而E-cadherin的上调可能与癌细胞迁移能力降低及其对细胞死亡的敏感性有关。
EMT 另一个标志特征是上皮细胞完整性丢失,其通过激活基质金属蛋白酶(MMPs)等蛋白酶,降低上皮细胞间接触的黏附连接,并会降解上皮钙粘素,使细胞或细胞群侵入其细胞外基质使肿瘤细胞发生转移[23]。相关报道也显示:MMPs 的激活显著增加转移相关基因的表达,而MMPs 的低表达可以抑制胃癌细胞的迁移和侵袭[24]。本研究结果显示:八宝丹联合顺铂干预胃癌耐药细胞可降低MMP-2 和MMP-9 的蛋白表达,其降低程度较单一应用八宝丹和顺铂明显,提示八宝丹联合顺铂通过下调MMP-2、MMP-9 相关蛋白,抑制胃癌耐药细胞的迁移和侵袭,增加了胃癌耐药细胞对DDP 的敏感性。
综上所述,八宝丹联合顺铂通过上调E-cadherin 和下调N-cadherin、Vimentin、MMP-2、MMP-9蛋白的表达,抑制了胃癌耐药细胞的迁移和侵袭,增强胃癌耐药细胞对DDP 的敏感性。
