用于软骨下骨修复的镁基支架
2024-01-03王天畅张昌入刘朝宗王金武
周 茉,徐 翔,王天畅,强 磊,张昌入,杨 涵,刘朝宗,王金武
(1.上海交通大学医学院附属第九人民医院,上海 200011;2.骨科与肌肉骨骼科学研究所,外科与介入科学部,伦敦大学学院,皇家国家骨科医院,伦敦 HA7 4LP)
骨关节炎(osteoarthritis,OA)作为一种可以导致残疾的退行性疾病,常累及软骨下骨,导致骨软骨缺损[1-2]。软骨下骨包括软骨下皮质板和松质骨,位于钙化软骨的远端,在OA 发展的不同时期会发生不同的变化[3]。在OA 早期,由于重塑率增加,会发生软骨下板变薄,以及软骨下松质骨丢失[4]。在OA晚期,软骨下板变厚,松质骨丢失,钙化软骨向关节软骨推进,关节软骨变薄且发生纤维化[4]。软骨下骨的变化对关节软骨有明显的机械影响,与关节软骨的健康和完整性密切相关[5]。关节软骨具有黏弹性,会在压缩载荷下变形,而密度和刚度不均匀的软骨下骨会导致不同区域的关节软骨变形不一致。这种不一致所导致的张力和剪切力会增加上覆软骨撕裂和纤维化的风险[4]。
受损的关节软骨和软骨下骨很难自愈,用于功能修复的组织工程支架是一种有前途的治疗方法[6]。骨软骨支架应提供3D 梯度结构、合适的孔隙率、匹配的生物降解性、良好的生物相容性、初始机械强度和骨整合[7-8]。软骨下骨,作为维持骨软骨单元生物力学特征的关键因素,是骨软骨支架设计的重要考虑因素之一[9-10]。失败的软骨下骨修复不仅会影响关节处载荷的传导,还会影响所修复组织的长期功能[11-12]。目前,骨软骨支架主要包括单相支架、双相支架、多层仿生支架和连续梯度支架[13-14]。常用的材料主要有天然生物材料,合成材料,生物陶瓷,金属,脱细胞基质和复合材料[14-16]。其中,聚合物被用于模拟软骨层的黏弹性,金属合金和陶瓷则被用于模拟软骨下骨层的强度和刚度[17]。
在金属材料中,镁合金因其生物相容性、可降解性、显著的骨整合和接近人体骨的力学性能被越来越多的用于骨组织工程[18-20]。与机械强度过低的生物高分子聚合物(如聚乳酸、聚丙交酯-共-乙交酯和聚己内酯)[18],易碎的生物陶瓷,以及弹性模量过高的其他惰性金属材料(如不锈钢、钛合金和钴铬合金)相比,镁及其合金的弹性模量更加接近皮质骨的(皮质骨的弹性模量:5~23 GPa,Mg 的弹性模量:41~45 GPa)[21],既可以满足承重需求,又减少了应力屏蔽的风险[18,21-25]。结合多孔的结构设计,镁基支架的弹性模量可以接近松质骨的(2~5 GPa)[26]。此外,Mg 作为人体中常见的矿物质,不仅在许多生理功能(如代谢、蛋白质合成、神经肌肉兴奋性和激素分泌)中起到重要作用,还可以促进成骨[27-29]。
然而,镁合金较快的降解速率和较差的耐腐蚀性仍是其在医疗领域应用所面临的挑战[30]。在降解的早期阶段降解产生的氢气释放出来,会在人体形成气穴;过快的腐蚀也可能导致力学性能的快速下降[31]。目前,在控制降解速率方面已做了一些努力,包括改变微观结构和表面改性[32],即添加其他元素制成合金,或在镁基支架表面应用涂层。
镁及其合金作为金属可降解多孔支架的候选者,尚缺乏广泛的临床应用[30]。目前,对于适用于软骨下骨缺损修复的镁基支架的结构和孔隙设计还没有定论,且研究人员对于镁合金成骨机制的理解有限。因此,本综述归纳了镁合金用于骨软骨支架的研究进展,包括制造方法、材料优化、结构设计、以及其机械、降解和生物学性能,并讨论了未来研究的潜在方向,旨在为多孔镁基支架的开发和临床应用提供参考。
1 多孔镁基支架的制造方法
支架的多孔设计对于保证与人体组织匹配的力学性能和生物相容性十分重要[30,33]。300~500 μm的孔径、50%~75%的孔隙率被认为符合骨小梁的结构特点且可促进骨向内生长[20,30,34]。因此,理想的制造工艺应能对孔隙特征进行调控。传统的制造工艺,如熔模铸造[35]、真空发泡[36]、触变铸造[37]和定向凝固[38],不能满足需求。近年来,已开发出可控的多孔镁合金加工工艺,主要包括钛丝空间支架(titanium wire space holder,TWSH)、与空间支架技术相结合的粉末冶金和选择性激光熔化(见图1 和表1)。
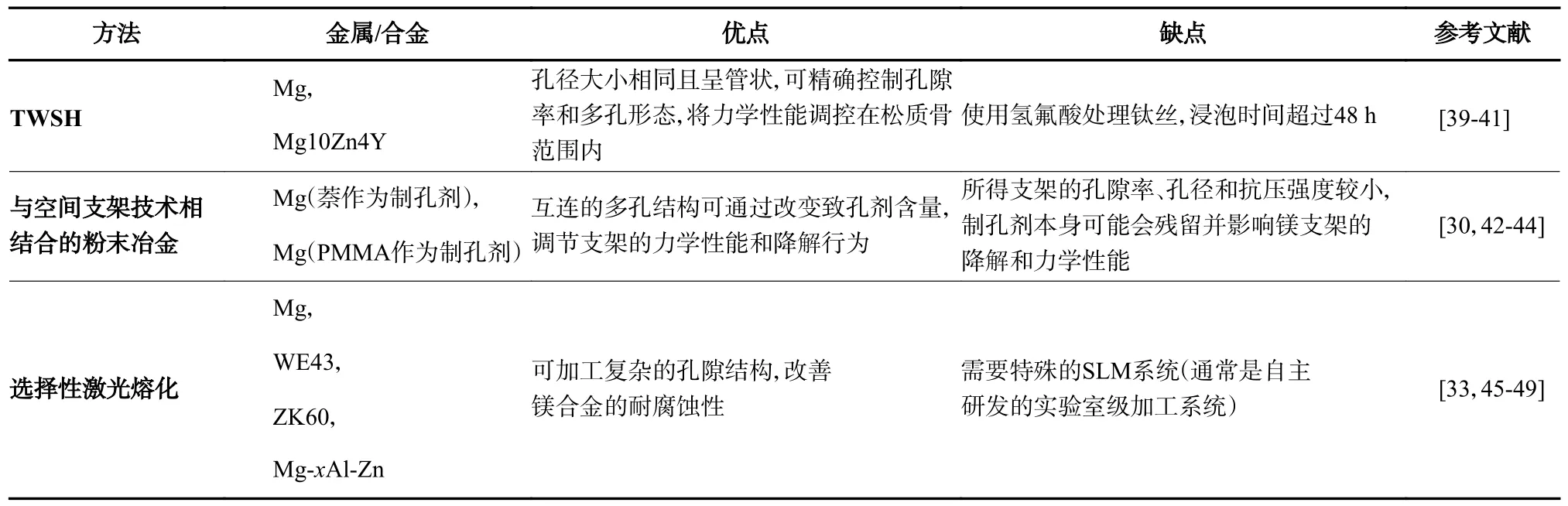
表1 3 种多孔镁基支架制造方式的优缺点Tab.1 Advantages and disadvantages of three fabrication methods for porous magnesium-based scaffolds
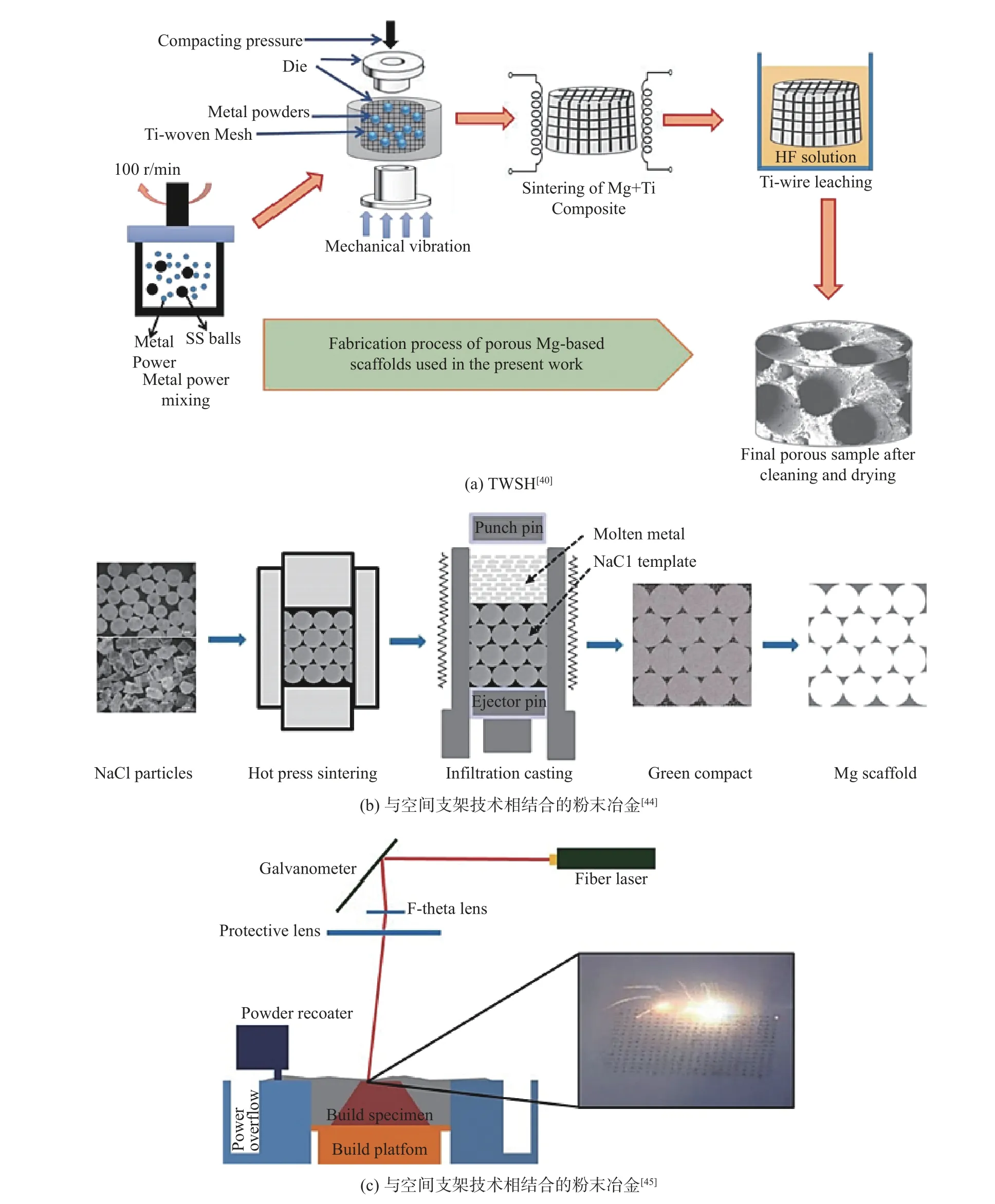
图1 3 种多孔镁基支架制造方式Fig.1 Three fabrication methods for porous magnesium-based scaffolds
TWSH 的基本原理是使用钛丝编织的3D 结构作为间隔物,将镁或其合金与钛丝一起加工,最后用氢氟酸将钛丝腐蚀(见图1a)[39]。孔隙参数通过调整钛丝的粗细和形态来控制,可以得到在人体松质骨范围内的孔径、孔隙率和力学性能[40]。Cheng 等[41]使用TWSH 方法,制造并比较了两个孔径不同(250 μm和400 μm)但孔隙率几乎相同(54%左右)的多孔镁支架,两个支架都表现出良好的细胞相容性和成骨细胞分化,且孔径较大的支架可以促进早期血管化。
传统的粉末冶金技术是将金属粉末压实并烧结,所得孔隙率取决于粉末颗粒的尺寸和形状[30]。为了获得受控的孔隙结构,可将其与空间支架技术相结合(见图1b)。这与TWSH 技术相似,孔隙的控制取决于作为空间支架的颗粒[42]。CO(NH2)2、NH4HCO3、NaCl、萘、樟脑和聚甲基丙烯酸甲酯(polymethyl methacrylate,PMMA)都可用作镁支架的空间保持颗粒,但可能会残留在镁支架的表面并对支架的力学性能和耐腐蚀性造成影响[30]。Bi等[43]使用上述方法制造了镁支架,以PMMA 为空间载体,得到的最大孔隙率为40%,抗压强度为25~170 MPa。Jia 等[44]将镁粉替换成镁锭,使用NaCl 作为多孔模板,用铸造的方式制备了多孔镁支架,得到了更大的孔径(200~350 μm)和孔隙率(68.54%~75.14%),但屈服强度仅1.35 MPa 左右。
选择性激光熔化(selective laser sintering,SLM)是一种增材制造技术,可以直接从金属粉末中快速制造3D 零件(见图1c)[45]。SLM 的整个过程在充满惰性气体(氩气)的环境中进行,使用光纤激光源作为能源,根据计算机辅助设计(computer-added design,CAD)文件定义的几何形状对粉末层进行选择性的熔化[45-46]。因此,SLM 可以制造使用传统技术难以生产的复杂组件[46]。此外,经过SLM 处理的镁合金表现出更高的耐腐蚀性,这可能得益于SLM 过程中的快速凝固[47-49]。Li 等[33]使用SLM 制造了具有金刚石晶胞结构的WE43 镁基支架,所得支架表现出良好的力学性能和生物相容性,压缩模量(700~800 MPa)接近小梁骨的,且在4 周后仍能保持机械完整性。
2 镁基支架的耐腐蚀优化
镁基支架较快的降解速率限制了其在医疗领域的应用推广。在中性环境中,Mg 降解会释放Mg2+、OH-和H2,导致局部碱化和Mg(OH)2在表面的沉积。释放的H2和OH-可能对细胞功能产生不利影响、降低植入物的细胞相容性、减少细胞存活率[33,50]。当Mg 腐蚀太快时,可能在局部形成气穴并导致植入物失效[50]。此外,体液中的Cl-会分解植入物表面的氧化物或氢氧化物层,导致点蚀。为提高镁基支架的耐腐蚀性,可以添加合金元素或表面改性。
2.1 用于镁基支架的合金元素
通过添加合金元素,可以显着提高Mg 的物理、化学和力学性能[51]。合金元素通过优化晶粒尺寸和形成金属间化合物来改变镁合金的耐腐蚀性和机械强度[52]。目前,广泛使用的合金元素有Al、Zn、Ca、Mn、Li 和稀土元素(rare earth element,REE)。其中,Al、Ca 和Li 是轻度毒性元素,某些REE(如Y)为中度毒性元素,Mn 和Zn 为重度毒性元素[53]。Al 具有非常低的密度和硬度,是强度质量比最好的金属之一,通常用于改善镁的力学性能和耐腐蚀性能[54],但有关Al 含量对铝镁合金腐蚀行为影响的研究较少[55-56]。此外,Al 是阿尔茨海默病的危险因素,可导致肌肉纤维损伤[57],因此不建议将铝镁合金用于人体[58]。Zn 是人体必备的营养素,且具有良好的降解行为,腐蚀反应较为温和[59]。镁锌种植体在骨和血管组织中表现出优异的生物相容性[60]。Zn 能够将Fe、Cu 和Ni 等杂质转化为无害的金属间化合物,从而降低其腐蚀作用[61],但过量添加会加速腐蚀[62]。Ca 是人体骨骼的主要成分,镁钙合金是最适合构成骨骼矿物相的合金体系,常用于增强生物相容性和力学性能[63]。增加Ca 含量可提高合金的硬度[64],但会降低其耐腐蚀性[65]。Mg-0.5Ca 合金系统可能是可生物降解骨植入应用的良好候选者[54]。Mn 通常用作镁合金中的次要元素,可以添加在镁铝合金中提高合金的力学性能和耐腐蚀性[66-67]。与Zn 类似,Mn 可以将Fe 和其他杂质转化为无害的金属间化合物来提高含铝镁合金的耐腐蚀性能[61],但过量添加Mn 会形成大量含Mn 的金属间相,产生电偶效应,降低镁铝合金的耐腐蚀性[67]。Li 的添加有利于提高耐腐蚀性,而质量分数超过9.0%则会降低耐腐蚀性[68-69]。有研究表明,当Li 质量分数超过5.5%时,合金的显微组织发生变化,强度下降,塑性增加[70-71]。REE 包括17 种元素,即15 种镧系元素、Sc 和Y。它们通常作为母合金或硬化剂被添加到镁合金中,可以通过固溶和沉淀硬化来提高其强度和耐腐蚀性[58]。目前,添加了Y、Nd 和Gd 的WE43 合金已成为非常有限的已实现临床应用的可生物降解金属之一[72-73]。
2.2 镁基支架的表面改性
优化镁合金的另一种方法是表面改性,即在原本的镁基支架表面添加涂层。表面涂层根据基材是否参与可分为两类,转化涂层和沉积涂层(见表2)。转化涂层通过镁基体和涂层溶液之间的化学或电化学反应,在原位形成紧密附着的镁化合物[74]。相比之下,沉积涂层是在没有基材参与的情况下异位形成的,其结合强度由涂层与基材或涂层与涂层间相互作用决定[75-76]。沉积涂层主要是无机涂层和聚合物。聚合物除了作为物理屏障外,还可以作为生物活性化合物(例如药物或骨相关蛋白)的载体,带来额外的生物功能[74]。可生物降解的聚合物表面涂层已被证明是一种直接有效的策略,可以延缓镁及其合金的快速降解并提高其生物活性[32,77]。

表2 不同涂层对镁合金的影响Tab.2 Effect of different coatings on magnesium alloys
对于转化涂层,表面磷酸化被认为可以提高镁基材料的耐腐蚀性以及表面生物活性[78]。P 是一种营养元素,特别是对于人体骨骼生长而言,因此镁基材料的表面磷酸化在骨科应用中更有前景[79]。碱处理也可对镁基材料进行改性形成Mg(OH)2涂层,抑制腐蚀行为[80]。然而,Mg(OH)2易被Cl-攻击而转化为高水溶性的MgCl2,因此该涂层不宜在富含Cl-的生理环境中长期使用[79]。与Mg(OH)2相比,MgF2在生理环境中更稳定。然而,形成MgF2所使用的氢氟酸有毒且对环境有害。
对于沉积涂层,磷酸钙(Ca-P)涂层可以有效延缓镁合金的初始腐蚀[81]。Ca-P 涂层的成分与天然骨的无机成分相似,具有诱导成骨和骨整合的特性[82]。此外,具有良好的生物相容性和降解性的聚合物,包括天然聚合物和合成聚合物,也已被广泛研究。应用聚合物涂层所面临的一个挑战是镁基体快速腐蚀导致的聚合物涂层脱落。如,聚乳酸涂层在两周内可将镁基支架的腐蚀速率降低1.5 倍,但长期效果几乎与无涂层样品相似,这是由于聚乳酸保护层被镁腐蚀产生的氢气或被其本身的水解体降解所破坏[83-84]。复合涂层或者多层涂层可以改善这一问题,如在添加聚合物涂层之前,先添加MgF2、Mg(OH)2或HA 涂层[85-87]。此外,复合涂层还可能带来更好的耐腐蚀性和生物相容性[87]。
3 镁基支架的结构设计
镁基支架的结构设计可以影响其机械、降解以及生物学性能,镁基支架结构包括正交、非参数化晶胞、三周期极小曲面(triply periodic minimal surface,TPMS)、Voronoi、CAD 仿生和编织6 种(见图2 和表3)。

表3 不同镁基支架结构的优缺点Tab.3 Advantages and disadvantages of the structure of different magnesium alloy scaffolds

图2 镁基支架结构设计示意图Fig.2 Schematic diagrams of the structure design of magnesium alloy scaffolds
正交结构是最常见的支架结构(见图2 a),设计简单且易于制造。然而,正交结构会导致交叠处的应力集中和受力时的逐层塌陷[91-92]。比正交结构更复杂的是非参数晶胞设计,这通常是基于立方体和其他多面体结构设计的,常用的是金刚石晶胞(见图2b)[93]。这些非参数化的晶胞设计有着比正交结构更好的力学性能,但依然无法避免支柱连接点处的应力集中[94]。
金属制造技术的发展使更复杂的参数化结构设计的制造成为可能。TPMS 是平均曲率接近于零的3D 周期性表面,具有大的表面积和连续的内部通道(见图2c)。TPMS 具有的高表面积体积比和高渗透性有助于营养物质传输和细胞渗透[95-96],也有助于增强细胞的粘附、迁移和增殖[97]。此外,与规则的晶格结构支架相比,无限连续的表面和光滑的接缝确保了更少的应力集中和增强的力学性能[98]。TPMS 的形态可以通过隐函数精确控制,包括曲率、孔隙率和孔径大小[99]。
除了规律的孔隙设计,一些随机的仿生孔隙设计也引起了研究人员的兴趣。Voronoi 设计是由特定体积中的一组点形成的,这些点可以随机分布,也可以根据应用以特定的方式分布(见图2d)[100]。通过对细胞规律性和相对密度等参数进行优化,可以得到类似于天然骨的结构[101-102]。另一种仿生天然骨小梁设计的方法是CAD 建模(见图2e)[89,103]。然而,这两种仿生设计结构的力学性能均未超过TPMS 设计的力学性能,且随机生成的较细的支柱可能导致较高的断裂风险[89,102-103]。
近年来,在结构设计方面也有新的探索。一种是通过编织控制孔隙(见图2f),编织的结构能提供优异的延展性和韧性。可惜的是,这种支架的力学性能较差,不在松质骨范围内[18]。此外,在基本设计的基础上,目前也有梯度设计和混合设计。例如,Shi 等[104]的研究证明,梯度设计可以降低应力屏蔽,Fousová等[105]则证明了分层梯度支架比均匀的多孔结构支架具有更好的力学性能。Yue等[102]设计的两种TPMS 的混合结构也表现出良好的力学性能和压缩时均匀的应力分布。
4 镁基支架的力学性能
作为软骨下骨层的镁基支架需承担重要的机械传导任务。制造工艺、合金组成、孔隙以及结构设计,都会影响支架的力学表现(见表4)。
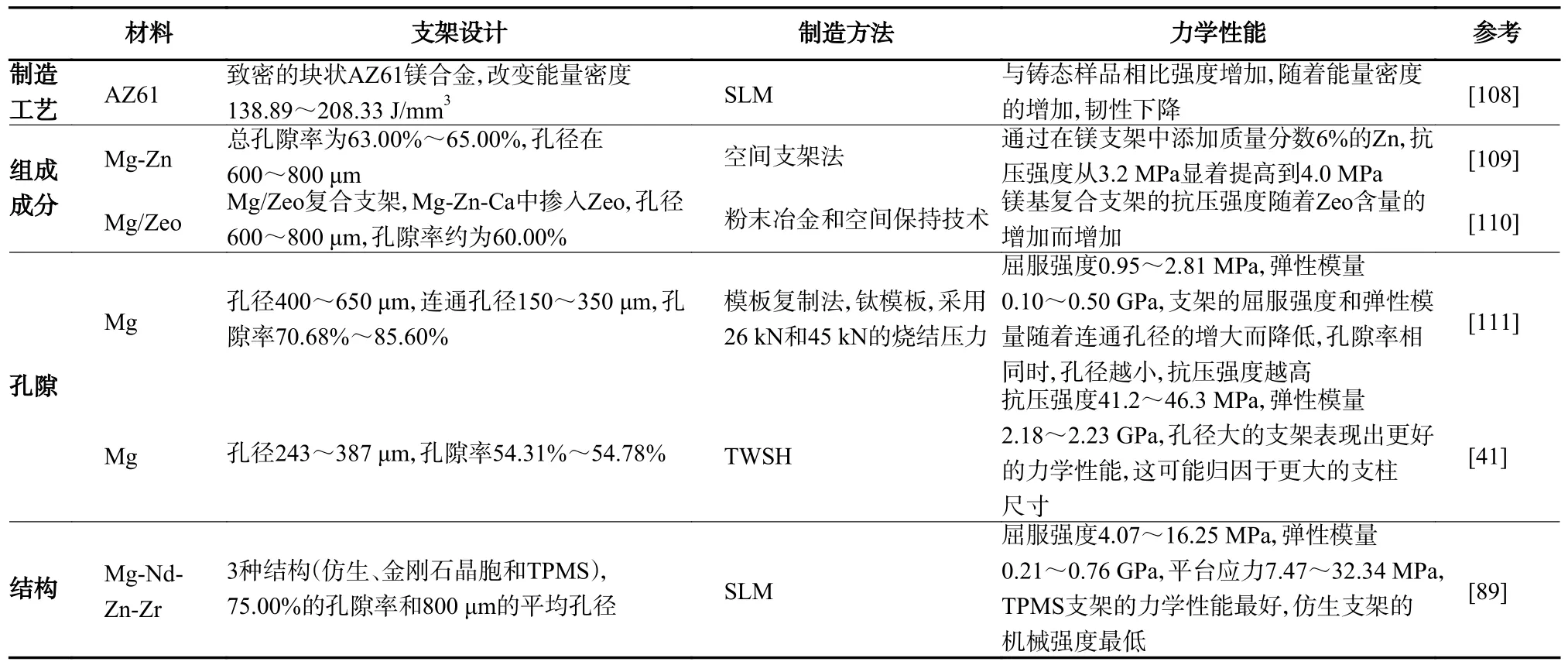
表4 制造工艺、合金组成、孔隙以及结构设计对镁基支架力学性能的影响Tab.4 Influence of manufacturing process,alloy composition,porosity and structural design on the mechanical properties of magnesium-based scaffolds
制造工艺本身的缺陷可能会影响力学性能。例如,在由与空间支架技术相结合的粉末冶金制造的支架中,可以观察到两种孔,一种是占位材料留下的孔,一种是由制造过程中不完全压实产生的小孔。这种小孔会影响力学性能,应通过优化制造过程和调整合金颗粒的大小和形状来减少[106]。相比之下,SLM 生产的镁及其合金由于高冷却速率和快速凝固而具有细化的晶粒,因此也表现出更高的硬度[46,107-108]。
镁基支架的组成也会影响其力学性能。适量添加合金元素(如Al、Zn、Ca、Mn 和REE)可以优化力学性能。此外,在镁复合材料支架中,力学性能的增强得益于其他材料颗粒的掺入[109-110]。
孔隙对抗压强度的影响是复杂的,孔径、孔隙率和支柱厚度共同影响着支架的力学性能。一些研究显示出随孔隙率或孔径增加而力学性能降低[111],但在另一些研究中的结论是相反的[41],这与支柱部分的不同厚度有关。此外,支架的结构设计也会影响力学性能,与其他常见的结构相比,TPMS 被证明有着更好的应力分布和压缩强度[89]。
5 镁基支架的降解行为
考虑到人体的自然骨愈合机制,可降解支架应为缺损部位提供12~24 周的机械支撑,并在1~2年内完全降解[112-113]。
5.1 体外降解
镁基支架的体外腐蚀模式可以通过失重法、析氢速率、pH 变化和电化学测试来评估。腐蚀过程中的微观结构改变可以通过X 射线计算机断层扫描(X-ray computed tomography,XCT)评估[88]。体外腐蚀测试常用静态磷酸盐缓冲盐水(phosphatebuffered saline,PBS)[42]。此外,也有研究者提出了其他符合体内环境的溶液供选择。例如,Zainal 等[114]使用碳酸氢盐缓冲Hank 溶液模拟人体血液环境,将样本浸泡7~14 d,得到的体外腐蚀速率与体内相似。
对于体外腐蚀行为的测定时长尚没有统一的规定,一些研究中只探索了浸泡24 h 后或几天内的腐蚀情况[42],而在另一些研究中这个时间超过两个月[88]。用于软骨修复的支架应保证两个月的机械完整性,然后快速降解,以允许营养运输和细胞长入[20]。因此,有必要进行长时间的腐蚀性研究。镁基支架在体外的腐蚀行为随时间而改变。Wang 等[89]的研究表明,Mg-Nd-Zn-Zr 镁基支架腐蚀所释放的Mg2+在前3 d 内迅速增加,并在第7 d 开始下降。
镁合金的体外降解行为会影响支架的力学性能和生物学性能。Hedayati 等[116]对多孔镁基支架的腐蚀行为以及力学性能进行了研究。结果表明,腐蚀造成的矿物沉积会对支架的力学性能产生影响,导致短期内(6~12 h)弹性模量增加。此外,有研究表明,Mg 降解导致在其表面产生Ca-P 沉淀,可诱导骨传导,增强成骨细胞反应和细胞生长[30]。Mg 降解产生的局部碱性微环境还可以使镁基支架在体外和体内均表现出抗菌作用[49]。
5.2 体内降解
为了实现最佳的软骨组织修复,植入后前两个月的机械稳定性至关重要。如果合金在体内降解太快,则无法在支架上完成充分的软骨修复[117]。
现阶段的体外腐蚀测试无法完全模拟植入物在人体内的腐蚀行为[118]。Witte 等[119]使用ASTM标准体外腐蚀试验对比了铸造镁合金LAE442 和AZ91D 的体内和体外腐蚀速率,发现体内测试获得的腐蚀速率比体外测试获得的腐蚀速率小大约4 个数量级;此外,两种镁合金体外腐蚀试验得到的腐蚀速率趋势与体内试验得到的腐蚀速率趋势相反。这可能是因为体内体外的环境不同,如体内动态变化的电解质[120]、新骨长入对局部电化学条件的改变[121]、术后降低的pH、与体外相比含量较低的Cl-[120]、以及粘附在植入物表面的蛋白质[119,122]。
5.3 孔隙和载荷对降解的影响
一般来说,镁支架的降解行为取决于其多孔结构、成分、微观结构和表面条件[30]。孔结构以及其他因素对腐蚀的影响如表5 所示。通常认为,多孔支架的耐腐蚀性与其孔隙率呈负相关。因为孔隙率更大的支架往往具有更多的连接面积和更好的溶液运输条件,从而加快了化学反应的速率[123]。在孔隙率相同时,耐腐蚀性与孔隙的结构有关[89],但与孔径的关系不大[41,111]。Jia 等[124]比较了具有球形孔和不规则多面体孔的两种支架之间的降解速率,在两种支架中观察到了类似的降解模式,即外部和内部孔支柱之间不同的沉积速率。与具有多边形孔支柱的支架相比,球形孔支架中的凸孔支柱几何形状减小了局部厚度。因此,它的降解速率相对较高。支架结构与腐蚀之间的关系表明,精确控制支架结构,可以一定程度上实现对支架降解速率的控制。除了支架本身的设计对降解的影响,原位载荷也会加速降解[88]。这可能是由于载荷的加载形成了疲劳微裂纹,破坏了局部涂层。
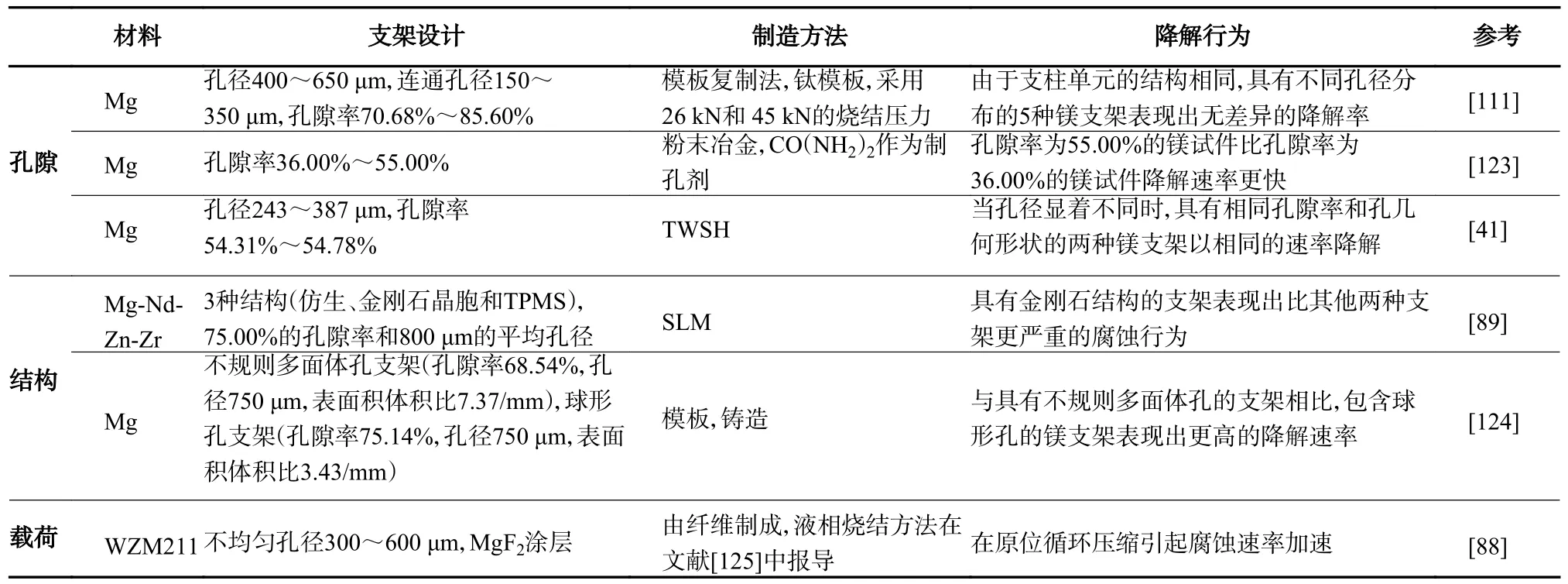
表5 孔隙、结构、载荷对镁基金支架降解行为的影响Tab.5 Effect of porosity,structure and load on the degradation behaviour of magnesium-based scaffolds
6 镁基支架的生物学特性
6.1 体外评价
6.1.1 生物相容性
镁基支架需要特殊的细胞毒性测试。新开发材料的毒性测试通常通过IOS: 10 993-5 和10 993:12进行,包括基于提取物的测定、直接接触和间接接触以研究细胞—支架相互作用。然而,对于未经处理的多孔镁基支架来说,由于其初始快速降解,这些测试方法可能不适合。降解导致的高浓度镁提取物、高渗透压和高pH,都可能在体外导致细胞死亡[126]。而在人体中,这种高浓度的局部产物会由代谢运输过程调节。因此,可以使用生物反应器来模拟体内情况[20],或者使用基于发光(BrdU)的细胞毒性测定,因为该测定不会受镁支架腐蚀的干扰[127]。此外,另一种被广泛使用的方法是使用稀释条件下的提取物进行测定[128-129]。为了更好地模拟体内情况,建议使用10 倍的提取比[130-131]。根据Dong 等[129]的研究结果,在10% Mg-Zn 提取物中培养3 d 的细胞形成汇合层,并显示出具有发达的应力纤维的铺展形态,然而,在50% Mg-Zn 提取物中只能观察到少数扩散的细胞,在100% Mg-Zn 提取物中,几乎没有任何细胞。
在对镁基支架的直接细胞培养中,Dong 等[129]的实验显示出前成骨细胞MC3T3-E1 在Mg-Zn 支架支柱上的良好粘附和均匀分布(培养3 d 后),与在Ti-6Al-4V 支架上生长的细胞相比,在镁基支架上生长的细胞扩散程度较小。Li 等[33]在实验中观察到类似的结果,在WE43 支架上接种的人成骨细胞样细胞系MG-63 比在Ti-6Al-4V 支架上接种的细胞形态更加浓缩。然而,Li 等[33]发现,与WE43相比,Ti-6Al-4V 支架表现出更有效的细胞粘附,在WE43 支架上观察到了更多的细胞死亡,在接种24 h 后,只能检测到很少的活细胞(见图3a)。这种差异可能是由不同的细胞选择、培养时间和合金成分引起的。此外,有研究[124]表明,镁基支架的3D 多孔结构也会对细胞粘附产生影响,与具有球形孔的支架相比,由于具有更高的比表面积,具有不规则孔的支架上的初始细胞附着数量更多(接种6 h 后)(见图3b)。

图3 镁基支架的体外生物相容性和体外成骨。Fig.3 In vitro biocompatibility and in vitro osteogenesis of magnesium-based scaffolds
6.1.2 体外成骨
一些特定的基因或蛋白在骨组织的生长发育过程中起着重要作用,包括成骨标志物核心结合因子(RUNX2)、成骨相关转录因子(osterix,Osx)、骨钙素(osteocalcin,OC)和碱性磷酸酶(alkaline phosphatase,ALP)等,镁通过调节参与间充质干细胞成骨分化各阶段的基因和蛋白的表达来促进成骨[133]。研究中常用ALP 活性的染色结果来评估镁基支架的体外成骨能力[132,134](见图3c)。
目前,镁基支架降解所释放的Mg2+对骨髓干细胞(mesenchymal stem cell,MSC)的调节机制尚不完全清楚。现有的研究涉及Notch 信号通路[135],PI3K/AKT 信号通路[136],MAPK/ERK 信号通路[137],以及TRPM7/PI3K 信号通路[138]。此外,镁基支架降解所释放的OH-也在MSCs 的成骨分化中发挥作用。随着培养基pH 的升高,骨桥蛋白(osteopontin,OPN)的表达逐渐增加,而成骨分化相关基因在pH 8.5 时开始逐渐减少[139]。
不同浓度的Mg2+可以通过调控自噬来影响骨分化。自噬是一种高度保守的分解代谢过程,抑制自噬会抑制骨基质的矿化,导致骨重塑能力减弱[140]。高浓度(1.0 mmol/L)的Mg2+可通过减弱自噬活性来抑制成骨分化[141]。低浓度(0.1 mmol/L)的Mg2+可以增强自噬水平,促进MSC 的成骨分化[142]。然而,也有研究表明,Mg2+的浓度≤10.3 mmol/L 的镁支架不会抑制MSCs 的活性和成骨分化[132]。目前,只有少数研究探讨了镁生物医学材料或Mg2+对MSCs 的调节作用,缺乏广泛的共识。因此,需进一步研究有关Mg2+参与成骨分化的机制。
6.2 体内评价
宿主组织与支架的相互作用、支架的降解、新形成组织的向内生长、新血管生成和炎症反应是支架设计所应考虑的因素。在支架植入后的前两周,其主要特征是宿主炎症反应的启动和发展。随后是支架的降解和新血管生成。最后,支架失去其完整性和力学性能,被新形成的纤维组织取代[20]。
6.2.1 炎症反应
低浓度的Mg2+可能具有抗炎作用。据报道,在培养液中添加5 mmol/L 的Mg2+,可降低LPS 和IFN-γ 刺激的巨噬细胞中TNF-α、IL-6 和IL-1β 的mRNA 表达[143]。此外,低镁血症可促进慢性低度炎症,导致TNF-α 和IL-6 水平升高[144-145]。
相反地,高浓度的Mg2+通过诱导NO 的合成,可促进炎症反应[146-148]。根据Xie 等[149]的研究,镁基植入物快速降解所导致的Mg2+高浓度显示了促炎反应的上调,上调了TNF 信号通路,增加了体外促炎M1 表型的比例,导致巨噬细胞的吞噬能力增强。
镁基植入物引起的过度激活的炎症反应可能会对骨修复产生负面影响[149]。然而,Witte 等[150-151]认为,即使是快速降解的镁基支架也表现出良好的生物相容性,在体内具有适当的炎症宿主反应。他们将镁合金AZ91D 制成的开孔支架植入家兔股骨远端髁中,并在3 个月后进行了组织学分析,镁基支架已经很大程度上降解,纤维囊包围了手术部位,没有对其邻近组织造成明显伤害。在Cheng 等[41]的研究中,具有较大孔径的镁基支架与具有较小孔径的镁基支架相比,引发了更严重的炎症反应,但也诱导了更多的成骨和血管化。此外,镁支架降解释放的Mg2+引起的炎症反应还具有消除细菌感染的潜力[149]。研究表明[152-153],高Mg2+培养的RAW 264.7 细胞中TNF-α 和iNOS 的浓度显著增加,诱导型iNOS 产生高水平的NO,而NO 对感染性关节炎的细菌清除至关重要,缺乏iNOS 的小鼠更易受细菌感染。
6.2.2 成骨和血管化
镁基支架具有优异的力学性能和骨整合能力,可诱导形成更成熟的骨[150,154-155]。高Mg2+浓度可能会导致骨细胞活化[156]。有研究表明,即使镁合金具有较快的降解速率,也不会对周围的软骨组织造成负面影响,并且可在降解植入物的边缘观察到新骨形成[117]。von Kossa 染色可在降解镁支架附近显示检测到的生物矿化骨体积,与自体骨移植相比,镁支架附近的骨生长密度更高且具有显著差异,这可能是因为降解镁支架附近的成骨细胞和破骨细胞活性增加,导致了更成熟的骨结构的形成[150,154]。此外,与自体骨移植相比,在镁支架植入组观察到小梁分离减少和小梁数量增加[150,154]。
孔径及其在支架内的互连性对于血管向内生长至关重要,更大的孔径会导致更多炎症反应,促进血管化和成骨[157],因为植入部位代谢活跃的成骨细胞需要充足的O2、必需元素和营养物质的供应[41]。根据Cheng 等[41]的研究,在相同孔隙率下,孔径较大(387 μm)的支架可以促进早期血管化,上调I 型胶原和OPN 表达,从而导致更高的骨量和更成熟的骨形成,但背后的机制尚不完全清楚。
7 结论
近年来,多孔可降解镁基支架在组织工程领域引起了广泛关注。镁及其合金因其生物相容性、可降解性、显著的骨整合和接近人体骨的力学性能,已成为可降解多孔支架有希望的候选者,适用于软骨下骨缺损的修复。目前,TWSH、与空间支架技术相结合的粉末冶金和选择性激光熔化都是可以调控孔隙特征的制造方式。然而,镁及其合金的精确加工仍是挑战,需要开发更安全简易可控的加工方式。CAD 的使用丰富了支架的结构设计,也对制造精度有了更高的要求。镁基支架的另一个挑战是较快的降解速率。尽管已经有大量文献研究了镁及其合金的体外和体内降解行为,并尝试通过添加合金元素和表面涂层的方式来减缓降解,但仍未实现在体内保持12~24 周机械完整性的目标,还需要进一步的研究。将合金和涂层研究,与支架的参数化结构设计相结合,实现降解行为可控的支架开发。此外,研究人员目前对镁基支架促进成骨的调节机制尚不完全清楚,只有少数研究探讨了镁生物医学材料或Mg2+对MSCs 的调节作用,缺乏广泛的共识。因此,需要进行更多有关Mg2+参与成骨分化机制的研究。
