医用多孔钛合金表面改性技术研究进展
2024-01-03王柄皓杨成亮吕玉廷王立强
王柄皓,杨成亮,吕玉廷,王立强
(1.广西壮族自治区骨与关节退行性疾病生物医用材料工程研究中心,广西 百色 533000;2.广西骨与关节退行性疾病基础研究与转化重点实验室,广西 百色 533000;3.右江民族医学院附属医院,广西 百色 533000;4.山东科技大学 机械电子工程学院,山东 青岛 266400;5.上海交通大学 金属基复合材料国家重点实验室,上海 201100)
医用金属材料能发挥替代和修复受损组织、维持人体功能的作用[1]。钛合金是应用最广泛的金属材料之一。传统Ti6Al4V 等钛合金弹性模量(约为110.0 GPa)远高于人体组织的(0.3~30.0 GPa),长期存在人体中易引起“应力屏蔽”效应[2]。将三维多孔结构引入到钛合金植入物设计中,能够显著改善植入物的力学性能,加强与人体组织的结合。此外,多孔钛还可以为心脑血管疾病治疗提供良好的支撑作用,提升治疗效果。多孔钛的制备工艺经历了粉末烧结、浆料发泡、纤维编制、凝胶注模等阶段的发展[3],得益于增材制造技术的兴起及器械结构设计方法的改进,通过调整结构参数(结构单元、孔径、孔隙率、梯度分布)能够实现多孔钛合金强度、模量等力学性能的精准调控[4]。作为一种具有优异力学性能的新型生物医用材料,多孔钛已广泛应用于人工关节、脊柱融合器、牙种植体、骨修复产品、人工心脏瓣膜、心血管支架等医用器械产品[5](如图1所示)。

图1 常见的医用多孔钛合金产品[6]Fig.1 Common medical porous titanium alloy products[6]
然而,随着临床要求的提升,多孔钛还需具备成骨诱导、靶向治疗、抗菌灭菌、耐磨、耐蚀等功能。表面改性通过化学或物理方法改变材料形貌及表面性质,在材料功能提升方面发挥了重要作用[7]。
1 多孔钛表面传统改性方法
多孔钛具备复杂的内部微小结构,其孔径范围在几十微米到上千微米之间[8],钛合金板材改性中常用的激光熔覆[9]、搅拌摩擦[10]、离子注入[11]等工艺难以深入材料内部。因此,多孔钛的改性多在流体(气体、液体)介质中进行,以适应复杂弯曲的多孔结构,通过改变材料表面形貌或添加功能成分发挥作用[12]。本节以表面改性原理、负载成分性质为标准进行分类,总结了传统多孔钛表面改性工艺及影响因素,对比了不同方法间的效果及优缺点。
1.1 蚀刻法
化学试剂、强酸等对钛合金具有一定的腐蚀作用,影响材料的表面形貌及粗糙度,而材料表面粗糙度又是影响细胞、蛋白质及细菌吸附、迁移和分化等过程的重要条件。蚀刻时间、蚀刻剂的种类、浓度等是常见的变量[13]。
Civantos 等[14]研究了氟氢酸蚀刻时间(125、625 s)对粉末烧结多孔Ti 钛支架体外细胞行为的影响。对孔径为355~500 μm 的支架中蚀刻125 s后,材料的平均表面粗糙度(Sa)从初始状态的26.7 μm 升高到39.6 μm,随着蚀刻时间达到625 s,其平均表面粗糙度增加至47.2 μm。细胞实验发现,表面特征不仅影响成骨细胞的粘附,还通过增加骨基质蛋白(包括ALP、胶原蛋白、骨桥蛋白和骨钙素)的产生促进成骨细胞分化。然而,蚀刻在改善材料表面结构的同时会造成材料强度的下降。Wang 等[15]研究了含质量分数20%盐酸溶液中蚀刻时间对多孔钛力学性能的影响。材料在盐酸溶液中内外表面发生点蚀和晶界腐蚀,随着时间推移,蚀刻坑的数量和尺寸(直径和深度)显著增加,150 min 后材料强度从152 MP 下降至106 MPa。
蚀刻法操作简单、成本低,在早期表面改性中发挥重要作用,但表面形貌难以控制,且可能会对材料造成损伤,限制了其应用。
1.2 化学浸渍/涂敷/沉积
化学浸渍/涂敷/沉积是将Ca/P 等生物活性无机盐或聚多巴胺(polydopamine,PDA)/多肽/氨基酸等有机化合物作为先驱体,在液相中混合均匀后,经过浸渍、沉积或化学反应在多孔金属材料表面形成涂层的方法。
羟基磷灰石(hydroxy-apatite,HA)和磷酸钙(calcium phosphate,Ca-P)是钛合金改性中最常用的无机材料。Yuan 等[16]采用沉积法在多孔Ti6Al4V支架表面包覆羟基磷灰石颗粒(hydroxyapatite particles,HAP)。体外细胞试验显示,沉积HAP 的Ti6Al4V 支架诱导hFOB1.19 细胞凋亡无统计学增加,HAP 涂层组相比空白对照组呈现更高的CCK-8 值。通过碱热反应对多孔钛支架预先进行活化处理,是促进元素沉积的重要方式[17]。Wang 等[18]将多孔TiNbZr 合金浸入氢氧化钠溶液中加热处理后,在模拟体液中浸泡一周使Ca/P 元素均匀沉积在支架表面。细胞培养实验表明合成Ca/P 材料显著提升了骨整合效果,增强了间充质细胞表型成骨谱系和成骨细胞合成活性。
有机化学物质涂层主要是依靠材料表面吸附,或生物活性分子与材料发生反应,在表面形成致密的有机活性分子层[19]。由于钛合金表面缺乏官能团,事先一般需利用酸碱进行活化处理,使其表面富含羟基用于固定接头分子(如壳聚糖等),再将有机物(如蛋白质等)与固定接头分子反应固定。吴小玉等[20]将多孔钛合金浸泡在碱性PDA 溶液中,通过PDA 自聚合反应在样品表面形成一定厚度的 PDA 涂层。生物矿化实验显示,PDA 含有的酚羟基与钙离子作用,能为HA 提供较多的形核位点,提高表面生物矿化性能。随后其又在PDA 基础上加入酪蛋白磷酸肽(casein phosphopeptide,CPP)分 子,PDA-CPP 复合涂层中丰富的磷酸丝氨酸基团为HA 提供了更多的形核位点,且CPP 周围的钙离子浓度较高,使得复合涂层诱导HA 的能力明显提高。除了PDA 与多肽外,诸如细胞外基质蛋白、生长因子、多糖和核苷酸等也用于生物活性有机物性[21]改性之中。
化学浸渍/涂敷方法成本低、操作简便,部分有机涂层在抗菌及促进成骨作用时针对性强。但诸如HA 等无机涂层与材料结合不牢,在循环负载作用下易断裂脱落,影响其治疗效果。
1.3 电化学法
电化学法是将金属材料作为电极置于电解液中,通过氧化还原反应在材料表面形成多孔氧化物或含特定成分涂层的方法。按照反应类型及作用原理主要分为阳极氧化、微弧氧化(micro-arc oxidation,MAO)、电化学沉积工艺等。
阳极氧化法是以金属钛或其合金为阳极,置入氢氟酸体系电解液中,在外部电流的作用下经过:(1)氧化膜的建立;(2)腐蚀坑的形成与发展;(3)纳米管的生长等阶段,在金属表面生成一层有序氧化物纳米管阵列(如图2 所示)。Liang 等[23]在乙二醇中加入一定量的水和氟化铵作为电解液,以钛螺钉作为阳极,设置10、15、20、25 V 不同电压并持续通电40 min。通过对材料表面观察发现,螺钉不同位置的碳纳米管结构具有差异,这是由于反应中材料表面电流密度大小与材料尺寸、位置相关,影响纳米管的生成。Hamlekhan 等[24]以0.2%HH4F(质量分数)溶液为电解质,置于49 mL 乙二醇和1 mL 去离子水溶液中。采用60 V 直流电流分别对CP-Ti 表面和Ti6Al4V 表面进行阳极氧化并探究其生物性能。成骨细胞培养实验表明,相同基体材料下,纳米管的存在增加了细胞的总密度;而不同基体材料间,Ti6Al4V 由于Al 和V 合金元素的析出导致细胞密度低于CP-Ti 材料表面。电化学参数、基体材料性质,尤其是电解液成分对碳纳米管的形成发挥重要作用。阳极氧化过程中含氟电解质溶液经历了硝酸、氟盐类、贫水有机电解液体系的发展,对碳纳米管的管壁厚度、直径、长度、孔径大小等结构参数产生重要影响[22]。
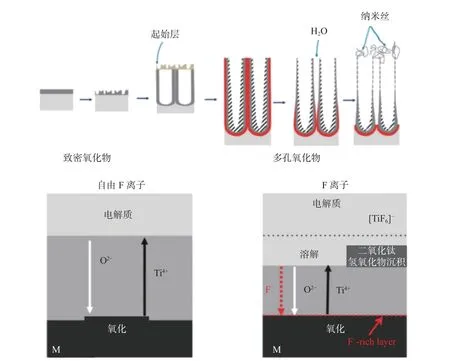
图2 阳极氧化TiO2 纳米管形成过程[22]Fig.2 Formation of TiO2 nanotubes by anodic oxidation[22]
MAO 是在阳极氧化基础上提高电压或电流,利用强电压产生微弧放电及局部高温,使放电通道中电解液离子在高温下气化,形成等离子体并与多孔植入物发生氧化反应,从而生成以TiO2为主要成分的多孔氧化物涂层[25]。Luo 等[26]配制Ca(CH3COO)2·H2O、(NaPO3)6、Na2SiO3、NaOH 等为主要成分的电解质溶液,设置工作电压540 V、电流脉冲1~2 A/dm3、频率为800 Hz、占空比为6 的参数对多孔口腔种植体进行MAO 处理。在材料表面形成了厚度为6~7 μm 的含HA 微/纳米结构层。涂层中Ca 元素及多孔结构显著提升细胞的活力,增加了体内新骨的形成。与阳极氧化相比,MAO 制备的涂层硬度大、结合强度高、抗磨损性好。在该工艺中,涂层的质量主要受到MAO 工艺参数(如电解液的成分、温度、电压、电流密度、氧化时间等)影响。
电化学沉积也称为电沉积、电泳沉积或电镀,是使用电流通过氧化还原反应将材料(金属、聚合物、陶瓷、玻璃及其复合材料)沉积到基体材料上的方法[27]。Vidal 等[28]对墨水直写(direct ink writing,DIW)技术制备的多孔钛支架进行脉冲电沉积,实现Ca-P 涂层的均匀覆盖。抗菌试验结果显示,生物功能化支架对革兰氏阳性和阴性菌株显示出抗菌活性,有效改善骨科植入物的生物整合特性,同时减少种植体周围的感染。此外,研究人员还将Cu、Zn、Ag、Mg、Ta 电镀到材料表面提升耐磨/蚀性能及生物相容性[29]。Guo 等[30]利用电镀在钛支架表面制备钛铜/氮化钛铜涂层。通过体内外生物实验评估支架的性质、骨整合能力。结果表明,人骨间充质干细胞(human bone mesenchymal stem cells,hBMSCs)在涂层支架上的增殖和粘附效果比未加涂层支架上更好。涂层在吸附hBMSCs、上调SDF-1a/CXCR4 等基因表达,刺激细胞外信号相关激酶(Erk)和Akt 信号通路方面发挥出重要作用。除铜元素具有优异生物活性外,TiN 还表现出优越的抗腐蚀能力。与普通化学沉积相比,电化学沉积制备的涂层材料均匀性更好、厚度范围更大、结合强度更高。
1.4 气相沉积
气相沉积是指将欲添加成分气化,与多孔钛接触并在表面形成薄膜的方法。根据气化原理可分为物理气相沉积(physicalvapor deposition,PVD)和化学气相沉积(chemical vapor deposition,CVD)。
PVD 是在真空环境下,将靶材经蒸发或溅射以原子、分子或离子状态迁移并聚集在基体表面并形成薄膜的方法,其类型主要包括真空蒸镀、溅射镀膜和离子镀膜等[31]。Escudero 等[32]利用PVD 在多孔Ti6Al4V 合金表面沉积厚度为(4.5±1.5)μm 的银涂层,与空白组相比,镀银后的支架降低了金黄色葡萄球菌在多孔样品上的粘附,抑制了材料表面72 h 内葡萄球菌生物膜的形成。此外,在28 d 内测试的银最大累积释放量低于3.5×10-6,对成骨细胞的粘附、增殖和分化未造成明显损害,表现出良好的相容性和抗菌作用。磁控溅射沉积方法则在非导电材料构件中广泛应用,例如HA等非导电材料多以射频磁控溅射(radio frequency magnetron sputtering,RF-MS)进行加工,具有成膜速度快、膜成分均匀、膜层性能稳定、涂层与基体附着强度高等优点。
CVD 是指把含有构成薄膜元素的一种或几种化合物,经气化后与基体表面发生化学反应,在基体上沉积一层金属或无机物涂层或固态膜的方法[33]。Lascano 等[34]采用粉末冶金法获得了多孔Ti-Nb-Ta-xMn 合金,利用CVD 方法将单层石墨烯(singlelayer graphene,SLG)转移到多孔钛合金表面,通过评估体外细胞行为证实石墨烯涂层促进细胞粘附和增殖,而对此可能的解释是纳米级形貌变化促进细胞内生物活性相关的蛋白质吸附的增加。此外,石墨烯材料与细胞间形成天然“屏障”,减少细胞与Mn 等金属重元素的接触。与PVD 方法相比,CVD 方法制备得到的薄膜具有更好的基体覆盖率、更好的渐进性等优势。
2 多孔钛表面新型改性方法
传统改性方法多在钛合金板材改性基础上加以改进转移到钛合金支架改性中,在形貌方面以调节表面粗糙度和生成表面多孔结构为主,在负载物质方面多添加HA 或Cu、Ag、Zn 等元素实现抗菌成骨效果。面对临床安全性与功能性要求的不断提高,依托生物提取/培养技术和涂层合成技术的持续升级,凝胶负载生物活性物质及复合涂层成为新的发展趋势。
2.1 凝胶载药/活性物质
凝胶涂层制备方法是以水凝胶等为载体,加入药物、活性元素及功能物质(引发剂、流变改性剂和增韧剂等),经过配制、涂覆/填充和固化等阶段使其固定在多孔钛表面的方法。
Bai 等[35]将泊洛沙姆407 水凝胶、PBS(pH=7.4,4 ℃)以质量比为25%∶75%的比例混合制备成载体水凝胶,将唑来膦酸盐(zoledronate,ZOL)溶液加入到制备的水凝胶溶液中,形成载药水凝胶并在4 ℃下注入支架孔中后加热至37 ℃完成制备。细胞成骨实验显示,凝胶的存在显著上调了成骨基因的表达并抑制了骨裂的形成,从而增强了骨再生并改善了骨质疏松症植入物的机械稳定性,促进了BMSCs 增殖。Core 等[36]将不同浓度的AgNO3(含1~100 mmol/L Ag)在加入壳聚糖(chitosan,Ch)凝胶中进行抗菌涂层构建。与空白组对比,含Ag组能够引起细菌细胞壁的结构变化、细菌蛋白质/DNA/ RNA 的损伤及超炎症反应等实现抗菌效果。
除了药物和金属元素之外,血小板、外泌体活性物质近年来也作为功能成分用于多孔钛的表面修饰[37]。Qiao 等[38]对血液进行离心提取富血小板血浆(platelet-rich plasma,PRP),将支架在室温下浸入PRP 中5 min,随后将其浸入20 μL 凝血酶(100 IU/mL)和20 μL 20%CaCl2(质量分数)混合液中制备支架涂层,冻干后保存使用,通过涂层释放的生长因子,包括TGF-β、IGF-1、bFGF、VEGF 和PDGF 等显著促进骨质疏松性骨缺损的骨再生和骨整合(如图3 所示)。
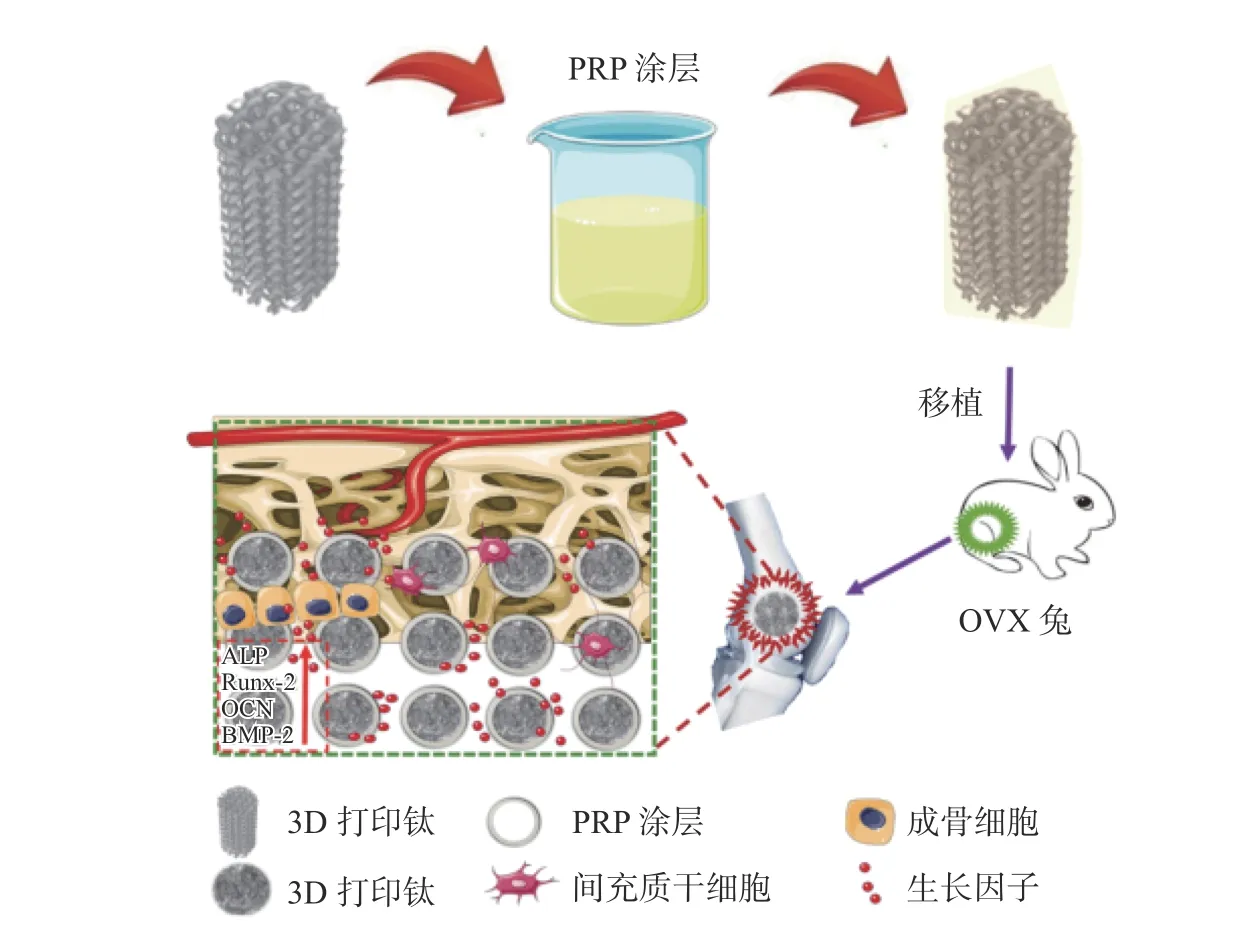
图3 多孔支架表面水凝胶负载富血小板血浆改性[38]Fig.3 Hydrogel-loaded platelet-rich plasma modification of porous scaffold surface[38]
与蚀刻、电化学等方法相比,凝胶法在不改变基体特性(如强度和韧性)的同时,兼具凝胶材料在润滑性、生物相容性、抑菌性和药物控释方面的优点。
2.2 复合方法
为实现抗菌、成骨诱导等单一功能的增强或不同功能的结合,往往需要将形貌改造与成分添加等多种改性手段进行复合以提升效果。
已知碳纳米管的规则多孔结构能够为细胞粘附提供更大的接触面积,促进细胞增殖。此外,多孔管状结构还可为药物储存提供空间。Wei 等[39]利用这一特性,通过电泳沉积在多孔钛支架表面沉积碳纳米管后,又在纳米管表面涂覆机械生长因子(mechanical growth factor,MGF),如图4 所示。使涂层具有纳米结构的拓扑结构及优良的MGF 负载特性,通过共价键延长释放性能改善多孔钛支架中的成肌细胞粘附、增殖和肌原性分化。此外,TiO2纳米管阵列还常用于加载药物和生物分子以增强生物活性。一些大分子蛋白和常见的小分子抗生素(如庆大霉素[40]和西罗莫司[41]等),被负载到纳米管阵列中用于增强成骨反应和抗菌特性。
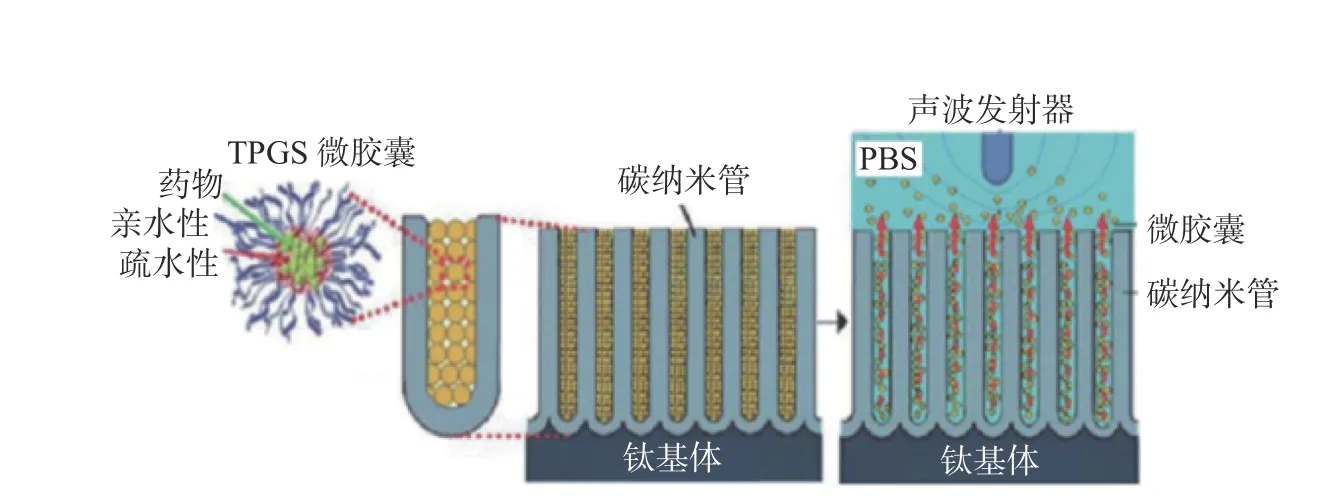
图4 碳纳米管负载生长因子用于表面改性[39]Fig.4 Carbon nanotube loaded growth factors for surface modification[39]
除将形貌改造与负载成分方法复合外,利用超声、电磁、光热等配合特制涂层进行外部刺激,从而激发改性层功能[42]以实现动态调节有望成为新的表面改性方向。Li 等[43]利用3D 打印制备多孔钛合金支架,将雷帕霉素粉末溶解到浓度为1 000 nmol/L 的低糖培养基(low-glucose dulbecco's modified eagle's medium,LG-DMEM)配制溶液中,随后将其加载到明胶海绵中并紧紧附着在超声发射器上。细胞完全粘附后,用无菌新鲜兔皮包裹到孔中用于药物递送到多孔钛合金表面。设置超声参数设置(频率30 kHz、强度45 W/cm2、时间 600 s/d)超声介导作用下的的雷帕霉素递送可以恢复下降的细胞活性(包括细胞活力、增殖、迁移和成骨),并通过上调间充质干细胞的自噬水平来抑制潜在的破骨细胞诱导能力和脂肪分化,显著改善了骨质疏松环境中假体界面的骨向内生长和骨整合。压电材料能够通过响应细胞通讯,通过振动/刺激或两者引起的变形产生表面电荷来调节细胞行为。Wu 等[44]利用水热合成法在3D 打印多孔Ti6Al4V 支架表面均匀形成BaTiO3涂层,通过超声激发涂层震动产生电刺激促进了促再生M2 极化,抑制了巨噬细胞的M1 极化,促进了绵羊颈椎切除术模型的骨再生过程(如图5 所示)。
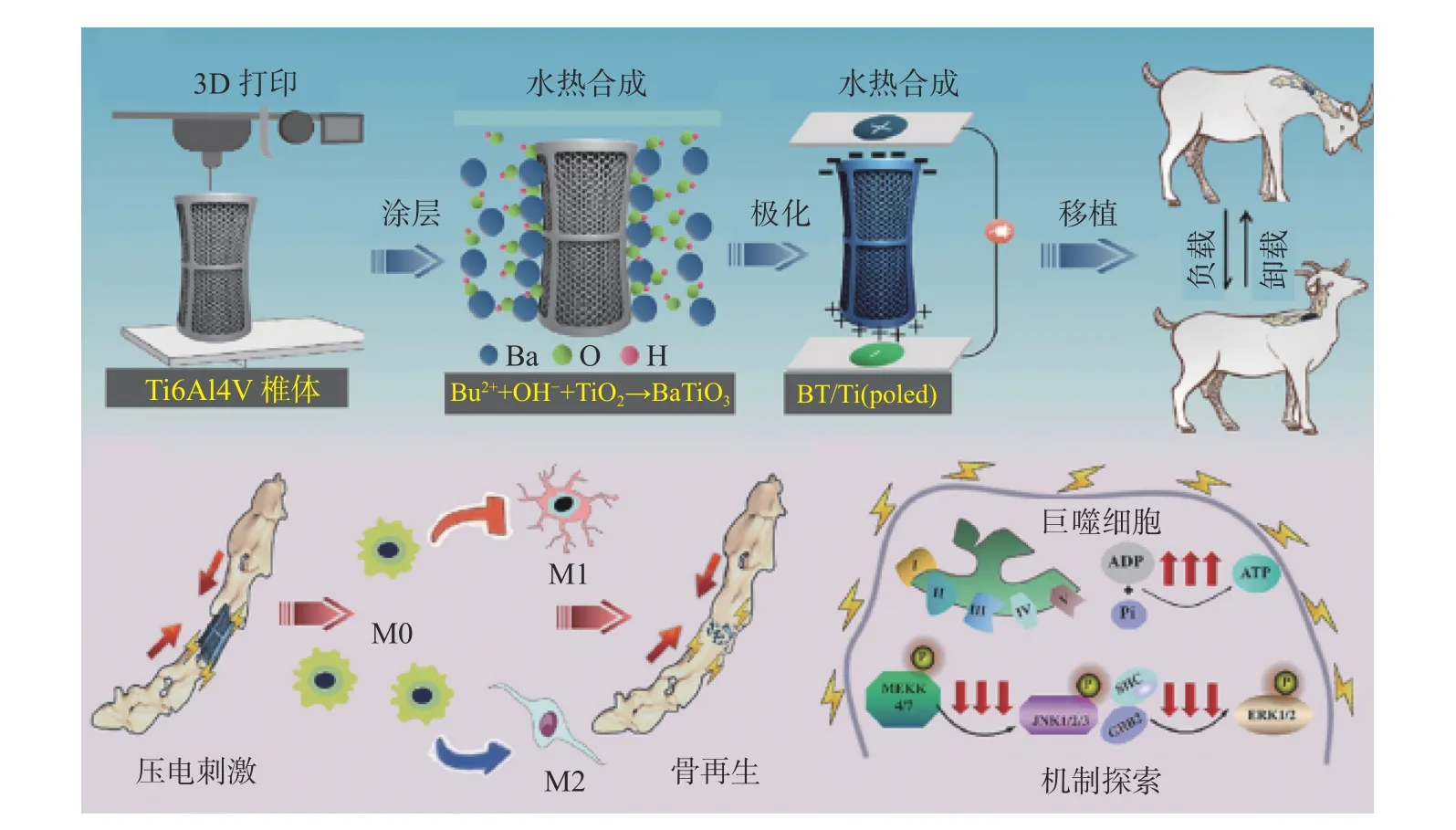
图5 涂有压电钛酸钡的多孔Ti6Al4V 支架和植入支架及促成骨机制[44]Fig.5 Porous Ti6Al4V scaffolds and implanted scaffolds coated with piezoelectric barium titanate and bone-enabling mechanisms[44]
3 结论
医用多孔钛合金植入物在骨科、口腔、心脑血管等领域发挥着重要作用,表面改性是提高多孔钛合金生物相容性、抗菌及靶向治疗等功能性的主要策略。由于多孔钛复杂的内部结构,其改性多在流体介质中进行,实现物质负载或者形貌改造以实现多孔钛表面改性的覆盖。改性工艺从早期蚀刻等物理方法逐步发展到凝胶负载血小板、外泌体等生物活性,不断向更高效、多功能和高亲和性的方向演变。
随着临床要求的不断提升,单一方法改性将难以满足组织修复中的多重需求,未来多种功能物质或改性方法结合将更多的应用在多孔钛合金表面改性中。此外,人体内抗菌、成骨及靶向治疗环境及需求处于不断动态变化之中。因此,未来多孔钛的表面改性方法将朝着满足组织/细胞时空调制的方向发展。通过光热、电磁场、超声等环境触发刺激源,在多孔钛材料中构建动态响应面,满足活细胞和组织的动态生长需求,实现更高效的生物活性植入物的构建。
