典型煤灰组分与热解产物相互作用的研究
2024-01-03王明睿陆海洋张玉辉许光文
王明睿, 贾 鑫, 陆海洋, 张玉辉, 白 昊, 许光文
(沈阳化工大学 资源化工与材料教育部重点实验室, 辽宁 沈阳 110142)
煤炭在短期内仍为我国的主要能源和资源,而石油和天然气严重依赖进口.目前,煤炭主要利用方式为直接燃烧,未实现富氢挥发分的高价值利用,且污染物治理成本较大.在所有煤制油气技术中,热解由于其低能耗、条件温和等优势,得到广泛关注.目前,国内开发的热解技术中主要是以煤灰作为热载体的分级转化技术,可以实现热、电、油、气的联产,极大地提高了煤炭的利用价值[1-3],其原理示意图参照文献[1].煤首先进入热解炉,与来自循环流化床的高温煤灰混合加热,发生热解反应,产生挥发分和半焦.挥发分经冷却、分离得到焦油和煤气,实现高价值利用.热解半焦则进入燃烧炉进行燃烧,产生的热量用于加热热载体和生产电、热.燃烧产生的部分高温灰进入热解炉为热解提供热量.
该技术中,热解是关键过程,决定了整个系统运行的稳定性及经济性.该系统中,煤灰不仅发挥了热载体作用,且不可避免地对热解反应及产物分布产生显著影响,其与传统热解特性存在明显差异.为阐明灰热载体的热解特性,已有学者针对煤灰对热解过程的影响特性开展研究.Xiong[4]等在流化床反应器上比较了石英砂和煤灰作为流化介质的热解特性,发现煤灰作为流化介质时气体和焦油收率低于石英砂作为流化介质时的,其中热解气体与煤灰相互作用是气体产率降低的重要原因.Zhang[5-6]研究表明,热解过程添加煤灰增加了气体收率,但降低了液体收率,煤灰的影响特性与其所含Fe2O3相关.杨玉坤等[7]添加淮南烟煤煤灰时,在高温时煤气产率有所增加,而半焦产率有所降低.煤灰添加能降低热解产物焦油的氮份额,但增加了热解煤气中NH3和HCN的产率,其主要原因为煤灰促进了焦油中含氮化合物向气态氮的裂解[8].Qu[9]研究了煤灰对硫迁移的影响特性,发现煤灰添加降低了气体中H2S的含量,主要原因是煤灰中的固硫物质,如Fe2O3,将H2S转化成硫化物.
尽管已有多篇文献报道了煤灰的作用特性,但目前针对煤灰对热解的影响机制尚不清楚,且各文献之间存在不一致的情况.其原因可能与煤灰组成的差异性和复杂性相关,不同煤灰的组成差异明显,其作用特性也可能不同.因此,阐明煤灰作用机制的基础是揭示其主要组分的影响特性.煤灰组分特别复杂,其主要组分包括CaSO4、Fe2O3和SiO2等.通常认为,SiO2为惰性物质,对热解的影响较小,而CaSO4、Fe2O3属于氧化剂,煤在热解过程中生成的热解气(H2、CO、CH4)和半焦是典型还原剂.因此,热解过程中,热解产物和煤灰中氧化剂可能发生氧化还原反应,显著改变热解特性.截至目前,CaSO4和Fe2O3与热解组分反应的研究缺乏,尤其煤灰典型组分与半焦反应的研究几乎处于空白,其反应特性和机理尚不清晰,导致难以阐明灰热载体的煤热解特性.
本文首先基于实验研究,考察了CaSO4和Fe2O3在模拟热解气气氛下的反应特性及其分别与半焦混合物加热过程中产物的分布特性,然后针对一些新反应、新结论采用HSC软件进行热力学验证.相关结果为阐明煤灰对热解特性的作用机制提供理论基础.
1 实验及热力学
所用的煤为小龙潭褐煤,其煤灰XRF分析见表1.
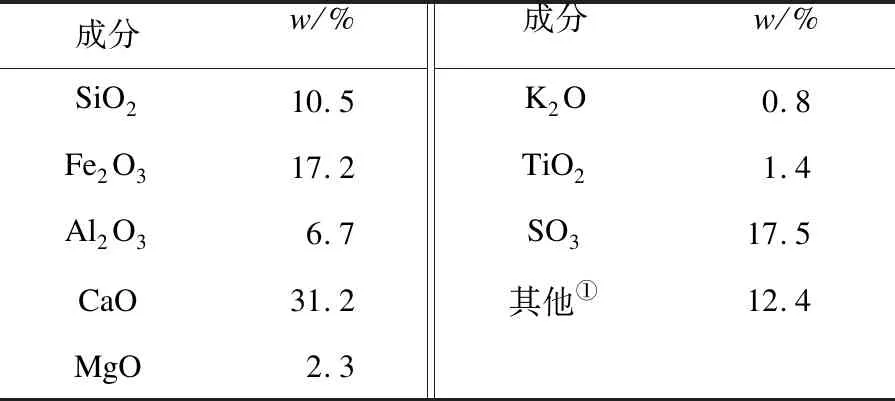
表1 小龙潭褐煤煤灰XRF分析
①差减法.
选用的典型煤灰组分为国药公司购买的分析纯的CaSO4和Fe2O3,其粒径小于0.1 mm.实验过程中CaSO4和Fe2O3用量基于小龙潭煤灰组分确定,以15 g煤灰为例,其中Fe2O3和CaSO4的质量分数分别为17.2%和29.75%,其所含的CaSO4和Fe2O3分别为4.5 g和2.5 g,即为实验过程的用量.模拟热解气组分参照小龙潭褐煤热解气的组成,即H2、CH4、CO、CO2、C2、C3的摩尔分数分别为42%、18.5%、16%、7.5%、2%、2%.半焦制备方法如下:0~0.2 mm小龙潭褐煤在红外加热炉中以2 000 ℃/min的加热速率加热到1 000 ℃,并恒温30 min.预实验证明该半焦在升温至1 000 ℃时几乎没有气体析出.半焦用量为5 g,其与CaSO4或Fe2O3的混合方式为机械搅拌.
实验装置见图1.
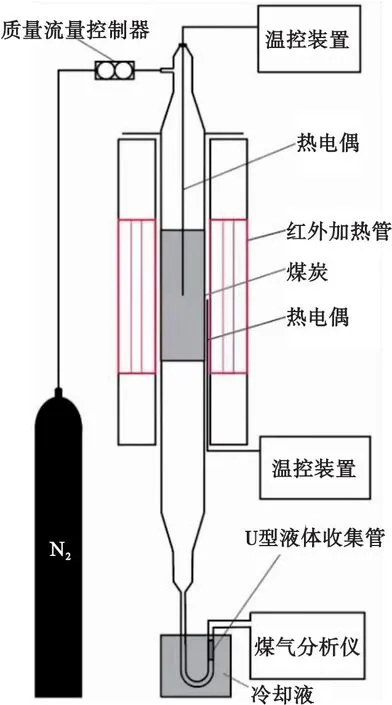
图1 红外加热实验装置
系统主要由气瓶、质量流量控制器、反应器(红外加热管、装配有热电偶的石英管)和气体冷凝系统(U型液体收集管、冷却液)组成.石英管反应器内径为60 mm,高度为500 mm,其内部布置烧结板,用于放置样品和均匀分布气体.实验开始前,将样品均匀放置在石英管烧结板上,然后按照图1连接整个反应系统.500 mL/min N2作为载气吹扫整个系统20 min,以排出系统内空气.然后,以30 ℃/min的加热速率从室温升温到1 000 ℃,并恒温10 min.反应的气体组分由煤气分析仪在线检测,分析仪型号为湖北锐意自控系统有限公司生产的Gasboard-3100P,精度:CO/CO2/CH4/CnHm为1%FS;O2/H2为2%FS.
针对实验过程推导出的一些新反应将由热力学软件进行验证,以验证其热力学是否可行.此外,热力学过程中产物变化规律将与实验之间进行相互验证.采用的热力学软件为Outotec公司开发的HSC Chemistry化学反应模拟计算软件,其能计算多相系统中的多组分平衡组成.
2 实验结果
2.1 模拟热解气与CaSO4、Fe2O3的反应
图2为CaSO4在模拟热解气气氛下气体浓度随时间(对应不同温度)的变化特性.由图2可见:低温下还原性气体浓度未发生明显变化,说明低温下还原气体几乎不与CaSO4发生反应;随着温度进一步升高,H2和CO浓度开始逐渐降低, 其摩尔分数分别由42.2%和15.8%降低到最低值22.3%和14.3%,表明此温度范围内上述两种还原气体与CaSO4发生剧烈的氧化还原反应,之后随时间逐步升高至初始浓度,表明上述反应已基本结束.已有大量文献表明[10-15],H2、CO、CH4等还原性气体可在高温下与CaSO4发生氧化还原反应,具体反应方程式如下:
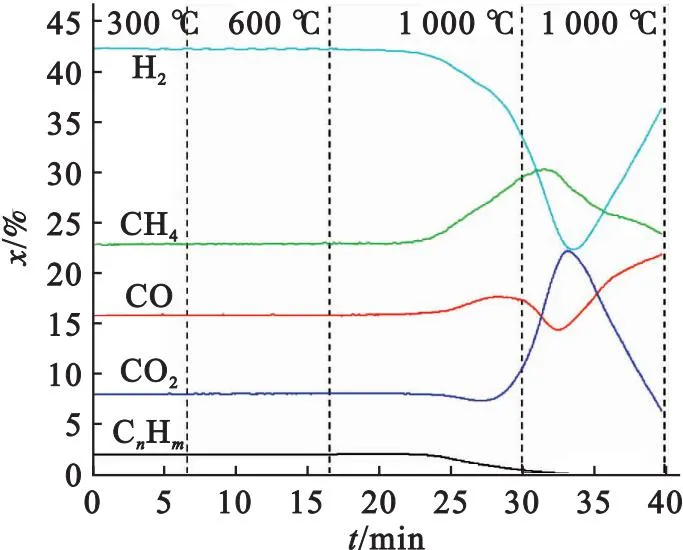
图2 热解还原气与CaSO4相互作用的气体浓度变化特性
4H2+CaSO4→CaS+4H2O,
H2+CaSO4→CaO+SO2+H2O,
4CO+CaSO4→CaS+4CO2,
CO+CaSO4→CaO+SO2+CO2,
CH4+CaSO4→CaS+CO2+2H2O,
CH4+4CaSO4→4CaO+CO2+4SO2+2H2O.
这也是图2中H2、CO浓度下降及CO2浓度上升的主要原因.值得注意的是,H2开始反应(即浓度开始下降)对应的温度(约788 ℃)明显低于CO(约1 000 ℃),且H2浓度降幅(19.9%)明显高于CO的降幅(1.5%),表明H2反应活性高于CO的,优先与CaSO4反应.CO2和CH4浓度变化规律与H2、CO相反,即它们的摩尔分数随着温度升高先逐渐增加,分别由最初的7.96%和22.9%增加到22.36%和30.2%,而后又逐渐降低.大量文献[16-18]及热力学结果均表明,CH4在高温下仍可以与CaSO4发生反应,导致其浓度下降,与本实验结果恰好相反.这主要是由于:一方面,CH4反应活性低于H2和CO,CaSO4几乎全部被H2和CO还原,使得CH4没有机会与CaSO4反应;另一方面,CaSO4将H2氧化成液态水,使得热解气体积减少,使得CH4浓度升高.CO2浓度增加及热解反应器出口冷凝管上明显的水珠均证明了H2和CO被CaSO4氧化成H2O和CO2.CnHm(C2、C3)在810 ℃时开始持续下降,其摩尔分数由最初的1.95%降低到0,可能的原因为其在高温下发生明显的裂解反应,生成积碳和氢气.高温下,积碳进一步与CO2发生气化反应生成CO[19],这也解释了为什么CO反应后浓度高于其初始浓度.
图3为模拟热解气与Fe2O3在不同反应时间(对应温度)下气体浓度的变化特性.

图3 热解还原气与Fe2O3相互作用的气体浓度变化特性
H2、CO、CH4等还原性气体可在高温下与Fe2O3发生氧化还原反应,具体反应方程式如下:
Fe2O3+3CO→2Fe+3CO2,
Fe2O3+CO→2FeO+CO2,
Fe2O3+H2→2FeO+H2O,
Fe2O3+3H2→2Fe+3H2O,
4Fe2O3+3CH4→8Fe+3CO2+6H2O,
Fe2O3+3CH4→2Fe+3CO+6H2,
2Fe2O3+3CH4→4Fe+3CO2+6H2.
与CaSO4类似,低温下还原性气体浓度未发生明显变化,随着温度进一步升高,H2的摩尔分数开始逐渐降低,分别由42.2%降低到34.6%,说明Fe2O3在此温度期间被H2大量还原[20],同时生成H2O,造成气体总体积降低,这也间接导致了CH4和CO2气体摩尔分数的增加.之后H2的摩尔分数又逐渐增加到46.0%,反应结束后H2浓度高于其初始浓度,表明高温下必然存在其它可产生H2的途径.H2与Fe2O3反应初始温度为300 ℃,远低于其与CaSO4的反应温度(约780 ℃),说明H2与Fe2O3反应比其与CaSO4反应更容易进行.实验中H2的摩尔分数降幅为7.6%,低于其与CaSO4反应的降幅(19.9%).这主要是:一方面,实验中CaSO4添加量高于Fe2O3(基于小龙潭煤灰组成);另一方面,相同量的CaSO4消耗的H2要明显高于Fe2O3,如还原1 mol CaSO4需要消耗4 mol H2,而还原1 mol Fe2O3仅需要消耗1/3 mol和1 mol H2(产物分别为Fe3O4和FeO时).CO浓度略有上升,这主要是由于H2优先与Fe2O3反应生成H2O,导致气体体积减少,进而使得CO浓度略有增加.高温下,CH4的摩尔分数也由最高值25.1%降低到15.5%.这说明此温度下烃类化合物发生裂解反应,生成积碳和氢气,这也解释了为什么高温下反应结束后的H2浓度高于其初始浓度.添加CaSO4时,CH4浓度并没有下降,这表明Fe2O3促进了CH4的裂解.与此同时,烃类热解的积碳与CO2发生气化反应,导致了CO2的摩尔分数从9.27%降低到0.84%,而CO的摩尔分数从15.1%增加到24.1%.
2.2 半焦与CaSO4、Fe2O3的反应
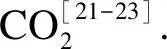
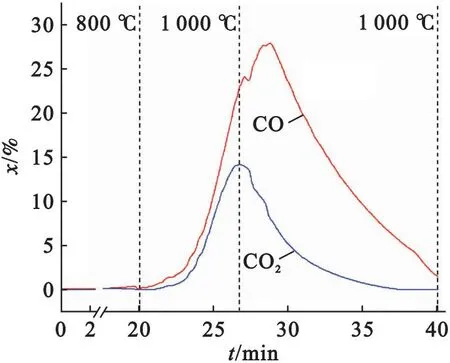
图4 半焦与CaSO4相互作用的典型气体生成特性
图5为半焦和Fe2O3混合物(简称“半焦+Fe2O3”)在加热过程中气体产物的生成特性.
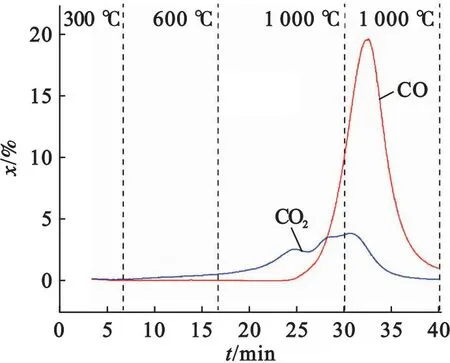
图5 半焦与Fe2O3相互作用的典型气体生成特性
由图5可以看出,在低温下几乎无气体析出,高温下开始有CO和CO2产生.“半焦+Fe2O3”在低于600 ℃下开始反应,已有少量CO2析出;而“半焦+CaSO4”初始反应温度在800 ℃以上.这表明Fe2O3的反应活性高于CaSO4的,优先与半焦反应.反应初始阶段CO2生成量略大于CO,之后随着温度升高,CO的摩尔分数迅速增加,其最高值达到了19.6%,远高于CO2的摩尔分数峰值(3.8%).这说明半焦在高温下被Fe2O3氧化成CO和CO2,且以CO为主要产物的反应起主导作用.
3 热力学验证
H2、CO等还原气体与CaSO4、Fe2O3的反应在化学链燃烧过程中已有研究,而半焦与典型煤灰组分(CaSO4、Fe2O3)的反应是基于本次实验结果推导出来的,尚需进行热力学研究,以验证其可行性和产物变化的主要规律.此外,实验结果初步确认Fe2O3氧化活性高于CaSO4,现通过热力学模拟进一步检验Fe2O3是否仍具有较高的活性.在热力学模拟过程中,所使用的参数与实际实验所使用的参数基本相同,并选取了实验中800 ℃时所采用的原料比例进行详细计算.
3.1 半焦与CaSO4、Fe2O3反应的热力学验证
按照实验过程中各物质量的比例进行HSC模拟.实验采用半焦为5 g,其碳元素的质量分数约为70%,因此其C元素为3.5 g(0.29 mol),CaSO4和Fe2O3分别为0.033 mol和0.016 mol.图6为CaSO4和半焦(C)混合物在不同温度下气相与固相平衡组分浓度的变化曲线.

图6 半焦(C)与CaSO4反应的热力学特性
由图6可知,不同温度下CaSO4含量几乎为0,表明其几乎被还原.C元素初始摩尔分数为89.8%,其在反应中过量;随着温度的升高,其摩尔分数由500 ℃时的87.1%降低到1 000 ℃时的82.3%.同时,反应新产生CaS,其摩尔分数由500 ℃时的12%单调增加到1 000 ℃时的17%,而CaO和CaCO3的生成量极少.气体产物中主要为CO和CO2,COS、S2和SO2的生成量很低.低温下气体产物以CO2为主,高温下气体产物以CO为主,当温度从500 ℃升高到1 000 ℃时,CO2的摩尔分数由90.7%降到0.85%,而CO的摩尔分数由5.7%增加到99.1%.CO和CO2在热力学的变化规律与实验结果(图4)一致.热力学结果证明了C与CaSO4反应在热力学上是可行的.
图7为Fe2O3和半焦(C)混合物在不同温度下气相与固相平衡组分浓度的变化曲线.由图7可知,热解温度范围内(500~1 000 ℃),Fe2O3几乎被反应,C元素含量随着温度升高小幅下降.Fe2O3还原产物主要为FeO和Fe,低温下产物主要为FeO,高温下产物主要为Fe.反应气相产物为CO和CO2,随着温度的升高,CO2的浓度逐渐降低,而CO的浓度逐渐增加,这与实验的规律(图5)吻合.综上,证明了Fe2O3和C的反应在热力学上是可行的.
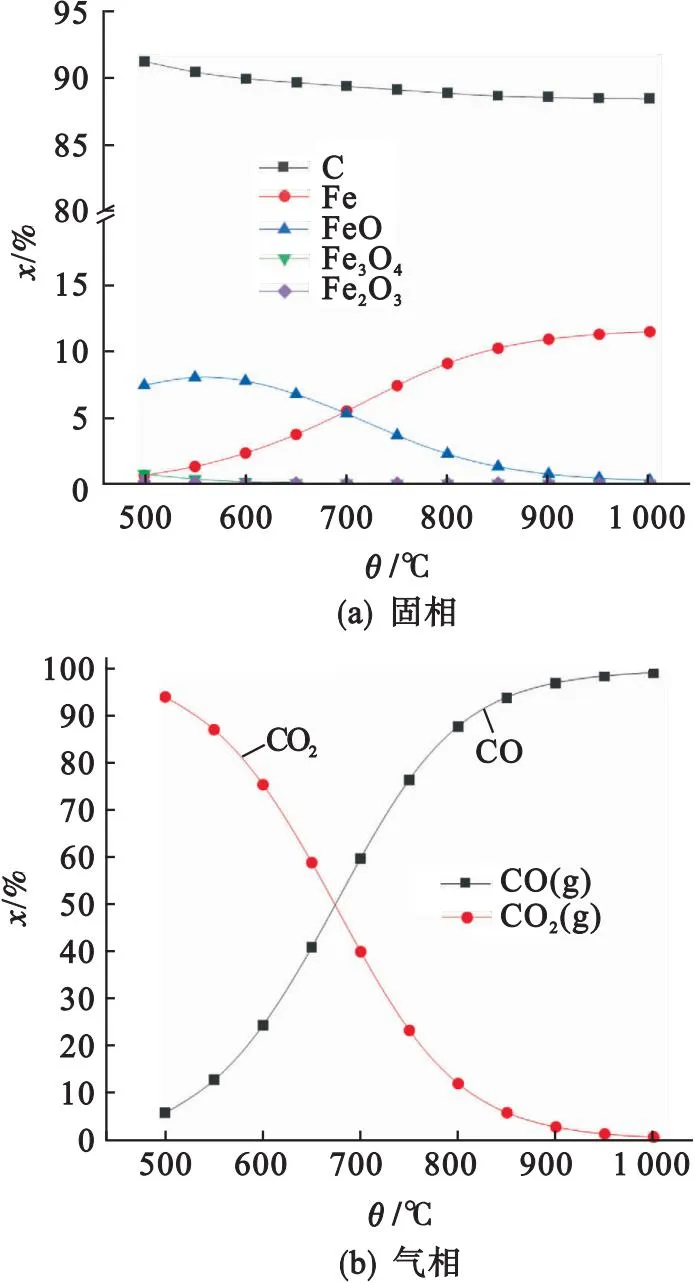
图7 半焦(C)与Fe2O3反应的热力学特性
3.2 CaSO4和Fe2O3氧化活性强弱的热力学验证
煤灰中CaSO4和Fe2O3均可与还原性气体发生反应,二者反应活性的强弱尚不清楚.实验结果初步表明Fe2O3活性高于CaSO4,但这是基于Fe2O3与热解气体、半焦的反应温度低于CaSO4反应温度得出的结论,尚需进一步理论验证.为此,首先以H2作为还原气体、C作为固体的代表,研究其分别与CaSO4和Fe2O3混合物的热力学反应.其中H2或C不足,无法将CaSO4和Fe2O3全部还原,以此判断还原物质优先与何种氧化剂进行反应.
图8为H2、Fe2O3、CaSO4(分别为1 mol)相互反应的产物随温度的变化特性.由图8可知,在500~1 000 ℃,CaSO4、CaS和CaO的摩尔分数分别在38.5%~46.2%、3.3%~6.4%和2.6%~ 9.7%之间,表明CaSO4反应分解比例较低.与之相反,产物中Fe2O3、Fe3O4和FeO的摩尔分数分别在5.1%~6.9%、24.7%~29.6%和5.7%~16.4%之间,说明绝大部分Fe2O3被H2还原.综上,Fe2O3与H2还原活性高于CaSO4.
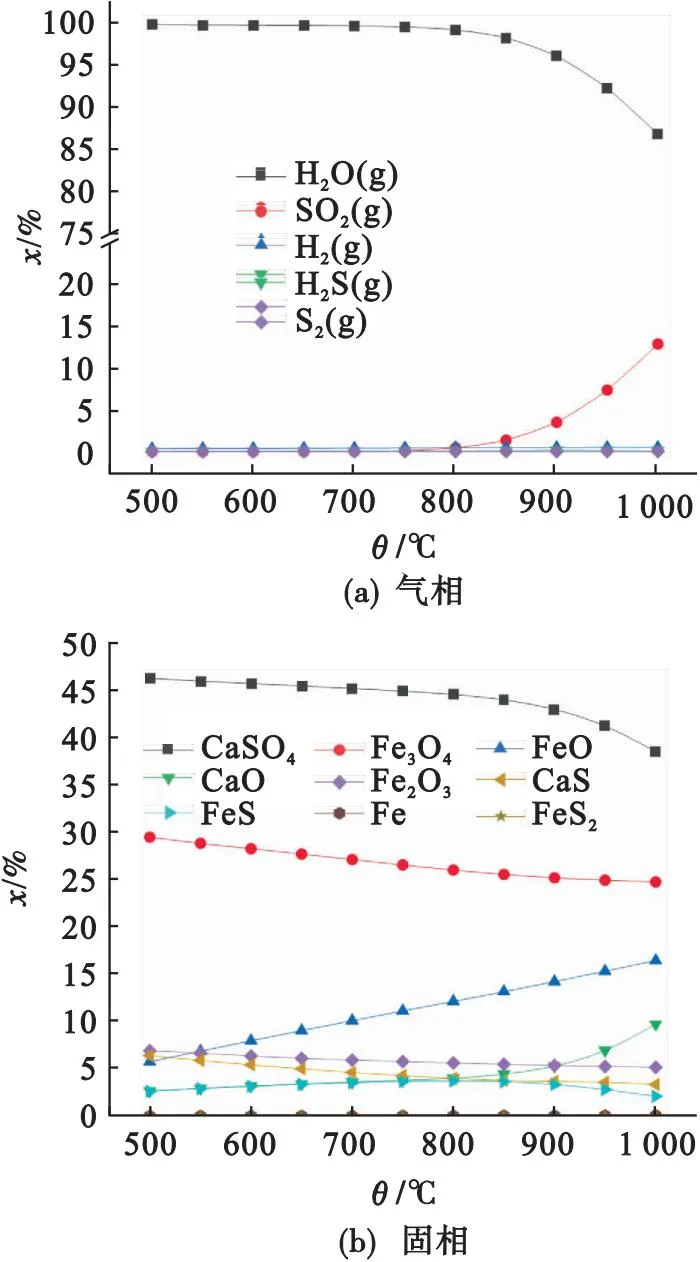
图8 H2、Fe2O3和CaSO4反应的热力学特性
图9为0.5 mol C、1 mol Fe2O3、1 mol CaSO4相互反应的产物随温度的变化特性.由图9可知,C的摩尔分数几乎为零,说明该反应中还原剂不足,氧化剂过量.在500~1 000 ℃,CaSO4、CaS和CaO的摩尔分数分别在40.0%~44.4%、0~3.2%和0~7.0%之间,表明CaSO4反应分解比例较低.与之相反,产物中Fe2O3、Fe3O4和FeO的摩尔分数分别在5.1%~10.1%、24.1%~25.3%和3.3%~16.3%之间,说明绝大部分Fe2O3被C还原.综上,Fe2O3与C还原活性同样高于CaSO4.
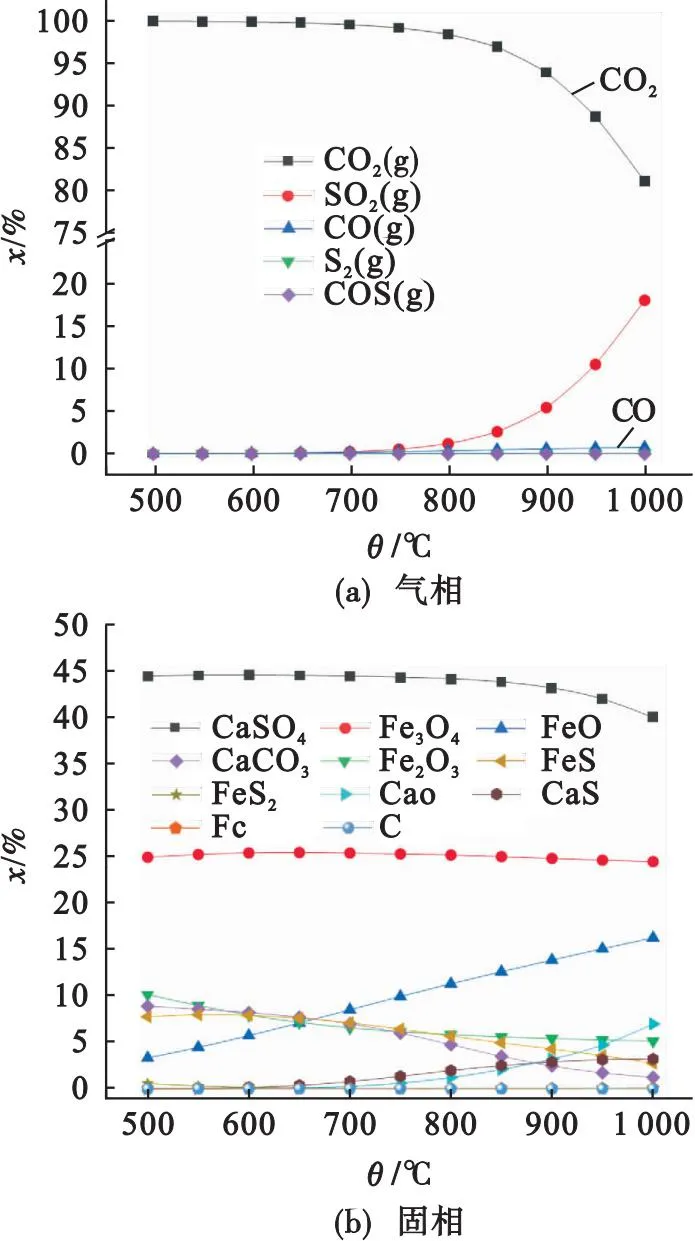
图9 C、Fe2O3和CaSO4反应的热力学特性
因此,在H2和C的热力学反应方面,Fe2O3活性均高于CaSO4.
4 结 论
为阐明煤灰对热解的作用机制,开展了典型煤灰组分(CaSO4、Fe2O3)与热解产物相互作用的研究,主要结论如下:
(1) 热解温度范围内热解还原气(H2、CO)与CaSO4或Fe2O3发生氧化还原反应,降低了H2浓度.
(2) 实验和热力学结果均表明,半焦在高温下被CaSO4或Fe2O3大量氧化成CO和CO2,且低温下气体产物以CO2为主,高温下气体产物以CO为主.
(3) Fe2O3与热解还原气和半焦反应温度均明显低于CaSO4,热力学结果也验证了Fe2O3具有较高的氧化活性,优先与还原性气体或固体还原剂(C)反应.
