微管不稳定蛋白-1在肛门鳞状上皮内瘤变分级诊断中的应用价值
2024-01-03杨春石娜王康王春
杨春, 石娜, 王康, 王春
1.东南大学医学院附属南京同仁医院消化内科,江苏南京 211102;2.南京市中医院病理科,江苏南京 210006;3.东南大学医学院附属南京同仁医院普外科,江苏南京 211102
肛门鳞状上皮内瘤变(anal intraepithelial neoplasia,AIN)是肛门鳞状细胞癌的癌前病变。根据疾病的分级,AIN 1级为低级别鳞状上皮内瘤变,AIN 2级和AIN 3级为高级别鳞状上皮内瘤变,因为高级别鳞状上皮内瘤变存在进展为浸润癌的较大风险,所以早期筛查AIN并判断分级对指导AIN治疗具有重要意义[1-2]。与宫颈上皮内瘤变具有成熟的筛查系统不同,目前AIN尚缺乏统一的筛查和分级诊断体系,因此,发现AIN相关的分子标志物有助于AIN的诊断和分级。微管不稳定蛋白-1(stathmin-1,STMN1)在有丝分裂过程中发挥重要作用,通过阻止微管的组装和促进微管的拆卸来促进细胞运动和迁移[3]。有研究显示,STMN1高表达与乳腺癌、卵巢癌、结直肠癌等恶性肿瘤的发生发展密切相关,也参与宫颈上皮内瘤变的发生发展[4-5],但STMN1在AIN中的表达变化及意义尚不清楚。因此,本研究对STMN1在不同级别AIN中的表达变化及其对分级诊断的应用价值展开探索。现报道如下。
1 资料和方法
1.1 一般资料
选择2017年1月1日—2021年10月1日南京市中医院经病理确诊的AIN标本33例为AIN组,病理科保存的肛门移行区正常黏膜标本10例为对照组。两组一般资料比较差异无显著性(P>0.05;表1)。纳入标准:①参照《肛门上皮内瘤变诊治中国专家共识》[6],经病理诊断为AIN;②未接受过肿瘤相关治疗;③患者或家属知情同意,签署知情同意书。排除标准:①合并心肝肾等重要脏器功能不全;②合并代谢性疾病、恶性肿瘤;③临床资料不全。

表1 不同p16、Ki-67表达AIN组织STMN1 mRNA表达水平和阳性表达率的比较
1.2 AIN分级评估[6]
AIN镜下病理表现为细胞核异型性,包括核增大、染色质增粗、核膜不规则,以及基底层以上核分裂像的出现。AIN 1级:未成熟细胞数量局限在上皮层厚度下1/3;AIN2级:未成熟细胞增殖累及上皮层厚度1/3~2/3;AIN3级:未成熟细胞累及上皮层厚度上1/3。AIN 1级为低级别鳞状上皮内瘤变,AIN 2级和3级为高级别鳞状上皮内瘤变。
1.3 免疫组化检测STMN1、p16、Ki-67阳性表达
各组组织经4%多聚甲醛固定,石蜡包埋后4 μm切片,采用EnVision二步法进行免疫组化染色。所用一抗Stathmin-1、p16、Ki67及二抗均购自福州迈新生物技术有限公司。Stathmin-1着色于细胞质,仅在上皮基底层染色时为阴性,在上皮基底和中间细胞层呈现弥漫染色时为阳性。p16着色于核及胞质,当组织呈空白或斑片状染色时为阴性,当鳞状上皮基底和中间细胞层呈现弥漫染色,伴或不伴浅表细胞层染色时为阳性。Ki-67着色于细胞核,基底层散在染色为阴性;上皮下1/3、下2/3或超过2/3染色为阳性。
1.4 荧光定量PCR检测STMN1 mRNA表达
采用RNA提取试剂盒提取组织样本RNA,将RNA反转录为cDNA,而后配置荧光定量PCR检测体系如下:cDNA 1 μL、反应混合液10 μL、上下游引物溶液各0.6 μL,去离子水补足至20 μL。STMN1上游引物5′-AGCGACGTTGATGACGAT-3′,下游引物5′-ATGCTAGCTAGCTAGCTG-3′。β-actin上游引物5′-GCTAGCTGAAGCTAGCGA-3′,下游引物5′-GCTAGGCTAGTTCGATGCA-3′。荧光定量PCR反应程序如下:95 ℃ 10 min,95 ℃ 5 s,60 ℃ 34 s,重复40个循环。反应完成后得到循环曲线及循环阈值(Ct),以β-actin为内参,测定STMN1 mRNA表达水平。
1.5 统计学处理
2 结 果
2.1 AIN组和对照组STMN1表达的比较
对照组STMN1在上皮基底层阳性表达,AIN组STMN1在上皮基底和中间细胞层呈现弥漫染色(图1A和B)。AIN组的STMN1 mRNA表达水平和阳性表达率均高于对照组(P<0.05;图1C和D)。
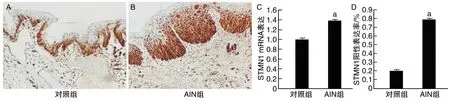
图1 AIN组和对照组STMN1 mRNA表达水平和阳性表达率的比较A和B为STMN1免疫组化染色(200×);C为STMN1 mRNA表达水平;D为STMN1阳性表达率。a为P<0.05,与对照组比较。
2.2 不同p16、Ki-67表达AIN组织STMN1的比较
AIN组p16和Ki-67阳性表达AIN组织中STMN1 mRNA表达水平和阳性表达率均高于阴性表达组织(P<0.05;表1)。
2.3 不同级别AIN组织STMN1的比较
高级别AIN组织STMN1 mRNA表达水平和阳性表达率高于低级别AIN组织(P<0.05;表2)。
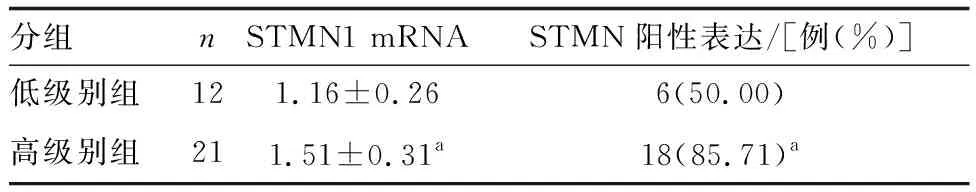
表2 不同级别AIN组织STMN1 mRNA表达水平和阳性表达率的比较
2.4 STMN1表达水平对AIN及分级的ROC曲线分析
STMN1 mRNA表达水平对AIN及高级别AIN均具有诊断价值(P<0.05;图2和表3)。
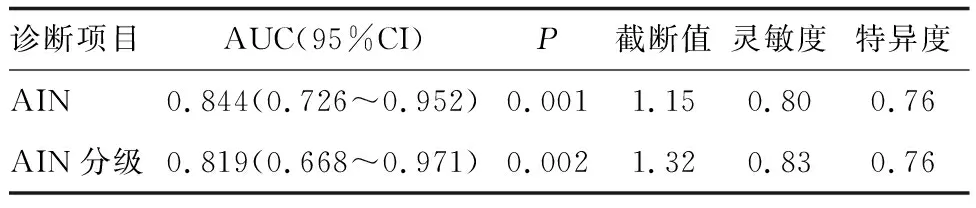
表3 STMN1 mRNA表达水平诊断AIN及分级的效能分析

图2 STMN1 mRNA表达水平诊断AIN及分级的ROC曲线
3 讨 论
近些年,肛门癌在全球范围内的发病率呈增加趋势,但该疾病的早期症状不典型,确诊时多已为晚期,生存率低、预后差[7-8]。AIN是肛门癌的癌前病变,高级别AIN具有进展为肛门癌的较高风险,筛查AIN特别是高级别AIN对肛门癌的早发现、早治疗具有重要意义。
本研究以STMN1作为分子标志物用于AIN诊断及分级,旨在发现AIN的筛查手段和标志物。微管是构成细胞骨架的成分之一,在维持细胞结构、生长、分裂等生命活动中均发挥重要的作用。STMN1通过调节微管系统的动力学平衡而发挥作用,研究资料显示,多种癌组织中STMN1表达增加[3-5],STMN1对癌细胞增殖、迁移、侵袭均具有促进作用[9-10]。以上结果提示STMN1具有促癌生物学活性。本研究中,肛门移行区正常黏膜组织的STMN1局限于上皮基底层,AIN的STMN1突破基底层并出现在中间细胞层,提示AIN中存在STMN1的异常表达。
目前关于STMN1阳性表达的评价标准尚不统一,有研究将染色超过上皮厚度1/3评定为阳性,也有研究将染色超出基底层评定为阳性,不同的定性评价标准直接影响评价结果的灵敏度和特异度[11-12]。本研究以染色超出基底层为评定STMN1阳性表达的标准,AIN组织中STMN1的阳性表达率均高于肛门移行区正常黏膜组织,提示STMN1高表达参与AIN的发生。为克服免疫组化染色不同阳性评价标准对评价结果的影响,本研究通过荧光定量PCR对组织中STMN1的表达进行定量分析,结果显示:AIN组织中STMN1 mRNA表达水平高于肛门移行区正常黏膜组织,STMN1 mRNA表达水平对AIN具有诊断价值。以上研究结果不仅进一步验证了STMN1高表达参与AIN的发生,还提示局部病灶中STMN1 mRNA表达可作为诊断AIN的分子标志物。
AIN分为1~3级,其中AIN 2级和3级为高级别鳞状上皮内瘤变,进展为肛门癌的风险高,因此准确诊断高级别AIN具有重要的临床意义。本研究发现,高级别AIN组织中STMN1 mRNA表达水平和阳性表达率均高于低级别AIN,提示STMN1高表达可能与AIN由低级别上皮内瘤变向高级别上皮内瘤变进展相关。研究资料显示,p16和Ki-67是反映上皮内瘤变的免疫组化标志物,AIN组织及宫颈上皮内瘤变组织中,p16和Ki-67阳性表达与病变进展、癌变风险增加相关,其机制可能是高表达的p16和Ki-67加速细胞分裂、促进细胞增殖和侵袭[13-15]。本研究分析AIN中STMN1与p16、Ki-67的关系发现,p16和Ki-67阳性的AIN组织中STMN1 mRNA表达高于p16和Ki-67阴性的AIN组织,表明AIN中STMN1 mRNA表达增加与标志物p16、Ki-67阳性表达相关,进而从分子层面揭示STMN1高表达可能促进AIN的进展。最后通过ROC曲线分析证实,STMN1 mRNA表达水平对AIN和高级别AIN具有诊断价值。
综上所述,STNM1高表达参与AIN的发生发展,对AIN发病及分级具有诊断价值。
