SARS-CoV-2核衣壳蛋白的生物信息学分析、纯化及多克隆抗体制备
2024-01-03王巧陈芝喜
王巧, 陈芝喜
南华大学衡阳医学院附属第一医院 1.超声影像科,2.输血科,湖南衡阳 421001
冠状病毒是一类有包膜,基因组较大的正链RNA病毒,能够感染果子狸、蝙蝠、蛇和老鼠等多种动物以及人类,能够通过动物传染给人类,导致爆发性流行[1-2]。2019年底由新型冠状病毒(severe acute respiratory syndrome coronavirus 2,SARS-CoV-2)引发的新型冠状病毒肺炎(corona virus disease 2019,COVID-19)疫情席卷全球[3]。
SARS-CoV-2含有核衣壳(nucleocapsid,N)蛋白、包膜(envelop,E)蛋白、刺突(spike,S)蛋白和膜(membrane,M)蛋白4个结构蛋白[4]。N蛋白在SARS-CoV-2感染早期大量表达,诱导患者产生免疫应答,参与SARS-CoV-2的入侵、复制以及干预宿主免疫系统的攻击[5-6]。虽然已有研究报道了N蛋白的二级结构、三级结构和磷酸化位点等性质,但是其他的生物学特性未见报道[7]。本文使用生物信息学软件分析SARS-CoV-2 N蛋白的固有无序结构域及其结合序列位点等生物学特性,纯化得到全长N蛋白并测定其免疫学活性,为新冠病毒的疫苗研发和快速诊断提供基础。
1 材料和方法
1.1 材料
大肠杆菌BL21(DE3)由南华大学病原生物学研究所保存;编码全长N蛋白的重组质粒pET-28a(+)-SARS-CoV-2-N由上海捷瑞生物工程有限公司合成;镍2+(Ni2+)亲和层析试剂盒购自美国通用电气公司;BCA蛋白质定量试剂盒、弗氏佐剂购自美国西格玛奥德里奇贸易有限公司;BALB/c小鼠购自湖南斯莱克景达实验动物有限公司;所有生化试剂都为分析纯,购自国药集团。
1.2 N蛋白的生物信息学分析
从NCBI数据库获得7种能够感染人冠状病毒的N蛋白氨基酸序列即SARS-CoV-2(GenBank:MN908947.3)、HCoV-229E(GenBank:KU291448.1)、HCoV-OC43(GenBank:KU131570.1)、HCoV-NL63(GenBank:KY862074.1)、HCoV-HKU1(GenBank:MH940245.1)、SARS-CoV(GenBank:NC_004718.3)和MERS-CoV(GenBank:MH734115.1)。使用Clustal Omega进行序列比对。使用SOPMA软件预测SARS-CoV-2 N蛋白的二级结构。使用Pondr和IUPred软件预测SARS-CoV-2 N蛋白的固有无序结构域(intrinsically disordered protein,IDP)。使用MoRFchib软件预测SARS-CoV-2 N蛋白的分子识别特征序列。使用IEDB网站分析SARS-CoV-2 N蛋白的B细胞表位。
1.3 N蛋白的表达与纯化
将重组质粒pET-28a(+)-SARS-CoV-2-N转化到大肠杆菌BL21(DE3),挑取阳性单克隆至卡那霉素抗性的LB液体培养基中增菌培养,待细菌在600 nm波长处光密度(optical density,OD)值增加到0.6时,加入终浓度0.1 mmol/L IPTG于28 ℃、200 r/min条件下继续培养4 h以诱导N蛋白表达。收集细菌置于冰上超声破碎后,12 000 r/min离心20 min,将所获得的上清用Ni2+亲和层析法纯化N蛋白,SDS-PAGE观察纯化效果,利用BCA法测定其水平。
1.4 N蛋白免疫小鼠及多克隆抗体制备
将18只8周龄雌性BALB/c小鼠随机分为PBS组、佐剂组和N蛋白组,每组6只。PBS组和佐剂组分别注射PBS溶液和相应的佐剂。N蛋白组初次免疫时将完全弗氏佐剂与N蛋白1∶1混匀,然后取100 μg N蛋白皮下注射。在第3周时将完全弗氏佐剂换成不完全佐剂,其他步骤与第1次免疫相同。第6周时按照第2次免疫方法进行第3次免疫。最后一次免疫完2周后处死小鼠,分离抗血清和脾细胞。
1.5 血清抗体滴度检测
采用ELISA法检测抗血清中抗N蛋白抗体的含量。将150 ng N蛋白加至96孔板中,4 ℃包被过夜,加入封闭液,室温封闭2 h,微孔板中加入200 μL不同稀释倍数的抗血清,并设立阳性对照和阴性对照,37 ℃孵育2 h;经PBS洗涤后,每孔加入100 μL HRP标记的羊抗鼠IgG(1∶1 000稀释),37 ℃继续孵育2 h,PBS洗涤后加入显色剂,酶标仪上测定其OD450值,并计算待测孔中的P/N值。P/N=(待测孔OD450-空白孔OD450)/(阳性对照孔OD450-空白孔OD450),当P/N≥2.1时判定为阳性,产生阳性结果的最大稀释倍数即为抗体滴度。
1.6 淋巴细胞增殖测定
取100 μL 1×106个/mL脾细胞悬液加入96孔板中,加30 μg N蛋白刺激细胞增殖,同时设置PBS为阴性对照组和加入40 μg刀豆球蛋白A(ConA)为阳性对照组,每组设置5个重复孔。将96孔板放入到37 ℃、5% CO2培养箱中培养48~72 h,然后加入10 μL MTT试剂,继续培养4 h,测定OD450值,计算脾细胞增殖的刺激指数(simulate index,SI),判断淋巴细胞增殖情况。
1.7 统计学分析
2 结 果
2.1 N蛋白的序列比对
Clustal Omega软件分析结果显示,SARS-CoV-2与SARS-CoV的N蛋白的同源性高于97%,但与HCoV-229E和HCoV-NL63的N蛋白的同源性较低(图1)。
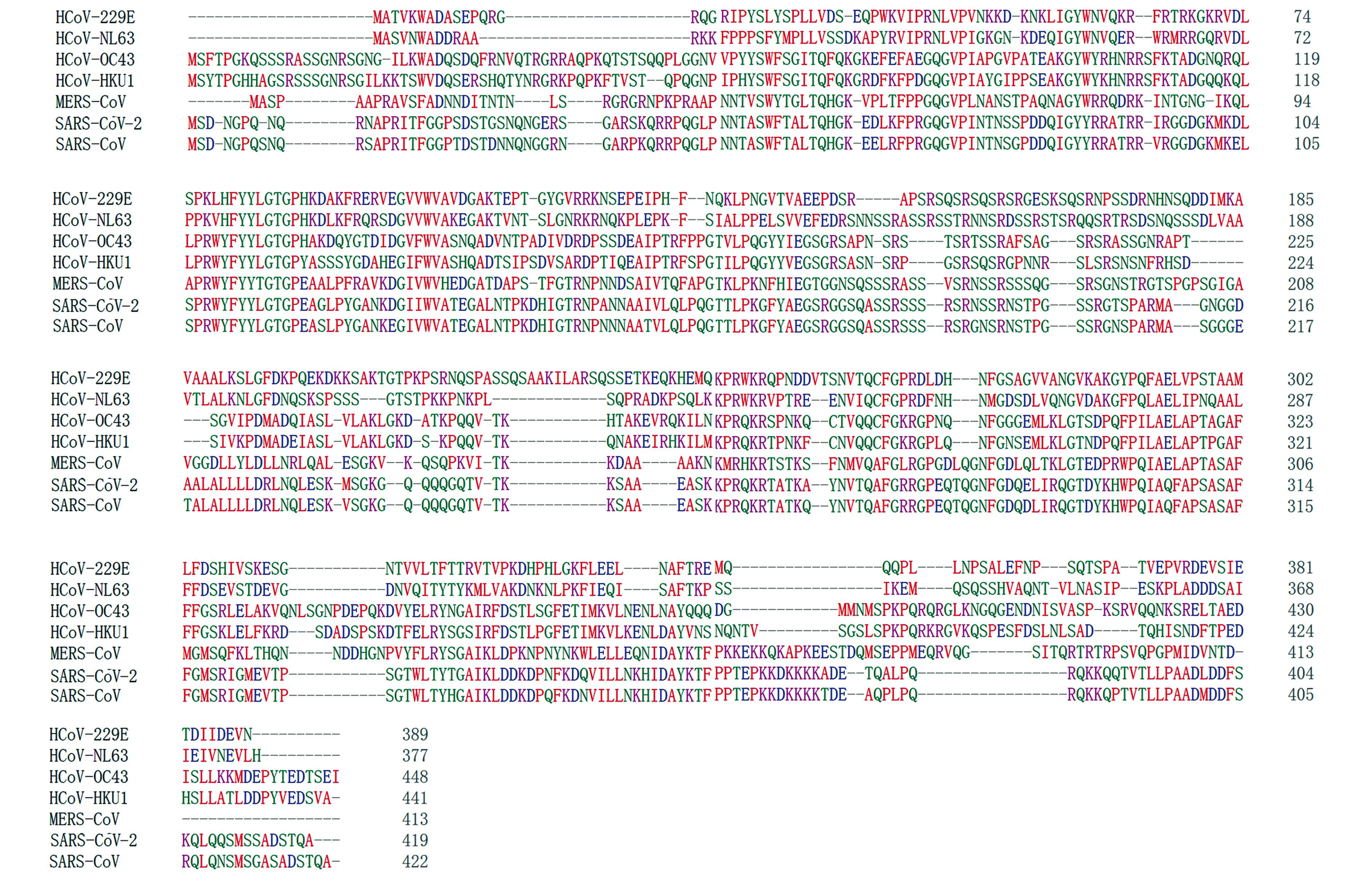
图1 不同冠状病毒N蛋白的序列比对
2.2 SARS-CoV-2 N蛋白的二级结构和固有无序结构预测
SARS-CoV-2 N蛋白二级结构中含有无规卷曲(C)、α螺旋(h)、β折叠(e)和β转角(t),分别占55.13%、21.24%、16.71%和6.92%,说明该蛋白的主要二级结构元件为无规卷曲和α螺旋。SARS-CoV-2 N蛋白在0~45、181~208位氨基酸区域属于IDP(得分大于0.5的结构域部分为IDP),该预测结果与其自身二级结构中含有大量无规卷曲相符合(图2)。
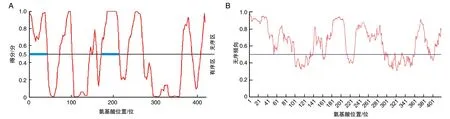
图2 SARS-CoV-2 N蛋白固有无序结构A为Pondr软件;B为IUPred软件。蓝色线条为固有无序结构。
2.3 SARS-CoV-2 N蛋白的分子识别特征序列
SARS-CoV-2 N蛋白具有4个分子识别特征序列,分别在1~20位、82~98位、102~118位和403~409位氨基酸(图3)。

图3 SARS-CoV-2 N蛋白的分子识别特征序列蓝色区域为分子识别特征序列。
2.4 SARS-CoV-2 N蛋白的B细胞表位序列
N蛋白具有较强的免疫原性。当阈值设为0.5时,SARS-CoV-2 N蛋白含有11个线性B细胞表位,具体线性B细胞表位的氨基酸序列见表1。

表1 SARS-CoV-2 N蛋白的B细胞表位序列
2.5 SARS-CoV-2 N蛋白的纯化
重组质粒pET-28a(+)-SARS-CoV-2-N中目的基因长度约为1 260 bp,与SARS-CoV-2 N蛋白的基因大小相符合(图4A)。将质粒转入大肠杆菌表达菌,诱导重组菌表达N蛋白,得到蛋白相对分子质量为51.5 kDa,与理论相对分子质量相符合。Ni2+亲和层析纯化得到纯度较高的N蛋白(图4B)。
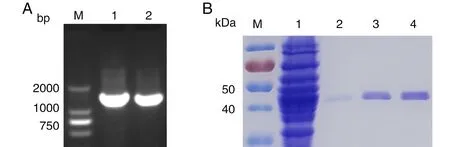
图4 重组质粒pET-28a(+)-SARS-CoV-2-N的PCR验证(A)和SARS-CoV-2 N蛋白的表达与纯化(B)
2.6 SARS-CoV-2 N蛋白多克隆抗体的制备
ELISA结果显示,N蛋白组血清中特异IgG抗体滴度大于PBS组和佐剂组(P<0.05;图5)。
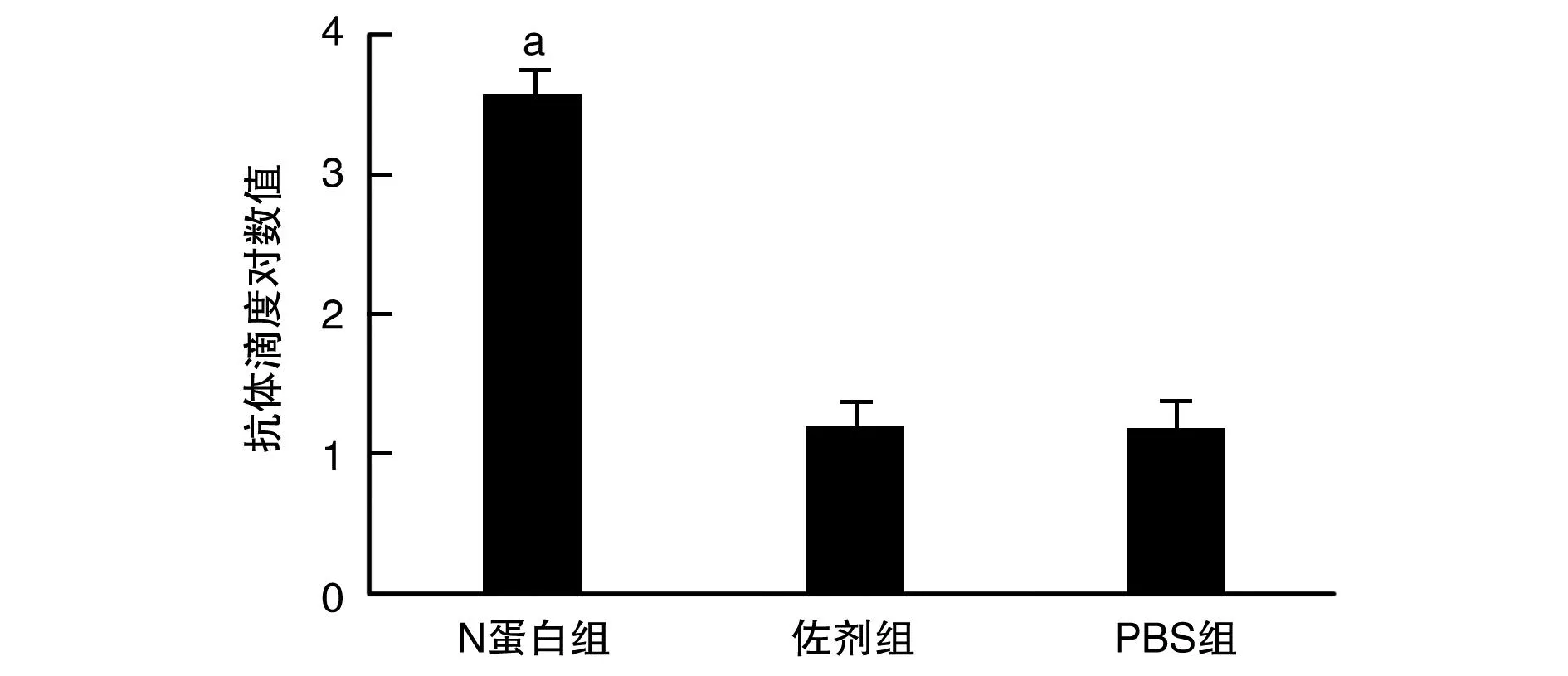
图5 血清中N抗体滴度a为P<0.05,与佐剂组和PBS组比较。
2.7 淋巴细胞增殖
N蛋白刺激小鼠脾细胞SI(1.92±0.21)明显高于PBS组[(1.19±0.25),P<0.05],但与阳性对照组(2.12±0.29)比较,差异无统计学意义。
3 讨 论
研究表明,SARS-CoV、HCoV-OC43和HCoV-229E等多种冠状病毒具有极强的传染性,容易感染老年人、新生儿以及免疫功能低下的人群[8]。SARS-CoV-2现已与人类长期共存,主要引起呼吸道感染,严重者导致器官衰竭、甚至死亡。迄今全球已有2亿多确诊患者,超过570万死亡人数[8-10]。
SARS-CoV-2能编码E、M、S和N 4个结构蛋白。E蛋白结构尚不清楚,免疫原性较弱,但能够诱导炎症因子分泌,是SARS-CoV-2的毒力因子[11]。M蛋白能够诱导患者发生适应性免疫应答[11]。S蛋白识别人上皮细胞表面的血管紧张素转换酶2,介导SARS-CoV-2对宿主细胞的黏附,是疫苗开发的重要靶点[11]。N蛋白是冠状病毒中最为丰富的蛋白之一,目前SARS-CoV-2已经有Alpha、Beta、Delta和Omicron等多种突变株,但是这些突变株的N蛋白相对保守,点突变相对较少,故临床上采用N蛋白用于冠状病毒血清学诊断[12-13]。COVID-19患者体内抗N蛋白抗体滴度较高,故N蛋白能够用于恢复期患者的诊断[12-14]。本文结果显示,SARS-CoV-2 N蛋白具有良好免疫原性,能够诱导小鼠分泌高滴度特异性抗体,与文献[15]报道结果相一致,同时N蛋白能够刺激小鼠淋巴细胞增殖,这说明N蛋白能够诱导宿主发生免疫应答。
生物信息学是将计算机技术和生命科学相结合而形成的一门新科学。利用生物信息能够预测和分析病毒蛋白的结构和功能[9-10,16]。传统观点认为蛋白质只有折叠形成确定的三级结构后才能发挥功能,但近年来发现一些蛋白质没有三级结构,但是依旧具有重要的生物学功能,现在将这类蛋白质称为IDP。病毒蛋白中存在大量IDP,且是抗病毒的药物作用靶点[17]。SARS-CoV-2M蛋白具有2个IDP,这两个结构域可能参与细胞信号转导和转录调节等功能[18]。本研究预测得到SARS-CoV-2 N蛋白含有大量IDP。用MoRFchib软件分析结果显示,SARS-CoV-2 N蛋白有4个区域可能是分子识别特征序列,能够参与识别和结合靶分子。SARS-CoV-2 N蛋白与其他冠状病毒的N蛋白一样,能够通过IDP与核酸和靶蛋白发生相互作用[17-19]。
综上所述,本文利用生物信息学方法分析了SARS-CoV-2 N蛋白的二级结构、IDP结构域、分子识别特征序列、B细胞表位等生物学性质,纯化得到全长N蛋白并测定其免疫学特性,为研究SARS-CoV-2致病机制以及诊断试剂提供实验基础。
