植物根部热形态建成的研究进展
2024-01-02朱自强
刘 玮 朱自强
(南京师范大学生命科学学院,南京 210023)
作为固着生长的生物,植物的生长发育模式极大地受外界环境影响。为了应对各种生物胁迫和非生物胁迫,植物体内进化出了一系列复杂的调控机制。温度是限制植物生长发育的重要环境因子,高温对植物种子萌发、细胞伸长、开花时间和果实发育等生长发育各阶段都有影响[1]。植物会通过热形态建成响应热胁迫,以适应高温环境,例如下胚轴伸长、叶柄偏下性生长、气孔密度降低和叶片厚度减小等[2],这些形态变化能够帮助植物远离吸热土壤,更好地接触冷却气流,从而最大限度地提高散热能力[3]。除了地上部的这些变化之外,高温也会促进植物根伸长,以获取更多水分和养分。由于根是植物吸收水分和无机盐的重要器官,因此高温下根的生长发育状态也直接决定了农作物的产量[4]。据估计,全球平均气温每升高1 ℃,会造成小麦减产6.0%,水稻减产3.2%,玉米减产7.4%,大豆减产3.1%[5]。2018 年,联合国政府间气候变化专门委员会(IPCC)报告预计2030~2052 年全球气温会比工业化之前水平升高1.5 ℃[6]。可见,全球气候变暖将对未来粮食安全带来严重危害。因此,深入研究植物热形态建成机制,解析植物热形态建成调控网络对培育耐热作物品种和未来粮食安全最大化意义重大。
对于模式植物拟南芥(Arabidopsis thaliana)来说,当没有热适应突然暴露于高于40 ℃的高温时,拟南芥会因为无法忍受高温而死亡[7]。而如果事先暴露于温度低于37 ℃的高温时,植物可以获得耐热性以增加存活的机会[1,8-9]。当暴露于温和高温(27~32 ℃)下,植物会产生一系列形态变化,即热形态建成[2]。植物对高温的响应是具有组织特异性的[10],然而目前对植物热形态建成的理解和研究主要基于地上组织(如下胚轴和叶柄伸长、开花时间),对植物根部热形态建成调控机制的认识仍较少。本文首先总结了近年来植物地上部分热形态建成的主要研究成果,并着重聚焦植物根部热形态建成的调控机制进行论述,最后对植物根部热形态建成领域作出展望。
1 植物地上部热形态建成研究进展
由于表型易于观察,高温诱导的拟南芥下胚轴伸长得到了较为广泛地研究。1998 年,研究者发现温和高温处理能促进下胚轴伸长,并且这一过程依赖于植物激素生长素[11]。随后陆续发现参与该过程的多个植物高温感受器,包括植物红光/远红光受体光敏色素蛋白phyB(phytochrome B),转录因子PIF7(PHYTOCHROME INTERACTING FACTOR 7)和生物钟晚间复合体(Evening Complex, EC)关键组分ELF3(EARLY FLOWERING 3)[12]。在黑暗条件下,phyB 以无活性的红光吸收形式(Pr形式)存在;当吸收红光后,变为有活性的远红光吸收形式(Pfr 形式),这两种形式可以相互转变[13]。高温会加速phyB 从活化的Pfr 到非活化的Pr 构象的转变,进而解除phyB 对其结合转录因子PIF4(PHYTOCHROME INTERACTING FACTOR 4)的抑制作用,增强PIF4 的蛋白稳定性和转录活性,诱导下胚轴伸长[14-15]。高温也会促进PIF7mRNA 的翻译过程,使PIF7 蛋白快速积累,进一步诱导生长素合成基因YUCCA8的转录来诱导热形态建成[16]。ELF3 是生物钟晚间复合体的成员,晚间复合体由LUX(LUX ARRHYTHMO)、ELF3 和ELF4(EARLY FLOWERING 4)组 成[17]。ELF3 直接与ELF4、LUX 蛋白相互作用,作为支架将ELF4 和LUX 结合在一起;ELF4 能促进ELF3 和整个晚间复合体的核定位;LUX 具有DNA 结合能力,负责将晚间复合体招募到靶基因启动子上[18-19]。高温削弱晚间复合体的DNA 结合能力,进而减轻对下游靶基因PIF4的抑制,促进热形态建成[12]。高温也会影响ELF3 的活性,通过促进ELF3 液-液相分离,解除对下游基因的抑制,诱导热形态建成[20]。总的来说,温和高温能抑制phyB和ELF3的活性,增强PIF7活性来诱导地上部热形态建成。此外,动物中的CLK(CDC-Like Kinase)激酶已被证实参与调控高温下的可变剪接,它能够感知温度变化,改变对丝氨酸/精氨酸蛋白的磷酸化[21]。Lin 等[22]发现植物中的CLK 同源蛋白AFC2(ARABIDOPSIS FUS3 COMPLEMENTING GENE 2)激酶活性同样对高温敏感,能参与调控高温下的可变剪接,并负调控热形态建成。PIF4是拟南芥热形态建成的中心调节因子,温度感受器接受高温信号后能够稳定PIF4 蛋白活性或促进其转录活性,PIF4 进一步通过诱导生长素的生物合成促进下胚轴伸长[23-25]。通过这一系列研究,目前对地上部热形态建成的机制已经基本明确。
2 植物根部热形态建成的调控机制
2.1 高温促进植物根部热形态建成
温和高温会促进植物根部伸长,这一现象称为根部热形态建成(见图1)。研究发现,无论是短期高温,还是长期高温处理都会促进拟南芥主根伸长[26-27],即便是切除下胚轴和子叶的离体根段在高温处理下仍然可以伸长,因此认为植物根部具有自主感知和响应高温的能力[25,28]。目前已发现了根部热形态建成的部分调控机制(见图1)。
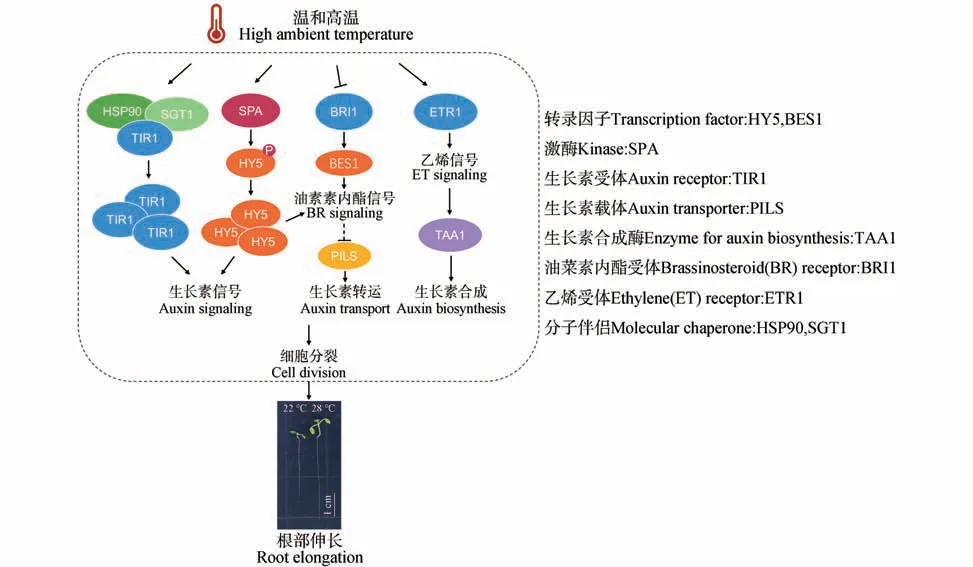
图1 拟南芥根部热形态建成调控网络Fig.1 The regulatory network of root thermomorphogenesis of A.thaliana
2.2 根部热形态建成调控的关键信号分子
植物地上部和根部热形态建成之间存在一定的联系,但同时也具有组织特异性,它们分别由不同的转录因子所介导。相较于PIF4在植物地上部热形态建成的重要作用,PIF4 在根热形态建成中并不是必需的[29]。HY5(LONG HYPOCOTYL 5)是根部热形态建成的正调节因子。Lee等[30]发现hy5突变体的根热形态建成存在缺陷,说明HY5 是根部热形态建成的正调节因子。进一步研究发现,HY5 能调节根系组织中的基因表达如生长素信号基因IAA19、SAUR40、SAUR77,进而促进根部热形态建成。同时,HY5 也和油菜素内酯介导的根系伸长有关,HY5 能直接调节油菜素内酯代谢基因BAS1和SOB7的表达。此外,高温会通过调控SPA(SUPPRESSOR OF PHYA-105)激酶对HY5的磷酸化影响HY5 蛋白稳定性。高温下模拟HY5 磷酸化形式的转基因株系(35S:HY5-S36D/hy5-215)表现出与HY5 正常转基因株系(35S:HY5/hy5-215)相似的根长表型,而HY5 磷酸化位点突变的转基因株系(35S:HY5-S36A/hy5-215)根热形态建成存在缺陷。总之,高温能促进SPA 激酶对HY5 的磷酸化,磷酸化的HY5蛋白具有更高的稳定性,直接调节生长素和油菜素内酯代谢相关基因的表达,进而促进根系伸长。地上部衍生的信号对根系热形态建成也起一定作用。HY5 可以介导植物地上部和根部之间的通讯,HY5 蛋白能从地上部转移至根部以调节植物生长[31-32],Gaillochet 等[33]发现hy5突变体的地上部和根部热形态建成表型能通过抑制PIFs 表达而被挽救,说明HY5 和PIFs 共同作用以调节地上部和根部热形态建成。
温度感受器phyB、ELF3和PIF7在调控温和高温下胚轴的伸长中起关键作用[14-16]。然而Borniego 等[34]发现,在植物根部热形态建成中,phyB、ELF3 和PIF7 并不具有温度感受器的功能。首先,在28 ℃下,phyB、elf3、pif7突变体的主根会伸长,但伸长率要小于野生型拟南芥。在地上部热形态建成中高温会抑制phyB 和ELF3 的活性,那么如果phyB 和ELF3 在根部热形态建成中起温度传感器功能,其功能缺失突变体的根长应该在20 ℃下伸长;pif7突变体的表型与其在地上部热形态建成中的相符。其次,phyB 的热逆转对其作为温度感受器的功能是非常重要的,高温会促进phyB 由Pfr转变为Pr 形式,加速phyB 的失活,从而诱导地上部热形态建成[14-15],而热逆转严重受损的phyB 变异体(phyBY361F和phyBR582A)与正常phyB 都能恢复phyB突变体的根部热形态建成。在下胚轴中,核内小体的大小与phyB 的活性相关,高温下phyB 核内小体会变小;而在根中,高温下伸长区细胞phyB核内小体的大小没有变化,根尖细胞phyB 核内小体的数量略微增加。这说明根中phyB 的热逆转较为稳定,以Pfr 活性形式存在,从而促进根系生长。温和高温下,下胚轴细胞中ELF3 核内小体的数量在一天内随时间而变化,上午ELF3 核内小体数量增加,下午数量减少;但是在根细胞中温度升高会导致ELF3 核内小体数量减少。高温能促进地上部PIF7的 转录和PIF7 蛋白积累[16,35],而 在28 ℃下,根部PIF7 蛋白丰度比在22 ℃降低,根部PIF7的表达也没有变化。说明高温对根部PIF7的影响可能通过转录后水平来实现。尽管phyB、ELF3 和PIF7 不是根部的温度感受器,但它们部分参与调节了植物根热部形态建成。
2.3 根部热形态建成调控的主要激素途径
植物地上部热形态建成的调控主要通过温度感受器(phyB、PIF7、ELF3)、特定转录因子(PIF4)和植物激素生长素来实现[36]。其中,植物激素将外源信号整合到植物生长过程中,从而调节植物的生长和发育[37]。尽管目前还没有研究发现存在于植物根部的温度感受器,但多项研究已表明根部热形态建成与植物激素密切相关。
2.3.1 生长素
拟南芥地上部的热形态建成主要由生长素(IAA)介导[26-27,33,38],根据这一线索,许多研究者开始探索生长素在根部热形态建成中的作用。根据目前研究来看,温和高温可以通过影响生长素的感知、信号转导、生物合成和运输来调控植物根部伸长。当拟南芥幼苗在27~29 ℃条件下生长或将其转移至27~29 ℃条件时,幼苗根部的生长素信号报告基因(如DR5)荧光强度会增加,这表明生长素信号可能在根部热形态建成中发挥作用[26-27,39]。 TIR1/AFB(TRANSPORT INHIBITOR RESPONSE1/AUXIN RESPONSE F-box)是生长素受体,能够感知生长素信号[40]。Wang 等[27]发现,高温下拟南芥tir1功能缺失突变体的根部伸长受到抑制。进一步研究发现,在29 ℃高温下,分子伴侣HSP90(HEAT SHOCK FACTOR 90)及其协同伴侣SGT1(SUPPRESSOR OF G2 ALLELE SKP1)共同促进TIR1 蛋白水平的增加,进而增强生长素信号转导,促进根系伸长。TMK1(RECEPTOR-LIKE TRANSMEMBRANE KINASE 1)是独立于TIR1/AFB 系统参与生长素感知的跨膜激酶,Gaillochet等[33]发现与野生型拟南芥相比,高温下tmk1 tmk4双突变体根的伸长率降低。这些研究都证实了生长素感知和信号传导是根系热形态建成所必需的。另外,Gaillochet 等[33]发现,生长素合成基因YUCCAs突变会影响拟南芥根部对高温的响应,说明生长素的生物合成也是温和高温促进根伸长所必需的。由载体蛋白驱动的生长素运输在根系高温响应中起重要作用。Hanzawa 等[26]发现经29 ℃高温处理后,生长素转运突变体aux1(生长素内流载体突变体)和eir1/pin2(生长素外流载体突变体)的根系伸长受到抑制,进一步研究发现高温会促进由PIN2 介导的生长素外排,以调节细胞内生长素稳态,从而调节根系生长。PILS(PIN-LIKES)蛋白是定位于内质网的生长素载体,能将生长素从胞质转运到内质网腔,间接抑制了生长素向细胞核的运输,从而减弱生长素信号转导[37,41-42]。Feraru 等[37]发现温和高温会降低根尖分生组织细胞内PILS6 的蛋白丰度,导致生长素在细胞核中积累,促进生长素信号转导,诱导根系生长。相应地,在拟南芥pils6突变体中也观察到了根系热形态建成的缺陷表型。
此外,最近研究发现高温能加快根尖分生组织的细胞分裂速度,进而诱导根部热形态建成,在该过程中生长素发挥着关键作用。早在1973 年,Grif 等[43]就提出了低温下植物根系生长迟缓是由细胞周期持续时间延长导致的。后续有研究认为高温能促进细胞分裂速率,很有可能是通过影响细胞周期持续时间来实现的[44-45]。2013年,Hanzawa 等[26]观察到高温下根尖中细胞周期标记基因CYCB1;1-GUS活性增强,并认为高温诱导的根部生长主要是由于细胞分裂增加引起的。2017 年,Yang等[39]在拟南芥根部进行的动力学研究支持高温对细胞分裂的促进作用,但却将此解释为对分生组织缩短的补偿机制,并提出在高温下伸长区细胞伸长在促进根系生长中的重要作用。Feraru等[37]也观察到高温下拟南芥根尖分生组织的缩短。因此,高温诱导的主根伸长是由于根部细胞伸长还是细胞分裂增加引起的还存在争议。近期研究发现,在28 ℃下,拟南芥幼苗根细胞的数量急剧增加,进一步研究发现是由于根尖分生组织细胞分裂速率增加引起的,并且该过程依赖于生长素[28]。该研究还发现施用生长素生物合成抑制剂会抑制根部热形态建成,并且阻断地上部生长素运输不影响根部热形态建成,还发现高温通过吲哚-3-丙酮酸途径诱导根部生长素的生物合成。总之,该研究证明高温诱导的细胞分裂依赖于生长素,建立了温度、生长素和细胞周期三者的直接联系。这也进一步说明植物地上部和根部热形态建成由不同的信号通路介导,根部很有可能存在独立于地上部自主感知高温信号的分子机制。
2.3.2 油菜素内酯
在植物地上部热形态建成中,生长素往往与其他植物激素如油菜素内酯相互作用共同发挥作用[36]。温和高温诱导子叶中生长素合成,随后生长素移动到下胚轴,并触发局部油菜素内酯诱导的细胞伸长[25]。油菜素内酯可以通过调节分化细胞伸长和分生组织大小影响根系生长[46-48]。研究发现,油菜素内酯在根部热形态建成中也发挥作用。Martins等[10]发现,在26 ℃条件下,油菜素内酯受 体BRI1(BRASSINOSTEROID INSENSITIVE1)的蛋白水平下降,导致油菜素内酯信号转导受阻,从而介导根部伸长。对应的,在26 ℃下,油菜素内酯信号响应缺陷突变体bri1和bes1(bri1EMS SUPPRESSOR 1)的根系伸长受到抑制。有趣的是,Sun 等[49]发现油菜素内酯信号限制了生长素转运载体PILS 蛋白在内质网的积累,从而增加了生长素的核输入,促进生长素信号转导。同时,Feraru等[37]发现高温能抑制PILS 蛋白的积累,促进生长素入核并诱发根部热形态建成,说明油菜素内酯信号在高温诱导的PILS 蛋白的抑制中起关键作用。
2.3.3 乙烯
植物激素乙烯对根系生长有显著的抑制作用。乙烯能够和生长素协同作用,通过调节根顶端分生组织的细胞增殖和伸长区细胞伸长来抑制主根生长[50-52]。在高温下,乙烯也能够和生长素协同作用,调控根部形态建成。Fei 等[53]发现,TAA1(TRYPTOPHAN AMINOTRANSFERASE OF ARABIDOPSIS)依赖的生长素生物合成和ETR1(ETHYLENE RESPONSE1)依赖的乙烯信号共同介导根部热形态建成。在27 ℃,taa1突变体的根长明显变短。外源施加乙烯前体ACC(1-aminocyclopropane-1-carboxylic acid)能恢复taa1突变体的根长表型,但不能恢复taa1 etr1的根长表型。这说明乙烯通过依赖ETR1 的途径调节taa1突变体对高温的敏感性。进一步研究发现,高温通过增强ETR1介导的乙烯信号来促进TAA1依赖性生长素的生物合成,而由TAA1介导的生长素合成对高温下维持AUX1、PIN1和PIN2的表达是至关重要的。以上结果说明乙烯是高温下维持生长素水平和运输所必需的。
3 植物根部热形态建成研究展望
尽管目前已发现了一些与植物根部热形态建成联系密切的信号分子和植物激素,但其更深入的分子机理仍需进一步研究。有研究发现植物根部可能存在未知的热传感器,能够以生长素为信使将高温信号传递到细胞周期,增加根顶端分生组织中的细胞分裂速率,促使根部伸长[28]。植物根部是否存在独特的温度感受器?其具体存在于根部哪些组织类型?这些有趣的科学问题尚待研究。
目前对于植物根部热形态建成的理解和研究主要基于双子叶模式植物拟南芥,虽然在单子叶模式植物二穗短柄草(Brachypodium distachyon)中也发现了与拟南芥相似的由H2A.Z 核小体介导的高温响应机制[54],但是单子叶植物中是否也存在根部热形态建成?是否在单双子叶植物中存在保守的调控机制?
根部热形态建成的生理意义目前也不是十分清楚。如果阻断根部热形态建成行为是否会影响到植物地上部分的高温响应?根部热形态建成是否会增强植物在高温下的水分吸收能力?另一方面,由于干旱和高温往往并存,是否干旱和高温利用同样的分子机制调控植物的根伸长行为?
