硫酸盐对粘红酵母X-20富硒能力的调控研究
2024-01-02郭锦堂薄少波张根林
郭锦堂 薄少波 张根林


摘要:为了探究硫酸盐对粘红酵母X-20(Rhodotorula glutinis X-20)富硒的影响,在恒定浓度亚硒酸钠和梯度浓度硫酸钠条件下培养R.glutinis X-20,研究硫酸盐对R.glutinis X-20生物量、总硒及硒纳米颗粒的影响,并使用RT-qPCR初步探索了硫酸盐调节R.glutinis X-20富硒的分子机制。研究发现,硫酸钠的添加使菌株的生物量提高了48.5%,总硒及硒纳米颗粒含量分别降低了36.7%和48.8%。RT-qPCR分析显示硫酸盐会抑制硒代谢关键基因CTH、metE、metB的表达,造成硫酸盐存在条件下总硒及硒纳米颗粒含量下降。硫酸盐的添加提高了R.glutinis X-20在亚硒酸钠环境中的生物量,这对富硒酵母产品的大规模生产具有重要意义。同时,RT-qPCR的结果也为R.glutinis X-20在分子生物学上的优化指明了方向。
关键词:粘红酵母;硫酸盐;硒代谢;硒纳米颗粒
中图分类号:中图分类号Q815文献标志码:A文献标识码
Sulfate regulation of selenium enrichment in Rhodotorula glutinis X-20
GUO Jintang,BO Shaobo,ZHANG Genlin*
(School of Chemistry and Chemical Engineering, Shihezi University, Shihezi,Xinjiang 832003,China)
Abstract: To investigate the effect of sulfate on the selenium enrichment of Rhodotorula glutinis X-20, the yeast was cultured under constant sodium selenite concentration and gradient sodium sulfate concentration to investigate the effect of sulfate on the biomass of the yeast, total selenium and selenium nanoparticles, and RT-qPCR was used to explore the preliminary mechanism of sulfate regulation of yeast selenium enrichment using RT-qPCR to explore the molecular mechanism of sulfate regulation. The addition of sodium sulfate was found to increase the biomass of the yeast strain by 48.5% and decrease the total content of selenium and selenium nanoparticle by 36.7% and 48.8%, respectively. RT-qPCR analysis revealed that sulfate suppressed the expression of CTH, metE, and metB, key genes for selenium metabolism, resulting in a decrease in the total content of selenium and selenium nanoparticles in the presence of sulfate. The addition of sulfate improved the biomass of R.glutinis X-20 in the sodium selenite environment, which is important for the large-scale production of selenium-enriched yeast products. Meanwhile, the results of RT-qPCR also indicated the direction for the optimization of R.glutinis X-20 in molecular biology.
Key words: Rhodotorula glutinis;sulfate;selenium metabolism;selenium nanoparticles
硒(Se)最早由瑞典科學家J.J.Berzelius于1817年发现,早期被认为是一种有毒物质[1]。但在20世纪中叶,对大鼠疾病研究显示硒对动物存在积极的作用[2]。1973年硒代半胱氨酸被发现是谷胱甘肽过氧化物酶的活性中心成分。同年,世界卫生组织确认硒是人体重要的微量元素之一[3]。至此,结束了持续100多年的硒是有毒物质还是有益元素的争论,并开启了硒元素化学形态及生物学效应的研究热潮。截至目前,已经有包括富硒酵母、富硒大米等大量富硒产品投入使用。
自然界中,硒主要以无机硒和有机硒的形式存在。硒酸盐、亚硒酸盐等无机硒主要存在于土壤岩石中,有机硒则多以硒代氨基酸的形式存在于生物体中,无机硒和有机硒都能为人体起到补充硒的作用,但是相较于无机硒,有机硒毒性更小且生物活性更高[4]。
硒在生物学中起着重要的作用。它是人类和动物体内必需的微量元素,是多种硒蛋白的重要组成元素,同时硒代氨基酸也充当着多种抗氧化酶的活性中心,如谷胱甘肽过氧化物酶(GPx)、硫氧还蛋白还原酶(TrxR)等,它们能够保护细胞免受氧化过程中产生的自由基的有害影响[5]。同时硒也被证明能够减少活性氧引起的人类疾病[6-8]。此外,有研究[9]表明适量的硒能够有效降低某些癌症的发病率和死亡率。相反的,硒的缺乏也会引起一些疾病。中国广泛存在的地方性疾病克山病主要病因就是硒元素的缺乏。硒摄入不足也会导致牛羊等家畜出现肌肉萎缩、肝坏死、牙周病、不育症和发育不全等疾病[5,10-11]。然而天然产品中的硒含量普遍较低,无法满足人体对硒的需求[12]。通过给动物饲喂富硒日粮,能够将硒以有机形态的形式富集在肉、蛋、奶等畜产品中,再经过生物链的传递进入人体,是一种经济安全的补硒方式[13]。目前虽然大多数饲料依旧使用亚硒酸钠作为硒添加剂,但是对于生物体来说,亚硒酸钠存在毒性大,生物利用性低的弊端[14-15]。因此,相比于硒酸盐、亚硒酸盐等无机硒源,富硒酵母作为一种更加安全、廉价且快速的富硒手段被广泛接受。
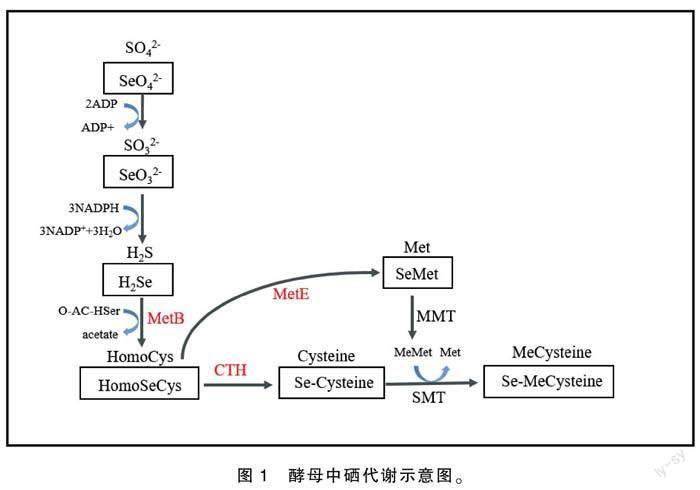
由于硒元素与硫元素的相似性,酵母对硒的富集主要是借助硫的代谢途径进行的,具体步骤如图1所示。硒酸盐首先借助ATP磺化酶等酶的作用转化为亚硒酸盐,并在硫酸盐还原酶的作用下进一步转化为硒化氢。硒化氢与O-乙酰高丝氨酸在胱硫醚γ合酶的作用下生成硒代高半胱氨酸,这是无机硒向有机硒转化的关键步骤。接下来,在胱硫醚γ-裂解酶和5-甲基四氢蝶酰三谷氨酸-高半胱氨酸-S-甲基转移酶的作用下生成硒代半胱氨酸及硒代甲硫氨酸[16]。
相较于硒酸盐,亚硒酸盐细胞毒性较低[15],因此本实验使用亚硒酸盐作为硒源,并使用梯度浓度的硫酸盐对富硒酵母Rhodotorula glutinis X-20进行培养,通过对富硒酵母生长速率、总硒含量、硒纳米颗粒含量的变化进行分析,探究硫酸盐对富硒酵母富硒能力的影响,同时使用RT-qPCR探究在以上条件下CTH、metE、metB基因表达量的变化,为富硒酵母产品的开发和优化提供参考。
1 材料与方法
1.1 菌株与培养基
本实验所用的粘红酵母R.glutinis X-20筛选自新疆天山北部富硒地区[17]。菌株被保藏到中国典型培养物保藏中心,保藏号为CCTCCM2017225。使用YPD培养基(20 g·L-1胰蛋白胨、10 g·L-1酵母浸出粉、20 g·L-1葡萄糖)对菌株进行发酵培养。
1.2 主要仪器与试剂
1.2.1 主要仪器
MLS33750型高压灭菌锅,三洋(日本)公司;Megafuge 8R台式离心机,Thermo Fisher(美国)公司;Light Cycler-96实时荧光定量PCR仪,Roche(瑞士)公司;UV-2600紫外分光光度计,岛津(日本)公司;ICAP6300光谱仪,Thermo Fisher(美国)公司。
1.2.2 主要试剂
酵母总RNA提取试剂盒购买自生工生物工程(上海)股份有限公司,cDNA反转录试剂盒、HiScript II Q RT SuperMix for qPCR (+gDNA wiper)试剂盒购买自南京诺唯赞生物科技有限公司,SYBR Premix Ex TaqTM II(TliRNaseH Plus)试剂盒购自TaKaRa公司。
1.3 菌株培养
菌株从-80℃超低温冰箱取出后使用YPD固体培养基活化,挑取单菌落接种至YPD液体培养基,220 r·min-1,30℃培养至OD值为1时作种子液。按1%的接种量将种子液接种至添加了恒定浓度亚硒酸钠(30mg·L-1)及梯度浓度硫酸钠(0、5、10、20、40、60、120 mg·L-1)的YPD液体培养基中,每隔12h测菌液OD值,绘制生长曲线。
1.4 总硒测定
使用电感耦合等离子体光谱法检测酵母样品中的总硒。使用冷冻干燥获取干酵母样品,称重后取适量干酵母样品置于聚四氟乙烯消解罐中,加入6.0 mL HNO3和 2.0 mL 30% H2O2,于通风橱中静置过夜。密闭消解罐,按表1微波消解程序进行消解;消解完毕后,打开消解罐,将消解后的样品溶液在电热板130℃上加热赶酸至 1~2 mL左右,冷却后使用超纯水定容至 25 mL,同时做空白试验[18]。
取10 mL定容后的样品上机待测。检测条件:射频功率 1 300 W,等离子体流量15 L·min-1,輔助气流量0.2 L·min-1,雾化气流量 0.6 L·min-1,轴向观测。
1.5 硒纳米颗粒的检测
将培养后的菌体10 000 rpm离心10 min,弃上清,使用5 mL 1M氯化钠洗3次,并在2.5 mL 1M硫化钠(Na2S)溶液中溶解1 h,在4 000 rpm离心10 min,去除不溶性细胞壁部分。用紫外分光光度计在500nm处测定样品的吸光度。
硒纳米颗粒的标准曲线是根据Biswas等[19]的方法构建的。配制6 mg·mL-1亚硒酸钠母液,分别吸取取50、100、200、300、400 μL母液并加入250 μl 0.1M 盐酸羟胺使SeO32-定量还原为Se0。然后,向每个试管中加入1 mL 1M的Na2S溶液,1 h后,测量溶液在500 nm处的吸光度。以Se0的摩尔浓度为横坐标,500 nm处的吸光度值为纵坐标绘制标准曲线如图2。
1.6 RNA的提取及RT-qPCR
酵母总RNA的提取使用生工生物工程(上海)股份有限公司的柱式真菌总RNA抽提纯化试剂盒,纯化后的RNA使用HiScript II Q RT SuperMix for qPCR (+gDNA wiper)试剂盒进行反转录操作,接着使用SYBR Premix Ex TaqTM II(TliRNaseH Plus)试剂盒进行RT-qPCR操作,以检测不同浓度硫酸盐影响下的硒代谢关键基因CTH、metE、metB的表达量,并以ACT1作为内参基因。所用的引物由Primer3在线设计(https://bioinfo.ut.ee/primer3-0.4.0/)。引物信息见表2。
2 结果与分析
2.1 硫酸盐对酵母生长的影响
使用恒定浓度的亚硒酸盐(30mg·L-1)及梯度浓度的硫酸盐(0、5、10、20、40、60、120 mg·L-1)对R. glutinis X-20进行培养,每隔12h记录菌液OD值以绘制硫酸盐影响下的酵母生长曲线。实验结果如图3所示,在初始的10 h内,添加了亚硒酸盐的酵母生长速率与对照组相差较小,这与普遍认为的硒能够抑制酵母生长的观点相冲突。Zhou等[20]研究认为,硒的加入能够改善酵母细胞中谷胱甘肽过氧化物酶的代谢,这可以帮助酵母细胞适应发酵过程中的胁迫作用,从而促进酵母细胞的生长。但是随着发酵时间的增长,亚硒酸盐对酵母细胞的抑制作用更加显著,其生长速率也逐渐减慢。总体上,只添加亚硒酸盐时,粘红酵母的生长受到明显的抑制,但额外添加不同浓度的硫酸盐时,酵母生长速率略有恢复,但始终低于对照组。
2.2 硫酸盐对酵母富硒能力的影响
使用2.1相同的方式培养菌株,84 h后收集菌体,使用冷冻干燥仪干燥菌体后称重,取0.2 g干菌体按照1.3中微波消解法处理样品后使用电感耦合等离子体光谱法检测酵母细胞中总硒的含量。图4表明在不添加硫酸钠和亚硒酸钠的条件下,酵母生物量最高,为9.44 g·L-1。在单独添加亚硒酸钠时,菌体生物量最低,只有5.63 g·L-1,但此时总硒含量最高达到256.6 μg·g-1,说明亚硒酸盐的细胞毒性对菌株的生长影响较大。随着硫酸盐的加入,菌体总硒含量降低至原来的60%左右,但生物量恢复至接近对照组的水平,说明硫酸盐的加入能够促进R.glutinis X-20在亚硒酸钠环境中的生长。考虑到硒在酵母中的代谢是借助硫酸盐代谢途径进行的,因此推测硫酸盐的加入能够降低酵母细胞中硒对硫的取代,减少硒元素带来的有害影响。研究[16]表明,酵母对硒酸盐的吸收严格依赖于培养基中硫酸盐的水平,只有在硫酸盐含量不足时,硒酸盐才能完全被酵母吸收和代谢。然而,在仅考虑酵母富硒能力时,硫酸盐的加入显然是不利的。
2.3 硫酸盐对硒纳米颗粒形成的影响
硒纳米颗粒与其他氧化態相比,零价硒具有低毒性和更好的生物利用度,具有其它形式的硒不具备的优势,如小尺寸(50~300 nm)、高稳定性、疏水性和大表面积[21]。生物合成的纳米颗粒具有显著的特性,例如良好的粘附性、摩擦学特性、光学和电学特性等[22-24]。在硒胁迫环境下,R.glutinis X-20在培养过程中也产生了明显的红色沉淀,是硒纳米颗粒形成的明显特征。在对硒纳米颗粒浓度检测的过程中发现,硫酸盐对硒纳米颗粒生物合成的影响与其对酵母总硒的影响相似,在只添加亚硒酸钠的情况下,酵母生物合成硒纳米颗粒的能力最强,硒纳米颗粒浓度为45.29 μg·g-1(图5)。但此时菌体生物量最少,只有空白组的59.6%。后续加入硫酸盐后硒纳米颗粒合成量降低至只添加亚硒酸钠时的50%左右,产生这种影响的原因可能与硫酸盐对总硒的影响相关。
2.4 硫酸盐对富硒相关基因表达量的影响
依据KEGG数据库,酵母硒代谢过程中,调控无机硒向有机硒转化的胱硫醚γ合酶基因(cystathionine gamma-synthase,metB),调控硒代半胱氨酸合成的胱硫醚γ-裂解酶基因(cystathionine gamma-lyase,CTH),调控硒代甲硫氨酸合成的5-甲基四氢蝶酰三谷氨酸-同型半胱氨酸S-甲基转移酶基因(5-methyltetrahydropteroy-ltriglutamate-homocysteine S-methyltransferase,metE)是其中的关键基因。利用RT-qPCR方法检测了在不同硫酸盐浓度下CTH、metB、metE基因表达量的变化。图6是使用对获得的RT-qPCR数据进行分析获得的溶解曲线,每条溶解曲线只有一个峰,且特征峰出现在80℃之后,说明RT-qPCR过程中没有引物二聚体等非特异性扩增,实验获得的数据可信。
qPCR获得的实验结果见图7,在只加入亚硒酸钠的条件下,CTH、metE、metB 3个基因均有上调,分别上调至对照组的2.93倍、1.29倍和1.35倍。加入硫酸盐后,CTH的表达量恢复至对照组的水平。metE,metB被抑制表达,表达量分别下降42%和64%。结合总硒及硒纳米颗粒检测结果,CTH、metE、metB基因对亚硒酸盐和硫酸盐有明显的响应,亚硒酸钠的加入使这3个基因的表达水平提高,此时酵母总硒及硒纳米颗粒含量均有增加;加入不同浓度硫酸钠后CTH、metE、metB表达量均有降低,相应的,酵母总硒及硒纳米颗粒含量也随之降低。这说明这3个基因是影响酵母总硒及硒纳米颗粒合成的关键因素。同时硫酸盐能够调节硒环境中CTH、metE、metB基因的表达,进而影响酵母硒代谢。
3 讨论与结论
由于硒元素与硫元素化学性质的相似性,微生物对硒的代谢与硫代谢机制相似。硒酸盐和亚硒酸盐进入酵母细胞后,能够借助硫酸盐的还原途径[25],还原为硒代谢重要中间产物硒化氢(H2Se),这可能是硒酸盐或亚硒酸盐产生细胞毒性的主要原因[26]。同时,硒元素能够取代含硫氨基酸中的硫元素生成硒代氨基酸,并且非特异性的插入蛋白质中,相关研究表明,蛋白质中硒代甲硫氨酸取代甲硫氨酸虽然不会显著改变酶的动力学特征,但是会影响它们的物理特性,导致蛋白质稳定性下降。例如,50%的蛋氨酸残基被硒代甲硫氨酸取代的β-半乳糖苷酶蛋白具有与野生型酶相似的 Km和 Vmax值,但是,与野生型酶相比,含有硒代甲硫氨酸的β-半乳糖苷酶稳定性较差[8,27],这也是硒元素细胞毒性的原因之一。
本研究中,使用30 mg·L-1亚硒酸钠对R.glutinis X-20进行培养,实验获得的生长曲线及生物量相关数据均表明亚硒酸钠对菌株的生长产生了明显的抑制,并且在加入不同浓度的硫酸盐后,菌株生物量得以恢复,但始终无法恢复至对照组的水平。在相同培养条件下对总硒和硒纳米颗粒的检测过程中发现,相比于只添加亚硒酸钠的酵母菌株,添加不同浓度硫酸钠后总硒及硒纳米颗粒含量均有所降低,且在5~120 mg·L-1的浓度范围内,总硒及硒纳米颗粒含量的降低程度与硫酸钠浓度无关。因此,可以初步推断硫酸盐在酵母生长过程中硒与硫的竞争中存在明显的优势,硫酸盐的加入降低了酵母对硒元素的富集,这减少了硒化氢(H2Se)的合成,降低了含硫蛋白质中硒元素的掺入,从而使R.glutinis X-20在亚硒酸钠环境中的生物量有所恢复。但是此过程中使用硫酸盐的最低浓度还需要进一步研究。而在对硒代谢关键基因CTH、metE、metB表达量的检测表明硫酸盐会导致硒代谢相关基因表达量的下降,这可能是加入硫酸盐后造成菌株富硒能力下降的原因之一。此外,硒酸盐或亚硒酸盐在进入酵母细胞时主要是依赖硫的转运途径进行的[28],硫酸盐的加入可能会与亚硒酸盐竞争相关的转运途径,从而使酵母细胞对硒的吸收量降低,从而导致总硒及硒纳米颗粒含量降低。
总之,硫酸盐虽然降低了酵母对硒的富集,但也提高了R.glutinis X-20在亚硒酸钠环境中的生物量,因此,在实际生产中可通过额外添加硫酸盐来提高富硒酵母的产量。此外,RT-qPCR结果为进一步提高R.glutinis X-20硒富集能力提供了新的思路,通过对CTH、metE、metB基因进行过表达等分子生物学手段提高其表达量进而加强R.glutinis X-20对硒元素的吸收。这对R.glutinis X-20富硒能力的进一步优化具有重要意义。
参考文献(References)
[1]MALYUGINA S,SKALICKOVA S,SKLADANKA J,et al.Biogenic selenium nanoparticles in animal nutrition:a review[J].Agriculture,2021,11(12):1244.
[2]PILON-SMITS E A H.On the ecology of selenium accumulation in plants[J].Plants,2019,8(7):197.
[3]董愛华,陈训银.硒的营养作用研究历程及富硒酵母作为畜禽营养应用概述[J].畜牧产业,2012(9):51-53.
DONG A H,CHEN X Y.Research history on the nutritional effects of selenium and the application of selenium-enriched yeast as livestock and poultry nutrition[J].Animal Agriculture,2012(9):51-53.
[4]FAIRWEATHER-TAIT S J,COLLINGS R,HURST R.Selenium bioavailability:current knowledge and future research requirements[J].The American Journal of Clinical Nutrition,2010,91(5):1484S-1491S.
[5]廖金凤.土壤环境中的硒对人和动物健康的影响[J].广东微量元素科学,2002,9(3):20-23.
LIAO J F.Effect of selenium in soil on health of human beings and animals[J].Guangdong Trace Elements Science,2002,9(3):20-23.
[6]李海蓉,杨林生,谭见安,等.我国地理环境硒缺乏与健康研究进展[J].生物技术进展,2017,7(5):381-386.
LI H R,YANG L S,TAN J A,et al.Progress on selenium deficiency in geographical environment and its health impacts in China[J].Current Biotechnology,2017,7(5):381-386.
[7]朋玲龙,王先良,陈霞,等.我国硒的环境分布及其健康影响[J].安徽预防医学杂志,2015,21(1):33-36.
PENG L L,WANG X L,CHEN X,et al.Environmental distribution of selenium and its effect on human health[J].Anhui Journal of Preventive Medicine,2015,21(1):33-36.
[8]KITAJIMA T,CHIBA Y.Selenomethionine metabolism and its toxicity in yeast[J].Biomol Concepts,2013,4(6):611-616.
[9]MUZEMBO B A,NGATU N R,JANUKA K,et al.Selenium supplementation in HIV-infected individuals:A systematic review of randomized controlled trials[J].Clinical Nutrition ESPEN,2019,34:1-7.
[10]SOBIECH P,ARCZYN'SKA K.The influence of selenium deficiency on chosen biochemical parameters and histopathological changes in muscles of goat kids[J].Polish Journal of Veterinary Sciences,2020,23(2):267-279.
[11]RODRIGUEZ A M,SCHILD C O,CANTN G J,et al.White muscle disease in three selenium deficient beef and dairy calves in Argentina and Uruguay[J].Ciência Rural,2018,48(5):e20170733.
[12]唐新欣,贺蓉.中国缺硒状况的调查[J].医药世界,2002(6):22-24.
TANG X X,HE R.Investigation of selenium deficiency in China[J].World of Medicine,2002(6):22-24.
[13]贾雪婷,赵青余,张军民,等.富硒畜产品研究进展[J].中国食物与营养,2021,27(2):26-31,10.
JIA X T,ZHAO Q Y,ZHANG J M,et al.Research progress on selenium-enriched livestock products[J].Food and Nutrition in China,2021,27(2):26-31,10.
[14]DAVIS T Z,TIWARY A K,STEGELMEIER B L,et al.Comparative oral dose toxicokinetics of sodium selenite and selenomethionine[J].Journal of Applied Toxicology,2017,37:231-238.
[15]FINLEY J W.Bioavailability of selenium from foods[J].Nutrition Reviews,2006,64(3):146-151.
[16]MAPELLI V,OLSSON L.The interplay between sulphur and selenium metabolism in yeast influences the intracellular redox balance[J].Fems Yeast Research,2012,12(1):20-32.
[17]娄兴丹,张根林,叶邦策.高富硒酵母的筛选及富硒强化研究[J].生物技术通报,2017,33(12):132-137.
LOU X D,ZHANG G L,YE B C.Screening of high selenium-enriched yeast and enhancement of its selenium-enriched capacity[J].Biotechnology Bulletin,2017,33(12):132-137.
[18]梁伟玲,许一平,宋丽丽,等.微波消解-ICP-OES测定北沙参及茎叶中硒的含量[J].化工管理,2019(32):42-43.
LIANG W L,XU Y P,SONG L L,et al.Determination of Se in glehnia littoralis and stems and leaves by microwave digestion-ICP-OES[J].Chemical Management,2019(32):42-43.
[19]BISWAS K C,BARTON L L,TSUI W L,et al.A novel method for the measurement of elemental selenium produced by bacterial reduction of selenite[J].J Microbiol Methods,2011,86(2):140-144.
[20]ZHOU N,LI D S,WU S,et al.Acceleration effect of sodium selenite on yeast growth and fermentative capability[J].The Journal of General and Applied Microbiology,2015,61(1):27-30.
[21]HOSNEDLOVA B,KEPINSKA M,SKALICKOVA S,et al.Nano-selenium and its nanomedicine applications:a critical review[J].International Journal of Nanomedicine,2018,13:2107-2128.
[22]WANG H,ZHANG J,YU H.Elemental selenium at nano size possesses lower toxicity without compromising the fundamental effect on selenoenzymes:comparison with selenomethionine in mice[J].Free Radical Biology & Medicine,2007,42(10):1524-1533.
[23]YUAN Y Q,ZHU J M,LIU C Q,et al.Biomineralization of Se nanoshpere by Bacillus licheniformis[J].Journal of Earth Science,2015,26(2):246-250.
[24]ZHANG W J,CHEN Z J,LIU H,et al.Biosynthesis and structural characteristics of selenium nanoparticles by Pseudomonas alcaliphila[J].Colloids and Surfaces B:Biointerfaces,2011,88(1):196-201.
[25]BIRRINGER M,PILAWA S,FLOH L.Trends in selenium biochemistry[J].Natural Product Reports,2002,19:693-718.
[26]TARZE A,DA UPLAIS M,GRIGORAS I,et al.Extracellular production of hydrogen selenide accounts for thiol-assisted toxicity of selenite against Saccharomyces cerevisiae[J].The Journal of Biological Chemistry,2007,282(12):8759-8767.
[27]BOLES J O,CISNEROS R J,WEIR M S,et al.Purification and characterization of selenomethionyl thymidylate synthase from Escherichia coli:comparison with the wild-type enzyme[J].Biochemistry,1991,30(46):11073-11080.
[28]SIRKO A,HRYNIEWICZ M,HULANICKA D,et al.Sulfate and thiosulfate transport in Escherichia coli K-12:nucleotide sequence and expression of the cysTWAM gene cluster[J].Journal of Bacteriol,1990,172(6):3351-3357.
(責任编辑:编辑郭芸婕)
收稿日期:中文收稿日期2022-05-31
基金项目:国家自然科学基金项目(22178226);兵团中青年科技创新领军人才计划项目(2017CB007)
作者简介:郭锦堂(1996—),男,硕士研究生,专业方向为生物化工。
*通信作者:张根林(1981—),男,教授,从事微生物资源开发与利用方向的研究,e-mail:zhgl_food@sina.com。
