不同微载体细胞培养技术在生物制品领域的应用
2024-01-02王晓勋综述张中洋审校
王晓勋综述,张中洋审校
国药中生生物技术研究院有限公司,北京 101111
细胞培养技术在生产疫苗、抗体、干扰素和基因工程药物等多种重要生物制品中发挥关键作用。早期传统的转瓶生产工艺由于操作繁琐、批间差异大、培养面积受限、产能低及传质和传氧差,较难实现实时在线监测,隐性污染高,在生产实践中限制了工艺放大。微载体可为细胞生长提供极大的表面积,简化培养工艺,实现实时在线监测细胞生长,提高了疫苗等多种生物制品的生产力[1-2]。
微载体细胞培养技术可追溯至20世纪60年代,荷兰学者Van Wezel首次用N,N-二乙基乙醇氨(N,Ndiethylethanolamine,DEAE)处理离子交换介质DEAESephadex A50凝胶,使细胞可较好地黏附在其表面进行生长增殖,DEAE-Sephadex A50凝胶具有较大的表面积/体积比率、优良的光学属性和合适的密度,为细胞提供了带电荷的生长微环境[3]。单位面积细胞的生产力决定了细胞培养工艺放大潜力,微载体系统的规模化应用可为贴壁依赖型动物细胞的高产培养提供极大的表面积,适合高效的生产工艺开发和优化放大。近60 年,基于微载体细胞培养技术不断完善,从实验室小试规模到中试生产放大工艺,机械搅拌式反应器、气升式反应器、篮式反应器、流化床反应器等多种生物反应器均得到应用。研究人员主要关注的微载体特征包括:①微载体具有稳定均一的特性,比表面积大,对细胞本身无损害;②细胞能高效黏附微载体,扩增效率高,易放大培养;③微载体具有仿生微环境,细胞生长状态和细胞活性优良;
1 微载体简介
1.1 微载体材料 微载体作为贴壁依赖型细胞生长的支撑介质,高效的附着率和仿生的微环境均对其原材料特性要求较高。材料对微载体的密度、形状、大小、厚度、膨胀度、机械稳定性、毒性、亲水性、疏水性、通透性均有影响,进而影响细胞黏附在微载体表面的生长过程。微载体在使用前一般需要进行预处理,包括孵育溶胀、高温灭菌和营养液平衡。微载体溶液可用高压灭菌而不影响其性能,预处理后即可添加营养液用于细胞培养。
目前已有多种材料应用于微载体生产工艺,如葡聚糖、明胶、聚苯乙烯、聚乙烯、聚酯纤维、聚丙烯、玻璃、丙烯酰胺、硅、硅橡胶、纤维素、胶原蛋白和糖胺聚糖等,这些原材料可形成多种不同形状,常见的有球状、纤维状、管状、微孔状等。在微载体生产制备中,需对这些材料进行包被处理或引入、填充和替换一些功能基团[3]。常见的有在载体表面引入DEAE等功能基团、耦合一些蛋白和多肽及在载体表面包被胶原或明胶等生物大分子。研究显示,每单位微载体比表面积越大对细胞的规模化高产培养越有利,微载体的密度不宜过大或过小,微载体表面的电荷性质和电荷密度决定了细胞贴壁效率和贴壁柔韧性强度[6-7]。
1.2 微载体分类 微载体细胞培养工艺在不断优化和完善,基于微载体的研究也呈现多元化发展的特点,国际市场上出售的商业化微载体类型已达十几种,包括葡聚糖基质微载体、纤维素基质微载体、聚苯乙烯微载体、甲壳质微载体、聚氨酯泡沫微载体、藻酸盐凝胶微载体、磁性微载体及其他微载体等多种类别[8-13]。目前常用的细胞培养用微载体按不同材料分类见表1。
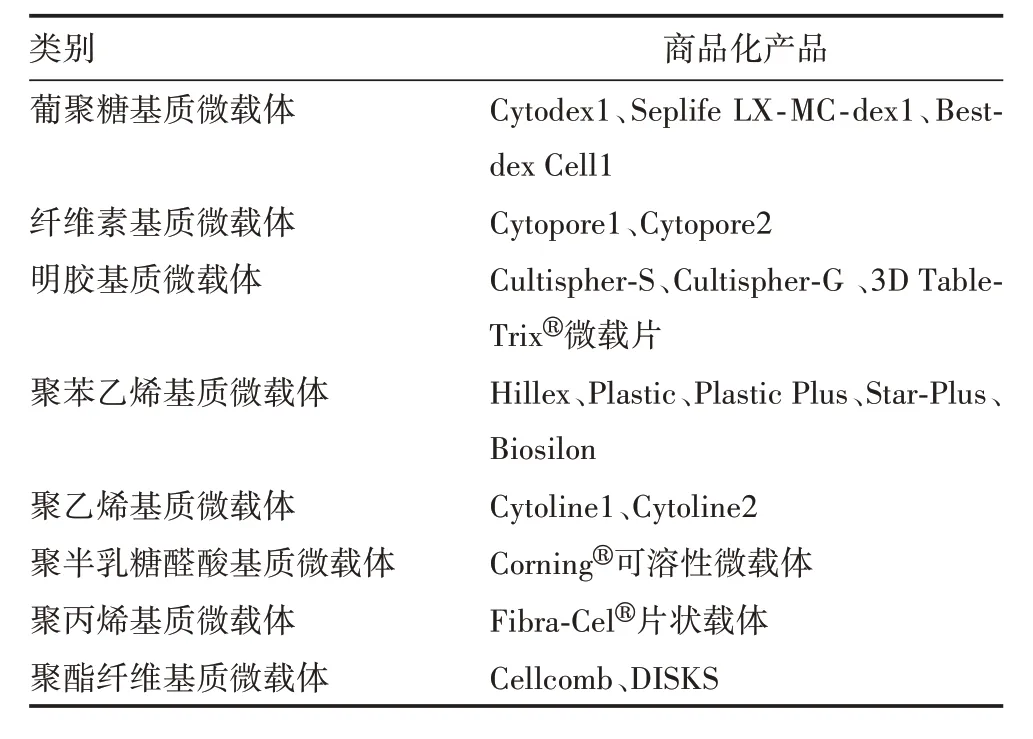
表1 常见微载体的分类Tab.1 Classification of common microcarriers
微载体在贴壁依赖型细胞的规模化培养中发挥着承载性基质的特点,要保障细胞大规模培养工艺有效放大,一般需要对微载体的表面质量特性进行优化,常见方法有在微载体表面包被蛋白及其他功能基团等。微载体一般在干燥条件下储存和开启,室温下可稳定保存5 年以上。近年,有多种不同材料用于微载体的制备,为不同类型细胞培养提供了丰富的可选择基质。
2 不同微载体细胞培养技术的研究现状
2.1 葡聚糖基质微载体 以葡聚糖为基质的微载体广泛应用于药物递送载体、细胞培养和组织修复等领域。此类微载体以交联右旋糖苷为基础架构,具有极大比表面积(>4 000 cm2/g),外观呈白色干粉实心颗粒状,无臭无味,微载体表面经特殊工艺处理覆盖部分带正电荷的DEAE 基团,可满足细胞高效生长,用来开发细胞产品,其中带电基团贯穿整个微载体基质[14]。凡能在体外贴壁的动物细胞几乎均能黏附至此类微载体上,如哺乳动物、禽类、鱼和昆虫细胞等,适用于大多数已确立的细胞系及从原代细胞和正常二倍体细胞株中培养病毒或细胞产物[15-16]。葡聚糖基质微载体种类最经典的商业化产品是美国GE 公司的Cytodex1(2019 年被丹纳赫Cytiva 公司收购),国内也有一些生物公司在研究开发以葡聚糖为基质的微载体,如苏州蓝晓生物科技有限公司的微载体Seplife LX-MC-dex1,博格隆(上海)生物技术有限公司的微载体Bestdex Cell1等均为商业化产品。
据报道,1 mL 营养液使用5 mg Cytodex1 微载体相当于增加30 cm2表面积,可大幅提高细胞扩增空间[15]。周健[17]采用Cytodex1 载体通过3 种不同方式培养Vero 细胞,6 h 后细胞均完全贴壁,培养至第7天,细胞总数最高达(353.4 ± 5.9)× 107个,细胞进入平台期时接种甲型流感病毒,66 h 后细胞100%病变,最高病毒血凝效价为1∶891,明显优于传统的细胞培养工艺。SAĞLAM METINER 等[18]采用3 g/L的Cytodex1 在摇瓶中培养HeLa 细胞,初始细胞浓度为2×105个/mL,培养4 d,按1∶1的体积分数接种弓形虫,最高产量达17.1× 107个,是摇瓶培养工艺产量的10 倍。TRABELSI 等[19]用3 g/L 的Cytodex1 在7 L生物反应器中培养MRC-5细胞,总细胞数最高达2.87×1010个,按MOI=0.005接种AIK-C 麻疹毒株,病毒滴度达106.875TCID50/mL。目前,动物细胞悬浮培养工艺最大培养体积已达25 000 L 规模,贴壁依赖型细胞的微载体培养规模也达6 000 L 以上,且还在不断扩大和优化。在普通的悬浮培养系统中通过微载体基质可实现每毫升数百万个细胞的产量,以葡聚糖为基质微载体细胞培养工艺已应用于肠道病毒71型(enterovirus type 71 vaccine,EV71)疫苗、流感疫苗、脊髓灰质炎疫苗、乙型脑炎病毒疫苗、出血热疫苗、狂犬病疫苗等多种病毒疫苗的生产[20-25]。
以葡聚糖为基质的微载体溶胀后与生物反应器内壁具有较强的黏附性,进行大规模微载体细胞培养后,不易将细胞从微载体上有效地消化分离,难以实现细胞高效高产回收,目前生产一般采用传统的胰酶消化进行分离,在小规模培养阶段也可使用葡聚糖酶降解微载体,同样给细胞回收带来较大浪费,给工艺放大带来一些技术障碍,增加了生产成本和工艺的复杂性,影响了微载体培养技术工艺的自动化水平,这些是亟待解决的工艺难题。
2.2 纤维素基质微载体 纤维素基质微载体由交联纤维素构成,呈多微孔结构,硬度高,惰性生物基质为细胞培养提供了坚固的非刚性微环境[26]。Cytopore系列微载体由纤维素基质构成基本骨架,具有>90%孔隙的多微孔结构,平均孔径约30 μm,溶胀体积相当于40 mL/g。纤维素基质多孔微载体培养细胞具有如下优势:①细胞可轻松、稳定固定于微载体表面和孔内,便于细胞黏附和伸展;②适合贴壁细胞和悬浮细胞的连续培养;③多微孔结构保护细胞免受高剪切力的影响;④细胞不仅可在其表面生长也可生长在载体内部,为细胞提供更充分的生长空间;⑤细胞能在微载体间自动转移,简化了不同批间细胞的传代培养工艺[27]。XIAO等[28]用2.5 g/L的Cytopore微载体在5 L 生物反应器中高密度放大培养重组CHO 细胞系工程株CL-11G 和杂交瘤细胞,总细胞数可达10 × 1010个,由于细胞能自发地从多孔微载体中释放并与之重新结合,较易扩大至20 L 生物反应器培养,用于生产重组人尿型纤溶酶原激活剂。THARMALINGAM 等[29]分别采用悬浮培养和Cytopore 微载体培养CHO 细胞生产重组蛋白,结果表明,与悬浮培养比较,微载体培养可提高β-IFN蛋白和t-PA的产量达2.5倍。FÖLDES等[30]比较了Cytopore 微载体和组织培养板培养干细胞的差异,结果表明,在相同培养时间条件下,微载体培养细胞数量不仅高于组织培养,且干细胞具有良好的形态特征。
纤维素多孔微载体在增加细胞培养表面积的同时,大幅减少了剪切力对细胞的机械损伤,不仅适合贴壁依赖型细胞,也适合悬浮培养细胞,但由于细胞大多生长在孔内,不利于直接对细胞进行在线监测和分析。以纤维素为基质的多孔微载体主要应用于通过培养CHO、BHK、NSO 和杂交瘤细胞生产重组产品和单克隆抗体。
2.3 明胶基质微载体 明胶基质微载体以交联明胶蛋白为基质,主要成分为猪源性明胶或牛源性明胶,具有生物相容性、多微孔、非刚性、无毒性、活性好、易降解、可回收的特点。较大的比表面积能满足哺乳动物细胞的大规模培养,对于贴壁依赖型细胞和悬浮培养细胞均有较好的承载效果[31-32]。目前,以明胶作为基质的市售商品有Cultispher-S微载体、Cultispher-G微载体和可溶性3DTableTrix微载体等,可用于研究和生产实践。LUO等[33]采用明胶基质可溶性3DTableTrix微载体在1 L 摇瓶培养人骨髓间充质干细胞,培养11 d内扩增了近500倍,达(1.05±0.11)×109个,通过溶解微载体收获细胞产物,最终回收率为(98.6±0.1)%,不仅体现了工艺放大潜力,还引入了可溶解微载体,便于细胞和载体分离,简化了细胞分离和传代培养工艺,具有良好的应用前景。有研究采用6 g/L的3DTable-Trix微载片在4 L 生物培养体系中连续培养Vero 细胞1周,即可获得较高密度的细胞(1×107个/mL)[32]。常彬等[34]采用Cultispher-G 微载体扩增兔软骨细胞,发现软骨细胞可在短时间内黏附于微载体表面并大量扩增,将负载软骨细胞的Cultispher 微载体与纤维蛋白胶直接复合用于修复兔膝关节软骨缺损,使组织工程软骨构建物具有更高质量。
基于明胶基质的大孔球状微载体具有多孔性特点,比实心球状微载体增加了培养表面积,下游通过温和降解微载体细胞基本可以完全回收。明胶基质为动物源性,可较真实地还原细胞的黏附生长,但引入了外源成分,对检定提出更严格的要求,尽管如此,以明胶为基质的微载体仍有望扩展细胞培养种类和应用领域。
2.4 聚苯乙烯微载体 聚苯乙烯微载体制备方法一般可分为两大类:一类是以苯乙烯单体经自由基加聚反应合成的聚合物,并辅助特殊处理工艺得到大小均一稳定颗粒;另一类是以高聚物为原料,通过化学或物理方式得到聚合物微球,表面覆盖一些蛋白涂层或功能基团。聚苯乙烯微载体是一类高性能无动物来源成分的微载体,具有聚苯乙烯芯材,无需进行溶解或预溶胀操作,只需进行无菌处理即可使用[35-36]。目前,用于研究的有Hillex、Plastic、Plastic Plus、Star-Plus、Biosilon等聚苯乙烯微载体产品[37]。
LOUBIÈRE 等[38]比较了Hillex、Plastic Plus、Star-Plus和Cytodex1 4种不同微载体对(mesenchymal stem cell,MSC)附着效率、细胞扩增性能和细胞分离程度的影响,结果表明,这些载体对MSC具有类似的附着和扩展性能,Hillex、Plastic Plus 和Star-Plus载体上的细胞较Cytodex1 载体更易分离。CETINKAYA 等[39]分别采用PHEMA-PNIPAAm、Biosilon 微载体和Cytodex1 微载体按初始细胞密度1×105个/mL 于24 孔板静态培养FCs,比较3 种微载体培养细胞的黏附、增殖和分化特性,培养5 d后,细胞密度分别为5×105、6.8 × 105、1.4 × 106个/mL,表明FCs 细胞在3 种微载体上均可扩增,但FCs 细胞自身的分化特性效率较低。Star-Plus 微载体已确定可用于培养CEF、ST、BT、P4RSF、MRC-5、KB、HFF、CHO、MDCK细胞,Plastic/Plastic Plus 微载体可用于培养Vero、ST、BT、P4RSF、MRC-5、KB、HFF、UMSCC、MDBK、CHO、MDCK、hMSC,SoloHill®微载体系列产品可用于人类和动物生物制品的商业化生产[40]。在易于扩展的基于生物反应器的培养系统中,聚苯乙烯基质微载体在不影响细胞收获效率的情况下可提高细胞附着和吸附性能,显著促进贴壁依赖型细胞生长。
2.5 聚乙烯基质微载体 聚乙烯是乙烯单体进行聚合反应所得到的产物,具有良好的理化性质,应用范围广泛。聚乙烯基质微载体由高密度聚乙烯聚合而成,目前,用于细胞培养的商业化产品有Cytoline 系列大孔微载体,Cytoline 主要组成部分是硅土和高密度聚乙烯。硅土经处理携带负电荷,于聚乙烯整合形成带负电荷的扁形大孔微载体。这种微载体同时具备聚乙烯特有的疏水性和硅土的亲水性特点,在使用前一般需要用0.1 mol/L NaOH 溶液进行修饰和优化表面特征[41-42]。
KONG等[43]采用Cytoline微载体于2 L流化床生物反应器中培养CHO 细胞,结果显示,细胞增长效率提高了约5.5 倍,表明多孔微载体表面积增加和细胞密切接触的优点可大幅提高细胞数量和生产效率。AYYILDIZ-TAMIS等[44]对Biosilon、Microhex、Cytodex 3、Cytoline 4 种微载体培养CHO 和Ag8 细胞效果进行比较,结果表明,培养12 d,细胞在微载体上均可实现有效增殖,Cytodex 3 和Cytoline 2 微载体在CHO-K1和Ag8 细胞的大规模培养中显示出良好的规模化培养潜力,表明Cytoline 通过其大孔结构可促进细胞高效黏附和规模化培养。以聚乙烯为基质的微载体(如Cytoline)在流化床灌注培养CHO 细胞应用较多,也可用于培养贴壁和半贴壁细胞,生产单克隆抗体和重组蛋白等生物制品。
2.6 聚半乳糖醛酸基质微载体 聚半乳糖醛酸微载体属于一类新型可溶性微载体,由聚半乳糖醛酸通过Ca2+交联形成多聚半乳糖醛酸聚合物,即水凝胶微载体。目前,用于细胞培养的商业化产品是Corning®新型可溶性微载体,包括两类产品,一类是在载体表面包被变性胶原,另一类是在载体表面包被Corning®Synthemax™。可溶性微载体的降解可通过添加乙二胺四乙酸(ethylene diamine tetraacetic acid,EDTA)(螯合钙离子使聚合物交联不稳定)、果胶酶(降解聚半乳糖醛酸聚合物)和细胞消化蛋白酶(分解细胞和细胞外基质)进行,在0.5 h内完全溶解。
WEBER等[45]采用2 g/L的Corning®微载体在5 L生物反应器中放大培养hMSC,培养4 d后,进行溶解微载体及细胞回收,结果显示,细胞数较初始细胞密度扩增了近7 倍,回收效率为96%,细胞活性和状态均可与种子细胞相当。SCIBEK等[46]采用Corning®SynthemaxTM微载体培养hMSC,共培养7 d,每2~3 d更新1/2营养液,培养至第5天,细胞数达25 000个/cm2,扩增近4倍,培养至第7天,细胞数达40 000个/cm2以上,扩增近7倍,回收效率>90%。
以Corning®可溶性微载体为代表的聚半乳糖醛酸基质载体具有可溶解性,较易将细胞与微载体分离,高透明度,可清晰观察细胞形态,无热原预包被,可增强细胞贴壁能力,为多种细胞大规模扩展和收获提供了新的解决方案。与多数传统微载体比较,聚半乳糖醛酸基质的微载体简化了细胞收获、分离和浓缩过程,适用于细胞治疗、疫苗生产、大规模贴壁细胞扩大培养和储存,是值得研究和开发的新型微载体培养工艺[47-48]。
2.7 聚丙烯基质微载体 聚丙烯是通过丙烯单体聚合形成的聚合物,聚丙烯基质微载体由带聚丙烯支架的聚酯网构成基本骨架,与聚酯无纺纤维素经高温强力压缩制成,结构牢固,外观以片状结构为主,便于发挥固定和支撑作用,在固定床式生物反应器中应用较多。目前,用于细胞培养的商业化产品有Eppendorf 公司的Fibra-Cel 片状载体。
MEUWLY 等[49]采用Fibra-Cel 片状载体在填充床生物反应器中通过灌注模式高密度培养CHO 细胞,经优化填充床的高度,将细胞接种密度由初始6.1×107个/mL提高至1.2×108个/mL,生产效率提高约2 倍。有研究在制备临床级第3 代慢病毒实验中,成功地将Fibra-Cel 片状载体作为HEK293T 细胞大规模黏附贴壁培养的基质,使病毒抗原和滴度最优化[50]。ZHANG 等[51]比较了Cytodex1与Fibra-Cel微载体在7.5 L生物反应器中培养MDCK-G1 细胞的效果,最高细胞密度分别达(5.03±0.12)×106和(1.02±0.69)×107个/mL,Fibra-Cel微载体优于Cytodex1的培养效果,但不易放大。
Fibra-Cel 能维持细胞长时期的高密度生长灌流培养,避免堵塞风险,减少细胞从最终产物中过滤,广泛应用于培养杂交瘤(DA4-4、123A、127A、GAMMA、67-9-B等),还可用于大规模培养3T3、COS、人骨肉瘤细胞、MRC-5、BHK、VERO、CHO、rCHO-tPA、rCHO-乙型肝炎表面抗原、HEK293、rHEK293、rC127-乙型肝炎表面抗原、正常人成纤维细胞、间质细胞、肝细胞及一些昆虫细胞(Tn-368、SF9、rSF9、Hi-5等)。聚丙烯作为一种固体微载体支持基质,供哺乳动物及昆虫细胞生长,主要用于分泌产物(如重组蛋白及病毒)等的研究。
2.8 聚酯纤维基质微载体 聚酯纤维微载体一般呈菱形或片状扇叶型结构,由高纯度聚酯纤维经高温压制而成,电镜下观察类似于树枝分叉构象。片状载体具有多层张力结构,搅拌剪切力和通气产生的气泡对细胞生长不产生影响,细胞生长类似于转瓶的静止状态,可保证培养基和细胞充分接触,培养过程简单,易于控制,是专门用于哺乳动物细胞贴壁培养的载体,高效的比表面积可为细胞的生长提供充足的表面积,让细胞在一个立体空间中温和生长传代,同时维持各种营养物质的良好交换,降低有害代谢产物的积累,实现细胞高密度培养[52]。上海楚鲲生物科技有限公司的DISKS 片状载体和天信和(苏州)生物科技有限公司的Cellcomb片状载体均是以聚酯纤维为基质,已应用于临床研究中规模化细胞培养上游工艺。DISKS和Cellcomb片状载体可用于培养VERO、CHO、BHK、MDCK、ST、MARC-145、MRC-5、SF9、HEK293、123A、127A、GAMMA及原代细胞等。
3 新型和传统微载体细胞培养技术的比较
近年,可溶性多孔微载体、水凝胶微载体、藻酸盐微载体、大孔肝素微载体、透明微载体、片状微载体、3D 大孔微载体等多种新型微载体产品呈现快速发展的特点,且研究方向广阔[53-56]。
可溶性多孔微载体常用于工业化培养hMSC,不仅保持了其免疫表型特征、三系分化潜能和基因组稳定性,还使细胞具有低衰老表型迹象。可溶性多孔微载体消除了传统微载体所需的繁琐准备工作,其可溶解性使细胞回收率达到较高水平[约(98.6±0.1)%],显示了其在工业化生产MSC 方面的巨大潜力[53]。多孔藻酸盐微载体(porous alginate sphere microcarriers,PABs)引入了含有细胞/葡聚糖混合物和藻酸盐(alginate,Alg)/聚乙二醇(polyethylene glycol,PEG)混合物,并由甲氧基聚乙二醇-牛血清白蛋白(methoxy-polyethylene glycol bovine serum albumin,MPEG-BSA)颗粒稳定的双水相(aqueous two-phase system,ATPS)乳液构成。通过改变ATPS 乳液与PEG-Alg 溶液的乳化频率和体积分数,可控制PABs的孔径大小。由于ATPS具有良好的生物相容性,细胞可直接包裹在相互连接的孔隙中。与传统的Alg包裹的细胞比较,PABs 包裹的HeLa 细胞和人肝癌细胞具有更强的细胞活性和增殖功能。PABs 被认为是一种较有应用前景的体外3D 细胞培养微载体,其基于聚合物/环糊精(cyclodextrins,CD)超分子体系的纳米微载体广泛应用于生物医学领域,如疏水脂肪族聚酯,其具有生物降解性,以聚乳酸和聚己内酯为代表[57-62]。由聚异丙基丙烯酰胺(polyisopropylacrylamide,PNIPAM)、聚乙二醇双丙烯酸酯(polyethylene glycol diacrylate,PEGDA)和明胶甲基丙烯酰(gelatin methacryloyl,GelMA)组成的互穿水凝胶网络制成的多功能温度响应微载体,通过采用流聚焦微流控芯片可制备粒径在100~300 μm范围内、粒径分布均匀(多分散度指数≈0.08)的微载体,可通过改变组合物-水凝胶组合物来调整多功能温度响应性微载体Cytogel的力学性能和细胞黏附性能,表明微载体具有将生长因子局部传递至细胞表面方面的潜在用途[63]。
传统微载体一般以固相化介质为细胞生长提供稳定支撑,仅用于满足细胞大规模培养,但培养下游细胞与微载体不易分离,对细胞产品的回收存在浪费,这是微载体细胞培养工艺普遍需要解决的问题,也是新型微载体开发的方向[64]。与传统微载体比较,新型微载体既满足细胞高效贴附生长,使细胞具有更强细胞活性,又能简化细胞分离工艺,为下游细胞产品收获提供极高的回收率,达到提质增效,降低生产成本,减少细胞污染的效果[65]。
4 小结与展望
微载体细胞培养工艺是最具前景的动物细胞大规模培养工艺开发方向之一,已有多项研究探讨改善微载体细胞培养过程中的细胞附着和分离,增强细胞的附着性,识别影响微载体表面特性的因素,在微载体上引入各种表面涂层及优化操作参数等问题[66-68]。
可溶性、大孔性、球形或片状、易溶解或易降解的微载体研究开发可能是今后微载体发展的方向,需要解决的问题是如何创造一个仿生微环境以满足细胞在微孔间高效黏附、优良生长和下游细胞的分离回收。持续改进基于微载体的细胞培养放大工艺仍是科研工作者普遍关心的课题。随着生物新材料的兴起和快速发展,微载体细胞培养技术得到深入研究,有望进一步拓宽其应用领域。
