重组抗前蛋白转化酶枯草杆菌蛋白酶9单克隆抗体质控方法的建立
2024-01-02武刚于传飞俞小娟李萌杨雅岚崔永霏郭璐韵王兰
武刚,于传飞,俞小娟,李萌,杨雅岚,崔永霏,郭璐韵,王兰
中国食品药品检定研究院单克隆抗体产品室卫生部生物技术产品检定方法及其标准化重点实验室国家药监局生物制品质量研究与评价重点实验室,北京 102629
心血管疾病(cardiovascular disease,CVD)是人类死亡的最主要原因之一,我国的CVD患病率呈逐年上升趋势[1-3]。高胆固醇血症是与动脉粥样硬化性CVD 发展相关的明确危险因素[4-6]。前蛋白转化酶枯草杆菌蛋白酶9(proprotein convertase subtilisin/Kexin 9,PCSK9)已被确定为CVD的重要治疗靶点[7-8]。PCSK9 主要由肝脏分泌,并在细胞外与低密度脂蛋白受体(low-density lipoprotein receptor,LDLR)结合,内化后与LDLR 结合的PCSK9 将其靶向于溶酶体降解,阻止LDLR 在细胞表面再循环,导致低密度脂蛋白胆固醇(low-density lipoprotein-cholesterol,LDL-C)血浆水平升高[9-10]。高胆固醇血症患者长期暴露于高水平LDL-C 环境下,显著增加了CVD 风险[11]。他汀类药物可有效降低血浆LDL-C,使LDL-C 血浆浓度降低65%[12-14]。但对于他汀类药物不耐受的患者(或不能耐受足以将LDL-C 降低至推荐目标水平的剂量)限制了这些药物的使用[15-16]。另外,他汀类药物产生的耐药性也影响了该类药物的功效[17]。对不宜使用他汀类药物的患者,PCSK9 单克隆抗体可作为一种有效降低LDL-C 的靶向药物,其安全性和有效性均已得到了广泛证实[18-21]。2015 年,美国Amgen公司研发的Evolocumab、美国Sanofi 公司与Regeneron 公司联合研发的Alirocumab 分别获得美国食品药品管理局批准上市。以上两款药物也于2018及2019 年先后在中国获批上市,其中Alirocumab 被列入《国家医保目录(2021 年)》中。本研究采用的PCSK9单克隆抗体是由CHO细胞表达,经细胞培养、纯化制备获得,是一种新靶点IgG1 型抗体。为对PCSK9 单克隆抗体进行有效质量控制,确保其用药安全、有效,根据《中国药典》三部(2020版)及人用药品注册技术要求国际协调会(International Council for Harmonisation of Technical Requirements for Pharmaceuticals for Human Use,ICH)Q6B等相关要求[22-23],本研究对PCSK9单克隆抗体的肽指纹图谱、抗体特异性、电荷变异体、变异体纯度、单体、高分子量和低分子量物质含量、生物学活性、N糖含量、聚山梨酯20含量等关键质量属性进行检测,以期建立该产品的指控方法。
1 材料与方法
1.1 样品 PCSK9 单克隆抗体参比品及样品均由中国食品药品检定研究院单克隆抗体产品室保存。
1.2 细胞 HepG2 细胞由中国食品药品检定研究院单克隆抗体产品室保存。
1.3 主要试剂及仪器 胰酶、TCEP·HCl、37%甲醛、碘乙酰胺及盐酸胍均购自美国Sigma 公司;HRP 标记的山羊抗c-Myc IgG 购自美国Abcam 公司;TMB底物显色液购自美国BD Fisher 公司;聚山梨酯20标准品购自美国J.T.Baker 公司;PNGase F 酶购自美国NEB 公司;胎牛血清(fetal bovine serum,FBS)、无血清DMEM 培养液、胰酶-EDTA、MEM 非必须氨基酸溶液(non-essential amino acids,NEAA)均购自美国Gibco 公司;BODIPY 标记的LDL 购自美国Life Technologies 公司;PCSK9-Myc 蛋白、PCSK9 蛋白、成像毛细管等电聚焦电泳[imaging capillary isoelectric focusing,icIEF)系统适用性对照品(330002)及十二烷基硫酸钠毛细管凝胶电泳(capillary electrophoresis-sodium dodecyl sulfonate,CE-SDS(330008)]系统适用性对照品均购自中国食品药品检定研究院;载体两性电解质Pharmalyte 3-10及Pharmalyte 8-10.5、G25蛋白质脱盐柱均购自美国GE Healthcare 公司;等电点(pI)marker 5.12 和9.50、iCE3 试剂盒、成像毛细管等电聚焦电泳系统iCE3 均购自美国ProteinSimple 公司;无脂蛋白人血清(lipoprotein deficient serum,LPDS)及30 kD 超滤管均购自美国Millipure 公司;含钙离子、镁离子的磷酸盐缓冲液(CMPBS)及液相检测系统U3000(CAD 检测器)均购自美国Thermo 公司;其他试剂均为分析纯;毛细管电泳系统PA800 plus(PDA检测器)及Beckman毛细管(50 μm×31 cm,21 cm)均购自美国Beckman 公司;分子筛色谱柱TosohTSKGEL BioAssist G3SWXL(7.8 mm ×300 mm,5 μm)购自日本TSKgel公司;Waters ACQUITY UPLC系统(荧光检测器)、肽图色谱柱Waters ACQUITY UPLC BEH130 C18(2.1 mm×100 mm,1.7 μm)、聚山梨酯色谱柱Waters Oasis MAX Cartridge Column(2.1 mm×20 mm,30 μm)、Oasis HLB滤芯及Waters 2695 HPLC系统(TUV检测器)均购自美国Waters公司;糖型色谱柱Kinetex Minibore C18 HPLC(150 mm×2.1 mm,2.6 μm)购自美国Kinetex公司。
1.4 一致性鉴别 采用还原胰蛋白酶肽指纹图谱法。取PCSK9 单克隆抗体参比品及样品各100 μg,分别加入8 mol/L盐酸胍溶液(终浓度5 mol/L)、Tris HCl(pH 7.5)溶液(终浓度100 mmol/L)、TCEP·HCl溶液(终浓度12 mmol/L),混匀,37 ℃孵育30 min;加入碘乙酰胺溶液(终浓度40 mmol/L),室温避光孵育30 min;用G25 蛋白质脱盐柱进行脱盐,收集样品,加入175 μL无菌水、25 μL 1 mol/L Tris HCl(pH 7.5)溶液,混匀,加入5 μL胰酶(1 mg/mL),混合,瞬时离心5 s,置37 ℃振摇(300 r/min)孵育1 h;冷却至室温,加入5 μL 10%三氟乙酸(trifluoroacetic acid,TFA)溶液,混匀。采用Waters ACQUITY UPLC 系统及肽图色谱柱Waters ACQUITYUPLCBEH130C18(2.1mm×100mm,1.7μm)进行反相超高效液相色谱(reversed phaseultra ultra-high performance liquid chromatography,RPUPLC)检测。检测条件:流动相A为0.05%的TFA溶液,流动相B 为0.045%的TFA 乙腈溶液,梯度洗脱(0~5 min,2%流动相B;5~70.5 min,2%→37%流动相B;70.5 ~ 71 min,37% →95%流动相B;71 ~78.5 min,95%→95%流动相B;78.5~79 min,95%→2%流动相B;79~105 min,2%→2%流动相B),流速0.2 mL/min,上样体积10 μL,样品室温度5 ℃,柱温60 ℃,检测波长215 nm,检测时间120 min。
1.5 抗体特异性鉴别 采用ELISA法。用1×PBS将PCSK9单克隆抗体样品及参比品分别稀释至1 μg/mL及400 ng/mL,加入96孔板,100 μL/孔,每个样品设3个复孔,以1×PBS为空白对照孔,2 ~8 ℃包被过夜;洗涤液(含0.05%Tween 20的PBS)洗涤5次,加入封闭液(含1%BSA 的1×PBS),300 μL/孔,室温封闭1 h;用封闭液将PCSK9-Myc蛋白稀释至1 μg/mL,加入96孔板,100 μL/孔,室温振荡孵育2 h;洗涤液洗涤5次,加入HRP标记的山羊抗c-Myc IgG(1 μg/mL),100 μL/孔,室温振荡孵育2 h;洗涤液洗涤5次,加入TMB底物显色液,100 μL/孔,室温避光显色10 min;加入终止液1 mol/L H2SO4,100 μL/孔,终止显色反应,用酶标仪检测A450。平行测定6次,计算相对标准偏差(RSD)。A450样品均值-A450空白均值应>A450参比品均值-A450空白均值,A450参比品均值-A450空白均值应≥0.25。
1.6 电荷变异体分析
1.6.1 系统适用性检测 采用icIEF 系统适用性对照品作为系统适用性考察样品[24],按照《中国药典》三部(2020 版)通则3129 进行系统适用性检测[22]。主峰pI标准偏差(SD)应≤0.10;主峰含量应在(70.8±4.8)%范围内,SD应≤4.8%,RSD应≤6.7%。
1.6.2 样品检测 取50 μL 8 mol/L尿素溶液,与70 μL 1%甲基纤维素、1 μL pI marker 5.12、1 μL pI marker 9.50、8 μL 的Pharmalytes 3-10 混合,制备为预混液。用超纯水将PCSK9单克隆抗体参比品或样品稀释至2 mg/mL,取40 μL,与160 μL预混液混合。进行icIEF分析,分析条件为:第1 聚焦期,电压1.5 kV,聚焦1 min;第2聚焦期,电压3 kV,聚焦7 min。计算酸性峰区、主峰区、碱性峰区的相对百分含量。平行测定6次,计算RSD。
1.7 变异体纯度分析
1.7.1 系统适用性检测 采用CE-SDS 系统适用性对照品作为系统适用性考察样品,按照《中国药典》三部(2020 版)通则3127 进行系统适用性检测[22]。非还原主峰应在92.19%~94.77%范围内,还原非糖基化重链应在0.93%~1.66%范围内。
1.7.2 样品检测 用超纯水将PCSK9单克隆抗体样品稀释至10 mg/mL,取30 μL,加入5倍稀释的巯基乙醇5 μL和SDS样品缓冲液161 μL(还原)或0.125 mol/L N-乙基马来酰亚胺10 μL 和SDS 样品缓冲液156 μL(非还原),混匀,于70 ℃水浴5 min;取80 μL,置进样瓶中上机分析。采用毛细管电泳系统PA800 plus 及Beckman 毛细管(50 μm × 31 cm,21 cm)进行检测。检测条件为:分离电压15 kV,毛细管温度25 ℃,样品室温度25 ℃,检测波长220 nm。计算样品“轻链+重链”峰(还原型)、非糖基化重链峰(还原型)、主峰(非还原型)、非糖基化主峰(非还原型)、低分子量物质的相对百分含量。平行测定6次,计算RSD。
1.8 单体、高分子量和低分子量物质含量分析 采用分子排阻高效液相色谱(size-exclusion chromatography high performance liquid chromatography,SEC-HPLC)法。用流动相[将200 mL 50 mol/L磷酸钠缓冲液(pH为6.6 ± 0.1)、140 mL 5 mol/L氯化钠溶液与660 mL超纯水混合,调节pH 至6.1±0.1]将PCSK9 单克隆抗体样品稀释至10 mg/mL。采用Waters 2695 HPLC系统、2489紫外检测器、分子筛色谱柱TosohTSK-GEL G3SWXL(7.8 mm × 300 mm,5 μm)进行检测。检测条件为:流速0.25 mL/min,进样量5 μL,进样器温度4 ℃,柱温为室温,于280 nm 波长处检测。通过面积归一化法计算得出高分子量物质峰、主峰、低分子量物质峰的相对百分含量。平行测定6 次,计算RSD。
1.9 N 糖含量分析 PCSK9 单克隆抗体样品及参比品通过超滤管将缓冲液置换为无菌水。取10 μL 换液后样品及参比品(150 μg),加入20 μL去糖基化缓冲液[将81 μL无菌水、99 μL 1 mol/L Tris-HCl缓冲液(pH 8.0)、99 μL 10% SDS 和21 μL 200 mmol/L TCEP•HCl 混合,现用现配],混匀,80 ℃孵育7 min,平衡至室温;加入5 μL 10% NP-40,涡旋混匀,瞬时离心5 s,加入10 μL PNGase F酶,37 ℃孵育16 ~20 h;加入200 μL衍生溶液(40 mg/mL 的NaBH3CN 溶液与60 mg/mL 的邻氨基苯甲酸溶液等体积分数混合),80 ℃加热1 h;用0.8 mL 95%乙腈溶液稀释每份衍生样品,再经Oasis HLB 滤芯纯化,5%乙腈洗脱,加入800 μL 流动相A(0.05%的TFA溶液)稀释。采用Waters ACQUITY UPLC系统(荧光检测器)、糖型色谱柱Kinetex Minibore C18 HPLC(150 mm×2.1 mm,2.6 μm)进行检测。检测条件:流动相B为0.045%的TFA乙腈溶液,梯度洗脱(0~10 min,6%流动相B;10~40 min,6%→12%流动相B;40~42 min,12%→100%流动相B;41~44 min,100%→6%流动相B;44~60 min,6%流动相B),流速0.2 mL/min,上样体积10 μL,样品室温度5 ℃,柱温25 ℃。检测器参数:激发波长230 nm,发射波长425 nm;PMT 增量1;数据速度1 点/s,检测时间60 min。各糖型含量由荧光图计算获得。平行测定6次,计算RSD。
1.10 相对生物学活性分析 取对数生长期HepG2细胞,0.25%胰酶消化,调整细胞密度为2.5×105个/mL,接种至黑色96 孔板中,80 μL/孔,于37 ℃,5% CO2细胞培养箱中培养16~20 h;加入PCSK9单克隆抗体参比品及样品(1 000 nmol/L起2.5倍系列稀释,共9个稀释度),10 μL/孔,每个浓度设3个复孔;加入PCSK9蛋白(30 nmol/L),10 μL/孔,继续培养4 ~8 h;加入BODIPY 标记的LDL(0.1 mg/mL),10 μL/孔,继续培养18~22 h;用CMPBS洗涤1次,加入3.7%甲醛溶液,200 μL/孔,室温固定至少20 min;CMPBS 洗涤1次,再加入CMPBS,100 μL/孔,用酶标仪进行检测,以490 nm 为激发光波长,520 nm 为发射光波长,读取相对荧光单位(relative fluorescence units,RFU)数值,应用Softmax V5.4分析软件进行4-Parameter拟合,绘制四参数曲线,根据参比品和样品的半数效应浓度(concentration for 50%of maximal effect,EC50),按下式计算相对生物学活性。系统适用性考察要求:低渐近线A 参数比值(A供试品/A参比品)应为0.89~1.12,斜率B参数比值(B供试品/B参比品)应为0.70~1.43,高渐近线D参数比值(D供试品/D参比品)应为0.90~1.11。平行测定6次,计算RSD。

1.1 1 聚山梨酯20 含量分析 用无菌水将聚山梨酯20 标准品分别稀释为0.004%、0.006%、0.007%、0.010%、0.012%、0.014%、0.016%、0.020%(W/V)。采用聚山梨酯20液相检测系统U3000(CAD 检测器)及聚山梨酯色谱柱Waters Oasis MAX Cartridge Column(2.1 mm × 20 mm,30 μm)进行检测。检测条件:流动相A 为2%的甲酸水溶液,流动相B 为2%的甲酸异丙醇溶液,梯度洗脱(0~1 min,10%→20%流动相B;1~3.4 min,20%→20%流动相B;3.4~3.5 min,20%→100%流动相B;3.5~6.9 min,100%→100%流动相B;6.9~7 min,100%→10%流动相B;7~8 min,10%→10%流动相B);流速1.0 mL/min,上样体积50 μL,柱温28 ℃。CAD 参数:氮气36 psi,灵敏度为200 或自动,过滤器为关闭。用聚山梨酯20 标准品浓度和峰面积进行线性拟合,通过样品的峰面积计算其聚山梨酯20 含量。平行测定6 次,计算RSD。
1.1 2 数据采集及分析 应用Chameleon 7 软件进行数据采集、分析及作图。
2 结果
2.1 一致性 PCSK9单克隆抗体样品与参比品比较,互补决定区(complementarity determining region,CDR)特征肽段(P1、P2、P3、P4)保留时间差异均≤0.6 min,样品中色谱峰的相对保留时间、总洗脱概况(峰保留时间、峰型和峰高等)与参比品肽指纹图谱相似,且无其他杂峰,见图1。表明该方法可对PCSK9单克隆抗体进行有效鉴别。
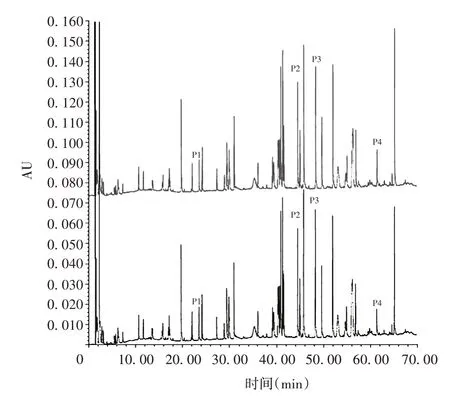
图1 PCSK9 单克隆抗体样品(上图)及参比品(下图)的RP-UPLC图谱Fig. 1 RP-UPLC profiles of PCSK9 monoclonal antibody sample(above)and reference substance(below)
2.2 抗体特异性 经6 次测定,A450参比品均值-A450空白均值=0.44,A450样品均值-A450空白均值=1.52±0.04,RSD为2.63%。表明该方法可用于判定待测样品中特异性PCSK9抗体的存在。
2.3 电荷变异体分析 系统适用性检测结果符合要求。PCSK9单克隆抗体样品有1个主峰区,酸性峰区为pI< 主峰区的所有峰,碱性峰区为pI> 主峰区的所有峰。经6 次测定,样品主峰区、酸性峰区、碱性峰区的峰相对百分含量分别为(49.27 ± 0.38)%、(46.44±0.35)%、(4.28±0.04)%,RSD分别为0.77%、0.75%、0.93%。见图2。表明该方法可用于PCSK9单克隆抗体电荷变异体的质量控制。

图2 PCSK9单克隆抗体样品及参比品的icIEF图谱Fig. 2 icIEF profiles of PCSK9 monoclonal antibody sample and reference substance
2.4 变异体纯度 系统适用性检测结果符合要求。6次还原CE-SDS 测定结果表明,PCSK9 单克隆抗体样品的“重链+轻链”峰、非糖基化重链峰、低分子量物质峰相对百分含量分别为(94.16±0.82)%、(4.11±0.76)%、(0.85±0.20)%,RSD分别为0.87%、18.49%、23.52%。6 次非还原CE-SDS 测定结果表明,样品主峰、非糖基化主峰、低分子量物质峰相对百分含量分别为(94.27±0.22)%、(2.85±0.08)%、(2.88±0.15)%,RSD分别为0.23%、2.81%、5.21%。见图3。表明该方法可用于PCSK9单克隆抗体纯度的质量控制。

图3 PCSK9 单克隆抗体样品的还原(A)和非还原CESDS(B)图谱Fig.3 Reducing(A)and non-reducing(B)CE-SDS profiles of PCSK9 monoclonal antibody sample
2.5 单体、高分子量及低分子量物质含量 经6次测定,PCSK9 单克隆抗体样品中单体主峰、高分子量物质峰、低分子量物质峰相对百分含量分别为(98.30±0.03)%、(0.75±0.01)%、(0.96±0.02)%,RSD分别为0.03%、1.33%、2.08%。见图4。表明该方法可用于PCSK9单克隆抗体单体相对含量的质量控制。
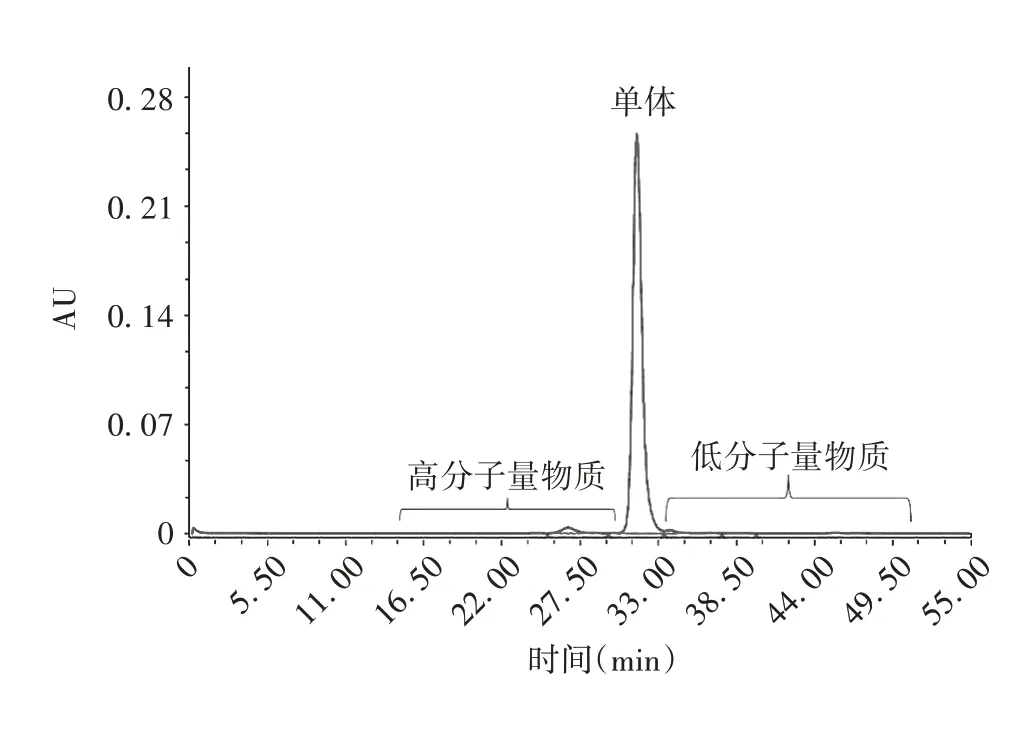
图4 PCSK9单克隆抗体样品的SEC-HPLC图谱Fig. 4 SEC-HPLC profile of PCSK9 monoclonal antibody sample
2.6 N糖含量 经6次测定,G0F、G1F、G2F、非岩藻糖基化糖型(G0+G1+G2+Man5)相对百分含量分别为(39.31±0.54)%、(34.69±0.41)%、(9.09±0.14)%、(12.61±0.50)%,RSD分别为1.37%、1.18%、1.54%、3.97%。见图5。表明该方法可用于PCSK9 单克隆抗体糖型的质量控制。

图5 PCSK9单克隆抗体样品的N糖图谱Fig.5 N-glycan map of PCSK9 monoclonal antibody sample
2.7 相对生物学活性 系统适用性检测结果符合要求。经6 次测定,与参比品比较,PCSK9 单克隆抗体样品相对生物学活性为(101.64 ± 3.61)%,RSD为3.55%,见图6。表明该方法可用于抗PCSK9单克隆抗体相对生物学活性的质量控制。
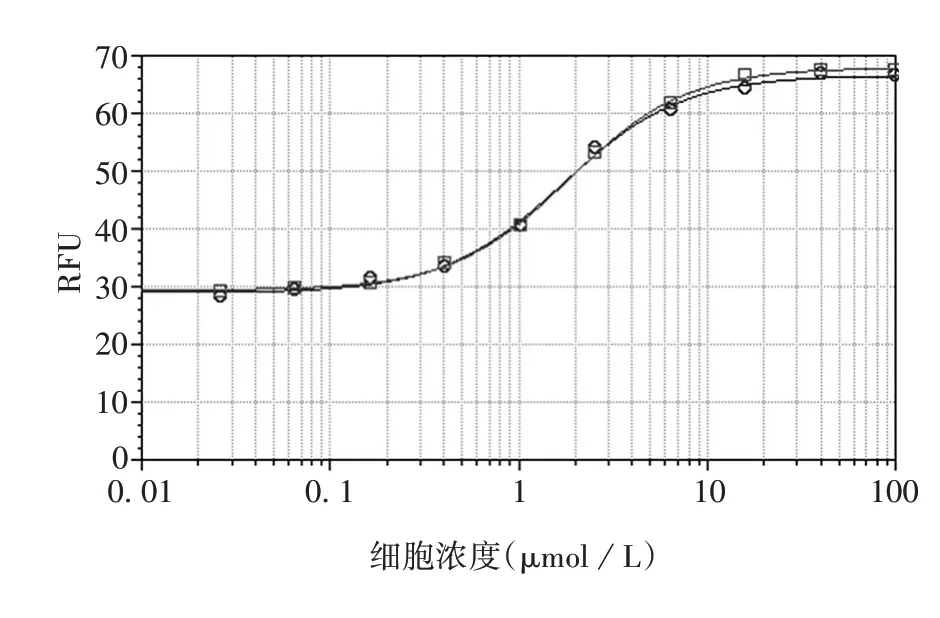
图6 HepG2 细胞法测定PCSK9 单克隆抗体相对生物学活性的剂量-反应曲线Fig.6 Dose-response curves of relative biological potency of PCSK9 monoclonal antibodies detected with HepG2 cells
2.8 聚山梨酯20含量 经6次测定,PCSK9单克隆抗体样品聚山梨酯20 含量为(0.012±0.000 3)%,RSD为2.50%,见图7。表明该方法可用于PCSK9单克隆抗体聚山梨酯20含量的质量控制。
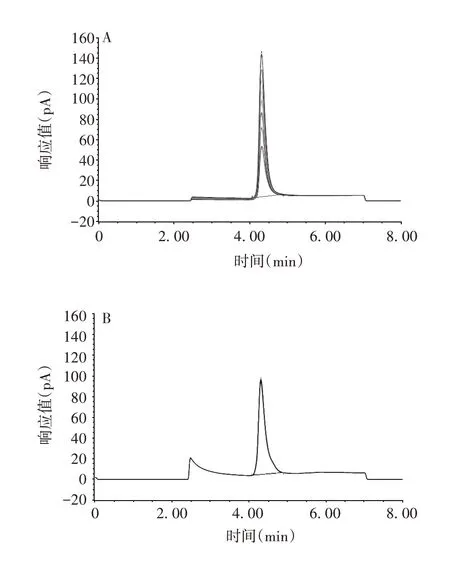
图7 聚山梨酯20含量分析的色谱图Fig.7 Chromatogram for content analysis of polysorbate 20
3 讨论
高胆固醇血症是动脉粥样硬化性CVD最重要的危险因素之一[25],除目前的主要治疗药物他汀类药物外,靶向药物PCSK9 单克隆抗体是降低胆固醇的有效补充疗法。研究表明,长期使用PCSK9 单克隆抗体(如依洛尤单克隆抗体)的严重不良事件、肌肉相关事件、新发糖尿病、出血性中风和神经认知事件的发生率均未超过安慰剂组,且未随时间延长而增加,表明该药物安全性良好[26]。目前,国内已有多家企业正在进行PCSK9 单克隆抗体的研发,质控方法对其研究进展具有重要意义。
本研究建立了PCSK9单克隆抗体的还原肽指纹图谱及ELISA 鉴别方法。将PCSK9 单克隆抗体参比品及样品进行前处理(变性、还原、烷基化、脱盐),再用胰酶酶解,通过RP-UPLC 检测肽指纹图谱。不同单克隆抗体的区别主要存在于CDR 区域,在肽图分析时一般要求对CDR的特征性肽段进行鉴别。结果显示,PCSK9单克隆抗体样品与参比品比较,CDR 特征肽段(P1、P2、P3、P4)保留时间差异均≤0.6 min,样品中色谱峰的相对保留时间、总洗脱概况(峰保留时间、峰型和峰高等)与参比品肽指纹图谱相似,且无其他杂峰。ELISA 鉴别法将PCSK9 单克隆抗体样品包被于96 孔板上,通过特异性带有Myc 标签的PCSK9 抗原作为一抗,HRP 标记的抗Myc 抗体作为二抗,HRP可催化底物显色。结果显示,经6次检测,A450样品均值-A450空白均值=1.52±0.04,RSD为2.63%。上述结果表明,ELSA 法可对PCSK9单克隆抗体进行有效鉴别。
近年,基于毛细管、液相色谱的分析方法由于具有高分辨率、自动化、重复性好的优点,已广泛应用于电荷变异体、变异体纯度的质控中。离子交换色谱是常用的电荷异构体分析方法,但针对不同的单克隆抗体需要不同的条件,而icIEF更易于平台化。本研究建立了用于PCSK9单克隆抗体电荷变异体质控的icIEF法,用于轻重链、非糖基化重链、断裂片段相对含量的还原CE-SDS法,完整抗体、非糖基化主峰、断裂片段相对含量的非还原CE-SDS法,以及单体相对含量的SEC-HPLC法。icIEF法检测结果表明,PCSK9单克隆抗体样品主峰区、酸性峰区、碱性峰区的峰相对百分含量分别为(49.27±0.38)%、(46.44±0.35)%、(4.28±0.04)%,RSD分别为0.77%、0.75%、0.93%。还原CESDS测定结果表明,PCSK9单克隆抗体样品的“重链+轻链”峰、非糖基化重链峰、低分子量物质峰相对百分含量分别为(94.16±0.82)%、(4.11±0.76)%、(0.85±0.20)%,RSD分别为0.87%、18.49%、23.52%。非还原CE-SDS测定结果表明,样品主峰、非糖基化主峰、低分子量物质峰相对百分含量分别为(94.27±0.22)%、(2.85±0.08)%、(2.88±0.15)%,RSD分别为0.23%、2.81%、5.21%。SEC-HPLC 法检测结果表明,PCSK9单克隆抗体样品中单体主峰、高分子量物质峰、低分子量物质峰相对百分含量分别为(98.30±0.03)%、(0.75±0.01)%、(0.96±0.02)%,RSD分别为0.03%、1.33%、2.08%。上述结果表明,icIEF、还原/非还原CE-SDS、SEC-HPLC 法可用于PCSK9 单克隆抗体电荷变异体、纯度、单体相对含量的质量控制。
翻译后的糖基化是单克隆抗体最常见和复杂的修饰之一,主要形式为N-连接糖基化修饰,不同的细胞株生产体系、生产工艺及参数等因素均会影响单克隆抗体上N 糖链的组成。研究表明,糖链在抗体结构和功能方面发挥着重要作用,不同的糖型对抗体功能影响也不同[27-28]。本研究通过荧光检测器确定各主要糖型的比例,建立了N 糖检测的质控方法,结果表明,G0F、G1F、G2F、非岩藻糖基化糖型(G0+G1+G2 + Man5)相对百分含量分别为(39.31 ± 0.54)%、(34.69±0.41)%、(9.09±0.14)%、(12.61±0.50)%,RSD分别为1.37%、1.18%、1.54%、3.97%。表明该方法可用于PCSK9单克隆抗体的N糖谱分析。
当LDL 与LDLR 结合时,两者均内化至细胞内,LDL 将在溶酶体中降解;LDLR 将再循环至细胞表面,继续从循环中去除LDL,肝LDLR 表达增加导致血浆LDL 清除增加。PCSK9 直接与LDLR 的表皮生长因子重复序列A(epidermal growth factor A,EGFA)结合,并将LDLR从核内体转运至溶酶体降解。用荧光染料标记的LDL可用于检测抗PCSK9单克隆抗体的生物学活性。连续稀释的抗体呈依赖性阻断PCSK9 与标记的受体结合,从而调节LDL 摄取速率,荧光表达程度直接与HepG2 中荧光染料标记的LDL量呈正比。本研究基于上述作用机制,通过HepG2细胞系建立了测定PCSK9单克隆抗体的生物学活性的方法,可较好地模拟药物的体内作用,该方法具有检测周期短、结果稳定的特点。检测结果显示,PCSK9单克隆抗体相对生物学活性为(101.64 ± 3.61)%,RSD为3.55%,表明该方法可用于测定抗PCSK 单克隆抗体的相对生物学活性。
综上所述,本研究针对PCSK9 单克隆抗体产品的关键质量属性建立了基于不同原理的质控方法,可用于相关产品的质量评价,以确保产品的安全、有效和质量可控,对我国PCSK9 单克隆抗体药物的研发具有重要意义。
