禾谷镰刀菌醛脱氢酶(ALDH)基因敲除突变体的转录组分析
2024-01-01唐磊翟焕趁葛锦雯张帅兵吕扬勇魏闪马平安胡元森


摘要:【目的】对野生型PH-1菌株和醛脱氢酶(ALDH)基因FGSG_04194敲除突变体(AFg04194)进行转录组测序,分析禾谷镰刀菌ALDH调控菌丝生长和脱氧雪腐镰刀菌烯醇(DON)生成情况,为深入探究禾谷镰刀菌ALDH的生物学功能、DON生成机制及致病机理提供了理论依据。【方法】接种禾谷镰刀菌野生型PH-1、△Fg04194突变体和基因回补突变体(AFg04194-C)菌株至CM培养基和小麦基质中,分析FGSG_04194基因对菌丝生长和DON生成的影响。利用高通量转录组测序技术对野生型PH-1菌株和AFg04194突变菌株在CM培养基中培养72h的菌丝进行转录组测序,对筛选出的差异表达基因(DEGs)进行GO功能注释和KEGG信号通路富集分析,利用实时荧光定量PCR对转录组测序结果进行验证。【结果】AFg04194突变体的菌落直径和生成的DON含量较野生型PH-1和AFg04194-C突变 体菌株显著减少(Plt;0.05,下同)。野生型PH-1和AFg04194突变体转录组原始数据经过滤后获得34.9Gb Clean data,共鉴定出329个DEGs,其中263个基因表达显著上调,66个基因表达显著下调。GO功能注释结果显示,DEGs显著富集在质膜成分、碳水化合物代谢和物质转运过程等条目上。KEGG信号通路富集分析显示,DEGs显著富集在碳水化 合物代谢通路、氨基酸代谢通路、脂质代谢、能量代谢、生物降解代谢通路、细胞生长和死亡相关途径、信号转导途径 等。将FGSG_04194基因调控下有代表性的DEGs分成五大类:几丁质合成相关的基因、跨膜转运蛋白相关的基因、转录因子相关基因、脂质代谢相关基因和能量代谢相关的基因。△Fg04194突变体的ATP含量显著高于野生型PH-1和△Fg04194-C突变体。运用实时荧光定量PCR检测7个DEGs的表达情况,其结果与转录组测序结果基本一致。【结论】FGSG_04194影响禾谷镰刀菌的菌丝生长和DON生成,并在ATP生成中起负调控作用,其机制可能与调控转录因子的 表达、调控脂类代谢、氨基酸代谢和能量代谢等通路有关。
关键词:禾谷镰刀菌;醛脱氢酶;转录组测序;差异表达基因
中图分类号:S432.44;S435.121.4
文章编号:2095-1191(2024)03-0733-12
文献标志码:A
Transcriptome analysis of aldehyde dehydrogenase (ALDH)gene knockout mutant in Fusarium graminearum
TANG Lei, ZHAI Huan-chen*, GE Jin-wen, ZHANG Shuai-bing, LYU Yang-yong,WEI Shan, MA Ping-an, HU Yuan-sen
(College of Biological Engineering, Henan University of Technology, Zhengzhou, Henan 450001, China)
Abstract: 【Objective] The purpose of the study was to perform transcriptome sequencing of wild-type PH-1 strain and aldehyde dehydrogenase (ALDH) gene FGSG_04194 knockout mutant (AFg04194), to analyze the regulation of mycelial growth and deoxynivalenol (DON) production by ALDH in Fusarium graminearum, and to provide a theoreti- cal basis for in-depth study of the biological function of ALDH, DON production mechanism and pathogenesis of F. gra- minearum. 【Method】The wild-type PH-1, AFg04194 mutant and gene complementation mutant (AFg04194-C) strains ofF. graminearum were inoculated into CM medium and wheat grains, respectively. The impact of the FGSG_04194 geneon mycelial growth and DON production was analyzed. By employing high-throughput transcriptome sequencing technology, mycelium from wild-type PH-1 and AFg04194 mutant strains cultured in CM medium for 72 h were conducted to transcriptome sequencing. The screened differentially expressed genes (DEGs) were analyzed through GO functional annotation and KEGG signaling pathway analysis, and the transcriptome sequencing results were confirmed using real-time fluorescence quantitative PCR. 【Result】 In comparison to the wild-type PH-1 and AFg04194-C mutant strains, the AFg04194 mutant exhibited significantly reduced colony diameter and generated DON content (Plt;0.05, the same be- low). The raw data of the wild-type PH-1 and AFg04194 mutant transcriptome were filtered, resulting in 34.9 Gb of Clean data. A total of 329 DEGs were identified, with 263 genes showing significant up-regulation and 66 genes displa- ying significant down-regulation in expression. The GO functional annotation results indicated a significant enrichment of DEGs in categories of plasma membrane components, carbohydrate metabolism and substance transport processes.KEGG metabolic pathway analysis demonstrated a significant enrichment of DEGs in carbohydrate metabolism pathway, amino acid metabolism pathway, lipid metabolism pathway, energy metabolism pathway, biodegradation metabolism pathway, pathways associated with cell growth and death and signaling pathways. Representative and significant DEGs regulated by FGSG_04194 gene were classified into five main groups: genes associated with chitin synthesis, genes associated with transmembrane transporter proteins, genes associated with transcription factors, genes associated with lipid metabolism, and genes associated with energy metabolism. ATP content of the AFg04194 mutant was significantly higher than that of the wild-type PH-1 and AFg04194-C mutants. Expression levels of the 7 DEGs were analyzed using real-time fluorescence quantitative PCR, and the results were generally consistent with the transcriptome sequencing results. [Conclusion 】The FGSG_04194 influences both the mycelial growth and DON production in F. graminearum, and plays a nega- tive regulatory role in ATP production. Its mechanism may be associated with the regulation of transcription factors as well as metabolism pathways such as lipid metabolism, amino acid metabolism and energy metabolism.
Key words: Fusarium graminearum; aldehyde dehydrogenase; transcriptome sequencing; differentially expressed genes
Foundation items: National Natural Science Foundation of China (31972176) ; Natural Scientific Research Innovation Project of Henan University of Technology (2020ZKCJ01); Scientific and Technological Project Entrusted by Enterprises (H2022sw175)
0 引言
【研究意义】禾谷镰刀菌(Fusarium graminearum) 是小麦赤霉病的主要致病菌,不仅导致粮食减产,还 会在谷物及其加工的食品中产生真菌毒素,如脱氧 雪腐镰刀菌烯醇(DON)、玉米赤霉烯酮(ZEA)等,严 重影响粮食和食品品质,危害人或动物的身体健康 (Huet al.,2022)。小麦抗病品种选育是防治赤霉病 最安全、经济、有效的途径之一,但抗病育种漫长且 因菌株的变异而丧失抗病性。目前,小麦赤霉病的 防治措施主要以化学防治为主,但农药的滥用会引 起病原菌耐药性的产生。为有效防控赤霉病的发 生,有必要深入解析病原菌的生长发育、毒素产生和 致病机制。醛脱氢酶(Aldehyde dehydrogenase, ALDH)是一种依赖NAD(P)+的氧化还原酶类,在原核和真核生物中广泛存在(Islam et al.,2022)。研究证明,ALDH在致病真菌稻瘟病菌的生长发育和致病性中起重要作用(Abdul et al.,2018)。因此,基于 转录组学研究禾谷镰刀菌中ALDH编码基因对生长 繁殖和毒素产生的分子调控机制,以期探究禾谷镰 刀菌的致病机制、挖掘新的调控途径和靶点,对防控 小麦赤霉病及其毒素污染、保证粮食和食品安全具 有重大意义。【前人研究进展】ALDH可将脂肪醛或 芳香醛转化成无毒羧酸,从而使机体免受氧化应激(Lo ct al.,2011)。许多ALDH的功能已在细菌、植物、人类、酵母菌和丝状真菌等生物中得到鉴定(Ahmed and Younus,2019)。在铜绿假单胞菌(Pseudomonas aeruginosa)中,抑制ALDH(PaPauC)的活性有助于 对抗病原体的感染,ALDH被认为是一种潜在的药 物靶点(Cardona-Cardona et al.,2021)。在植物中,ALDH与响应逆境胁迫相关,对植物具有保护作用(张乐等,2013)。如拟南芥和水稻中编码ALDH的 基因过量表达均会增强植物的耐旱、耐盐能力,这些 基因的缺失会增强植株对干旱、盐等胁迫的敏感性(Kotchoni et al.,2006;Gao and Han,2009)。人类机 体内存在不同的ALDH家族成员,其中ALDH2是重要组分,缺乏ALDH2的人对乙醇更敏感,ALDH2也 被确定为人类机体内神经保护系统和预防心血管疾 病的关键因素(Alam et al.,2016;Zhang et al.,2023)。ALDH在酵母细胞中也是必不可少的,其使 酵母菌对各种胁迫的耐受性提高,包括高浓度乙醇、 渗透应激和氧化应激等(Aranda and del Olmo,2003)。在丝状真菌中ALDH的相关研究较少。Norvienyeku 等(2017)对稻瘟病菌(Magnaporthe oryzae)中甲基丙二酸半醛脱氢酶基因(MoMSDH)的功能进行研究,结果显示MoMSDH作为代谢开关调控支链氨基酸、肌醇、吡哆醇和AMP/cAMP等代谢物的稳态平 衡,从本质上调控稻瘟病菌的产孢、极性萌发和发病机制。Abdul等(2018)研究发现,稻瘟病菌中2个ALDH家族成员钾离子激活的ALDH(MoKDCDH)和吡咯啉-5-羧酸脱氢酶(MoP5CDH)的失活,导致 分生孢子的产生显著减少,营养生长显著减慢,且破 坏或严重减弱菌株的致病性和细胞膜的完整性,表 明ALDH可通过清除活性氧、脂肪酸自由基和醇衍生物等维持细胞膜的完整性。Diaz-Sánchez等(2016) 研究发现,轮枝镰孢菌(Fusarium verticillioides)中 视黄醛脱氢酶(RALDH)基因CarY的突变导致菌 丝生长、孢子形态改变和有性孢子生成量减少,表明 ALDH在轮枝镰孢菌生长发育中有重要作用。Abdelhakim等(2022)从镰刀菌属菌株RK97-94的 ALDH敲除突变体中分离鉴定出抗疟疾药物亮镰菌 烯的前体G和H,说明ALDH参与亮镰菌烯的生物合成。【本研究切入点】虽然较多研究证实ALDH在 丝状真菌的生长发育和物质代谢调控中发挥重要角 色,但关于丝状真菌禾谷镰刀菌中ALDH功能和调 控分子机制研究较少。本课题组在前期研究禾谷 镰刀菌响应盐胁迫的分子机制时发现,ALDH编码基因(FGSG_04194)在盐胁迫下的表达显著下调(薛 晓雯,2021),但关于该基因的功能及调控作用尚不 明确,目前未见有关禾谷镰刀菌中敲除该基因后突 变体中差异基因表达及细胞代谢变化的研究报道。 【拟解决的关键问题】分析FGSG_04194基因对菌丝生长和DON生成的影响,并对禾谷镰刀菌野生型菌株PH-1和FGSG_04194基因缺失突变体进行转录组测序,分析FGSG_04194基因调控的差异表达基因(DEGs),通过对DEGs进行GO功能注释及KEGG信号通路富集分析,以挖掘FGSG_04194基因调控 生长和产生毒素的关键基因及相关代谢通路,为探究禾谷镰刀菌的致病机理及抗菌药物的靶点提供科 学依据。
1材料与方法
1.1试验材料
禾谷镰刀菌野生型菌株PH-1由福建农林大学王宗华教授惠赠,FGSG_04194基因缺失突变体(AFg04194)和基因回补突变体(AFg04194-C)菌株 由河南工业大学生物工程学院实验室构建并保存。主要试剂:DON酶联免疫吸附试验(ELISA)检测试 剂盒购自北京华安麦科生物技术有限公司;三磷酸 腺苷(ATP)含量检测试剂盒购自北京索莱宝科技有限公司;PrimeScriptTM IⅡ 1st Strand cDNA Synthesis Kit反转录试剂盒和TB Green Premix Ex TaqTM(Tli RNaseH Plus)试剂盒购自日本TaKaRa公司。主要仪器设备:P4单光束紫外可见分光光度计(上海美谱达仪器有限公司);DNM-9606酶标分析仪(北京普朗新技术有限公司);StepOneTM实时荧光定量 PCR系统(美国Applied Biosystems公司)。
1.2菌株培养及DON含量的测定
将野生型PH-1、AFg04194和AFg04194-C菌株的菌丝块接种至CM固体培养基(6g/L酵母提取物、6g/L酪蛋白氨基酸、10g/L蔗糖和20g/L琼脂)上, 28°℃培养72h,观察菌落形态并测量菌落直径,分 析FGSG_04194基因对菌丝生长的影响。取各菌株的4块菌丝分别接种至100g灭菌的小麦籽粒中, 28°℃培养21d,期间定期振荡混匀,每菌株设3个重 复。粉碎培养菌株后的小麦籽粒并称取5g放入50mL离心管中,加入25mL去离子水,涡旋振荡10min;将混合液4000r/min离心5min;取1mL上清液并用 去离子水稀释5倍,振荡混匀(孟瑶等,2019)。按照 DON ELISA检测试剂盒说明测定菌株在小麦籽粒 中生成的DON含量,从而分析FGSG_04194基因对DON毒素生成的影响。
1.3转录组测序样品制备
接种野生型PH-1和AFg04194突变体菌株至
CM液体培养基中,28°C下150r/min摇床培养72h, 无菌水洗涤菌丝3次,用无菌纱布过滤收集菌丝体, 滤纸吸干水分,用液氮快速冷冻处理菌丝,送往上海 派森诺生物科技有限公司进行转录组测序。
1.4文库构建及原始数据处理
首先对野生型PH-1和AFg04194突变体菌株的 菌丝进行总RNA提取,通过Agilent 2100 Bioana- lyzer仪器检测RNA的完整性和浓度;检测合格的 RNA通过Oligo磁珠富集mRNA进行纯化,然后采用金属离子(Mg2+和Zn2+)溶液处理法将mRNA片段化;选择300bp的片段为模板,反转录成cDNA以构 建cDNA文库;PCR扩增富集文库后进行cDNA文 库质检,利用Illumina NovaSeq高通量测序平台对cDNA文库进行双末端测序。对每个样品的原始数据(Raw data)进行数目、大小、Q20等统计,将原始数 据中的测序接头和低于Q20的Reads过滤掉后获得 Clean reads,并将Clean reads与参考基因组(GCF 000240135.3_ASM24013v3_genomic.fna)进行比对 分析,比对到参考基因组上比例高于70%的序列进 行后续分析。
1.5 DEGs分析
将每个基因的Read Count用作该基因的原始表 达量,使用FPKM值对其进行标准化处理,再借助
DESeq分析野生型PH-1和AFg04194突变体的基因表达水平差异分析,以Plt;0.05和log2Fold Change|gt;1为条件筛选出DEGs。利用R包topGO对DEGs进行GO功能注释,筛选出富集度较高的GO条目,从而鉴定出DEGs 的生物学功能(Ashburner et al.,2000)。采用KAAS对DEGs进行KEGG信号通路富集分析(Kanehisa et al.,2004)。
1.6ATP含量测定和及实时荧光定量PCR验证
将野生型PH-1、AFg04194和AFg04194-C菌株分别接种到CM液体培养基中,在28°C,150r/min条件下培养72 h,收集菌丝并用PBS磷酸盐(0.1 mol/L,pH7.4)冲洗,用无菌滤纸压干水分并放入液氮中研磨充分,一部分用于菌丝ATP含量测定,一部分用于RNA提取。称取0.1g样品进行ATP含量测定,样品中加入1mL提取液,涡旋振荡1min,随后4℃,12000r/min离心20min,取上清液置于冰上,按照ATP含量检测试剂盒说明进行ATP含量测定,每菌株设3次重复。采用TRIzol试剂盒进行提取菌丝总RNA, 使用PrimeScriptTM Ⅱ 1st Strand cDNA Synthesis Kit反转录试剂盒合成cDNA第一链(薛晓雯等,2020), -20℃保存备用。每菌株设3个生物学重复。
选取7个DEGs进行实时荧光定量PCR检测,其引物序列如表1所示。以野生型PH-1和AFg04194 突变体的cDNA为模板,使用TB Green®Premix ExTaqTM(Tli RNaseH Plus)试剂盒进行实时荧光定量PCR检测,反应体系10.0 pL:2×TB Green Premix Ex Taq(Tli RNaseH Plus)5.0 uL,10 umol/L上、下游引 物各0.2 μL,ROX0.2μL,50ng/μLcDNA模板1.0μL,无菌水补足至10.0μL。扩增程序:95℃预变性30s;95℃5s,60℃34s,进行40个循环。以β-Tublin作内参基因,使用2-△Aa法计算目的基因的相对表达 量,设3次重复。
1.7统计分析
采用GraphPad Prism 8.0.1计算菌落直径和DON含量的平均值和标准差。采用SPSS Statistics 20的单因素方差分析和最小显著差异法(LSD)进行差异 显著性分析。
2结果与分析
2.1 FGSG_04194基因对菌丝生长和DON生成的 影响
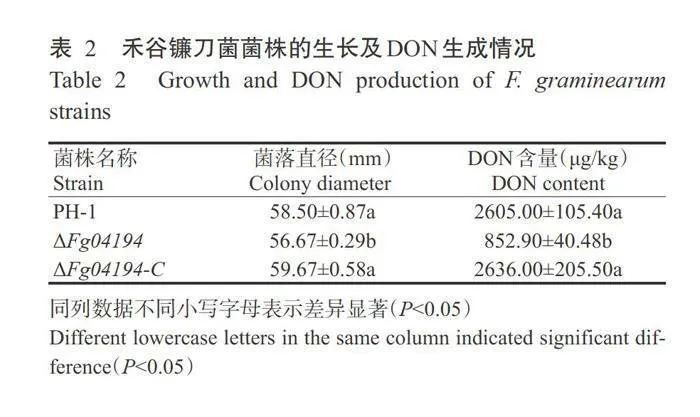
为了明确FGSG_04194基因缺失对菌丝生长的 影响,将野生型PH-1、AFg04194和AFg04194-C突变体菌株接种到CM固体培养基中培养72h,结果如表2所示。AFg04194突变体的菌落直径比野生型PH-1显著减小(Plt;0.05,下同),AFg04194-C突变体菌株与野生型PH-1无显著差异(Pgt;0.05,下同), 表明FGSG_04194基因缺失影响了禾谷镰刀菌菌丝 的生长。分析FGSG_04194基因对DON生成的影响,结果(表2)显示,在小麦基质中AFg04194突变体生成的DON含量较野生型PH-1显著减少,AFg04194-C突变体生成的DON含量与野生型PH-1无显著差异,表明FGSG_04194基因参与调控DON的生成。
2.2原始数据质量评估与比对分析
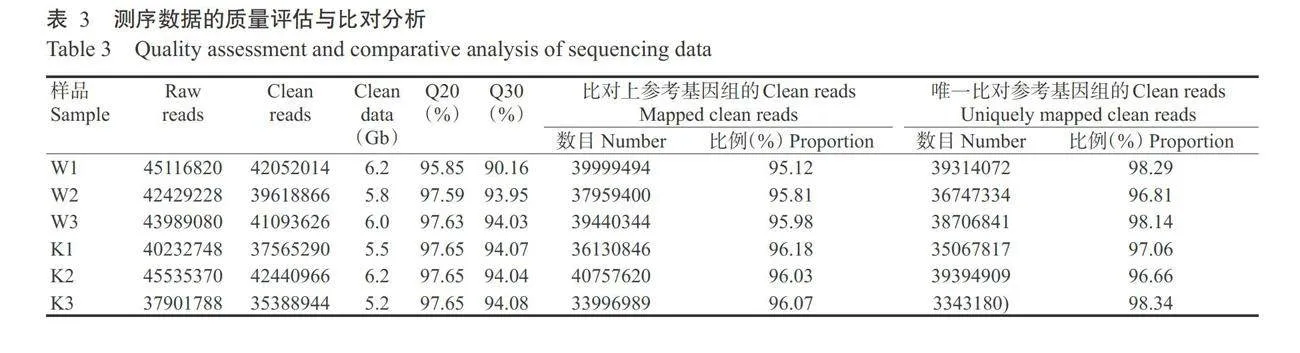
为揭示禾谷镰刀菌FGSG_04194基因的缺失对 突变体中差异基因的表达和代谢水平的影响,明确 ALDH基因调控生长和产毒的分子机制,本研究对野生型菌株PH-1(样品编号W1~W3)和AFg04194突变体菌株(样品编号K1~K3)的6个样品进行了转录组测序,结果如表3所示。6个样品共获得37.4Gb原始数据,数据已上传到NCBI的SRA数据库,登录号为PRJNA1018082。原始数据经过滤后获得34.9Gb Clean data,各样品的平均数据量为5.8 Gb,平均Clean reads有39693284条,测序数据的碱基识别准确率 Q30在90.00%以上。各样品中能比对到参考基因组的Clean reads占比为95.12%~96.18%;唯一比对到参考基因组的Clean reads占比为96.66%~98.34%,表 明参考基因组选择合适,且样品不存在污染,测序的 数据质量和数据量合格,可进行后续数据分析。
2.3 DEGs的筛选结果
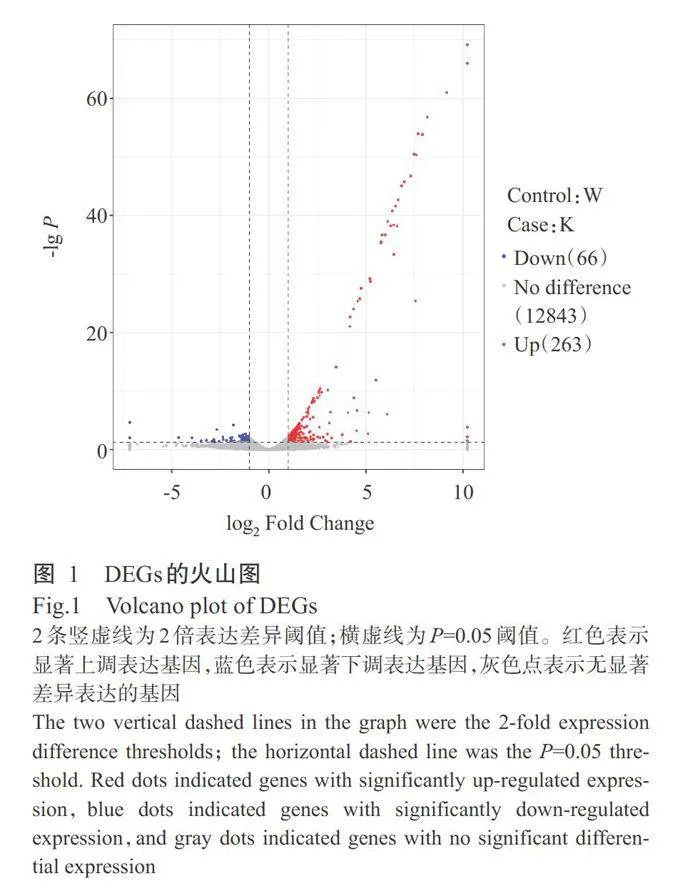
火山图可直观地展示AFg04194突变体菌株和 野生型PH-1菌株间的DEGs分布情况及基因的表达倍数差异和显著性结果,如图1所示。野生型PH-1和AFg04194突变体中共鉴定出329个DEGs,其中 263个基因表达显著上调,66个基因表达显著下调。
2.4DEGs的GO功能注释结果
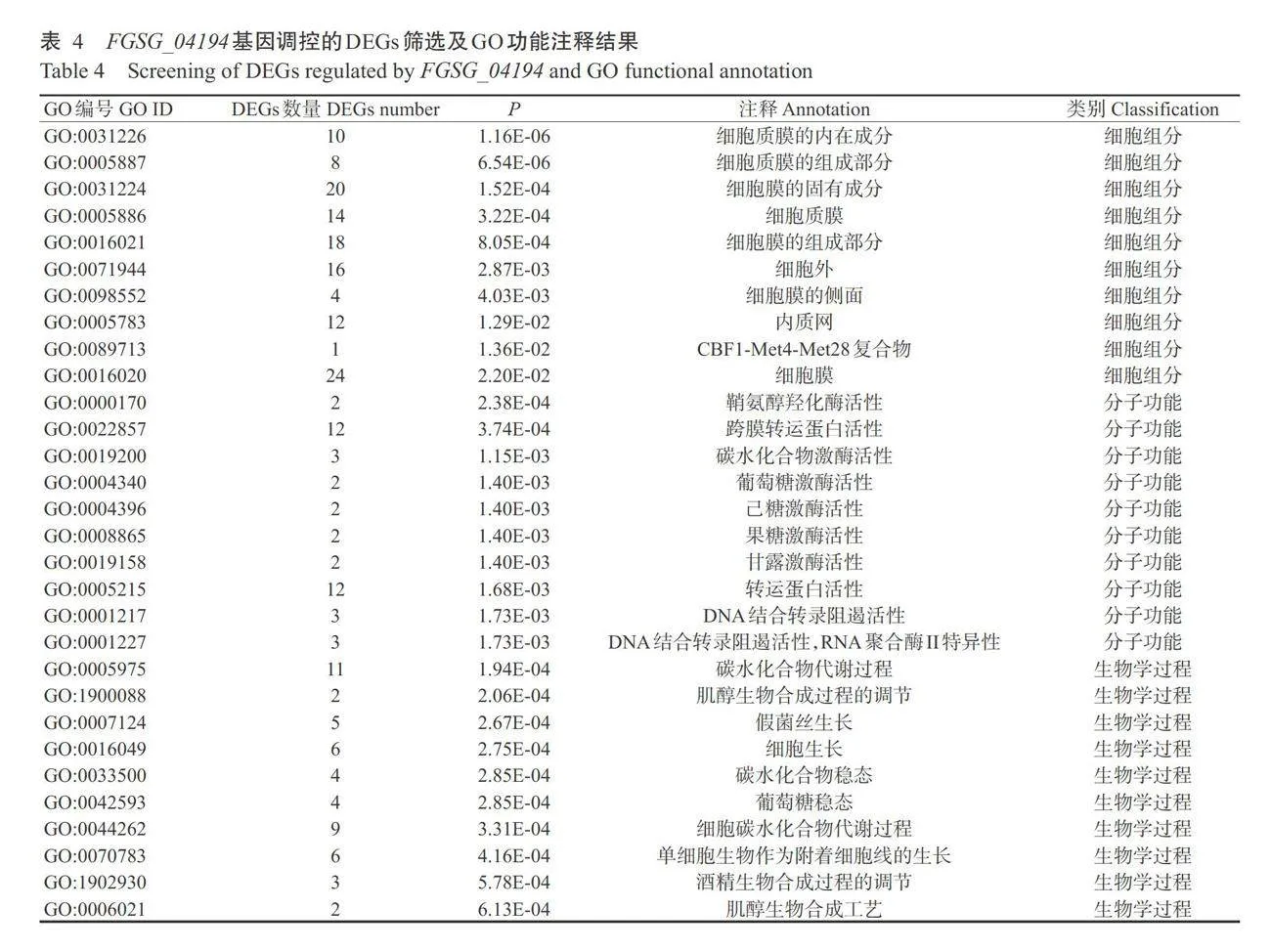
为了解析FGSG_04194基因缺失对禾谷镰镰刀 菌生物功能的影响,对筛选的DEGs进行GO功能注释分析,挑选G0条目中富集显著排名前10名的条目,结果如表4所示。共有39个DEGs显著富集到 细胞组分(Cellular components)、分子功能(Molecu-lar functions)和生物学过程(Biological processes)三 大类。细胞组分类别中,DEGs主要注释为质膜成分 (Plasmalemma component)。分子功能类别中,DEGs 主要注释为鞘氨醇羟化酶(Sphingosine hydroxylase activity)、跨膜转运蛋白活性(Transmembrane trans-porter activity)、碳水化合物激酶活性(Carbohydrate kinase activity)、糖酵解途径中的激酶活性(Kinase activity in the glycolytic pathway)、DNA结合转录阻 遏活性(DNA-binding transcriptional repressive acti- vity)等。生物学过程类别中,DEGs主要注释为碳水 化合物代谢(Carbohydrate metabolic process)、肌醇 生物合成过程的调节(Regulation of inositol biosyn- thetic process)和细胞生长(Cell growth)等。这些结 果表明,FGSG_04194基因通过调控质膜组分、能量 代谢等相关基因的表达进而调节菌丝的生长。
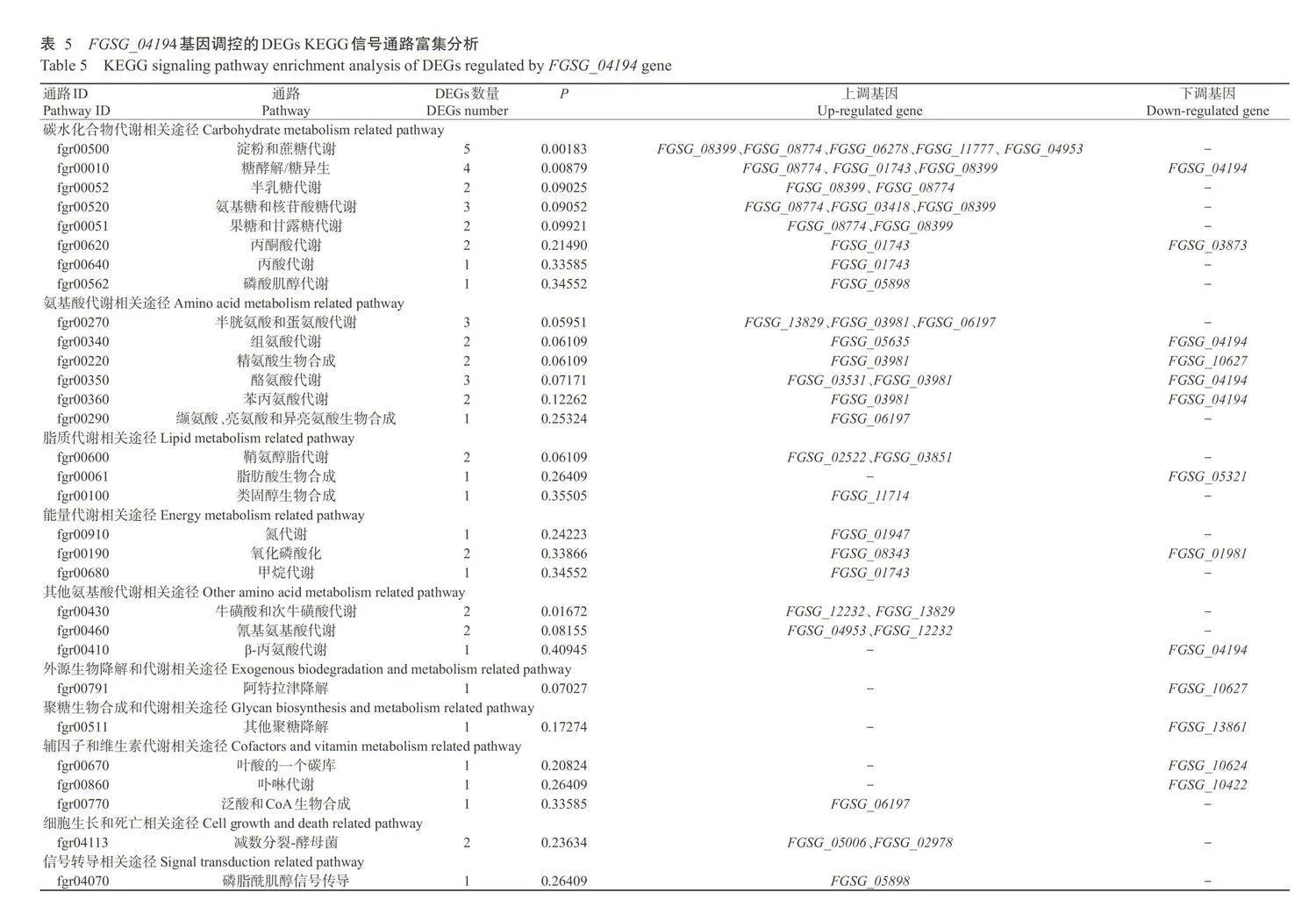
2.5DEGs的KEGG信号通路富集分析结果
将DEGs映射到KEGG数据库中进行信号通路 富集分析,结果显示,34个DEGs被富集到44条不同的KEGG代谢通路中。对富集最显著的前30个信 号通路进行分析,结果如表5所示,这些信号通路被 30个DEGs富集,这些信号通路主要为碳水化合物 代谢通路、氨基酸代谢通路、脂质代谢通路、能量代 谢通路、生物降解代谢通路、细胞生长和死亡相关途 径、信号转导途径等。其中,涉及碳水化合物代谢的通 路包括淀粉和蔗糖代谢(Starch and sucrose metabo- lism)、糖酵解/糖异生(Glycolysis/gluconeogenesis)、半乳糖代谢(Galactose metabolism)、氨基糖和核苷 酸糖代谢(Amino sugar and nucleotide sugar metabo- lism)、柠檬酸循环(TCAcycle)、乙醛酸和二羧酸代 谢(Glyoxylate and dicarboxylate metabolism)等。涉及氨基酸代谢通路包括半胱氨酸和蛋氨酸代谢 (Cysteine and methionine metabolism)、组氨酸代谢(Histidine metabolism)、精氨酸生物合成(Arginine biosynthesis)、酪氨酸代谢(Tyrosine metabolism)、苯 丙氨酸代谢(Phenylalanine metabolism)、缬氨酸、亮 氨酸和异亮氨酸生物合成(Valine,leucine and isoleu- cine biosynthesis)、苯丙氨酸、酪氨酸和色氨酸生物 合成(Phenylalanine,tyrosine and tryptophan biosyn- thesis)等。涉及脂质代谢通路包括鞘氨醇脂代谢 (Sphingolipid metabolism)、脂肪酸生物合成(Fatty acid biosynthesis)和类固醇生物合成(Steroid biosyn- thesis)。涉及能量代谢通路包括氮代谢(Nitrogen metabolism)、氧化磷酸化(Oxidative phosphoryla- tion)和甲烷代谢(Methane metabolism)。FGSG_04194直接参与调控的信号通路有糖酵解/糖异生(Glycolysis/Gluconeogenesis)、组氨酸代谢(Histidine metabolism)、酪氨酸代谢(Tyrosine metabolism)、苯 丙氨酸代谢(Phenylalanine metabolism)和β-丙氨酸 代谢(β-alanine metabolism)。FGSG_04194参与的 糖酵解/糖异生代谢通路如图2所示。FGSG_04194表达下调,FGSG08774(葡萄糖激酶)、FGSG01743(乙酰辅酶A合成酶)和FGSG 08399(己糖激酶1)表达上调。上述结果表明FGSG_04194通过调控能 量代谢、氨基酸代谢等通路的相关基因表达,从而调 节菌丝生长和DON毒素合成。
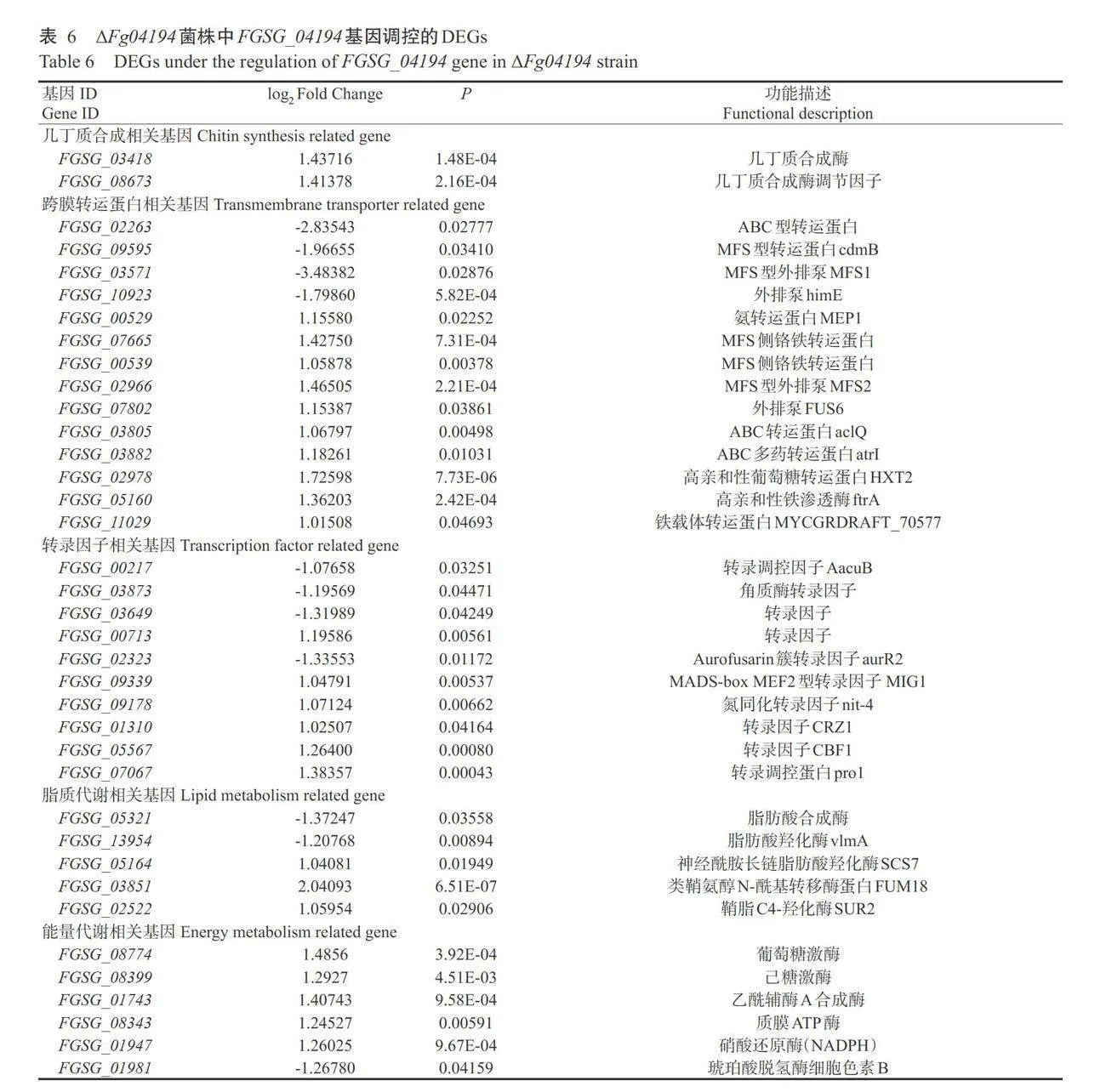
2.6 FGSG_04194基因调控的DEGs筛选
为进一步揭示FGSG_04194基因缺失对禾谷镰 刀菌其他基因表达和代谢水平的影响,结合GO功能注释和KEGG信号通路分析的结果,将FGSG_04194调控下有代表性的DEGs进行分类,结果如表6所示。这些DEGs共分成五大类:几丁质合成相关的 基因、跨膜转运蛋白相关的基因、转录因子相关基 因、脂质代谢相关基因和能量代谢相关的基因。在 AFg04194突变体中,脂肪酸合成酶基因和羟化酶基 因表达下调,几丁质合成酶基因、几丁质合成酶调节因 子基因、跨膜转运蛋白基因、转录因子基因及能量代 谢相关基因上调,表明FGSG_04194基因主要通过调 控转录因子的表达、细胞壁和细胞膜的组成、物质转运和能量代谢平衡影响禾谷镰刀菌生长和DON生成。
2.7 FGSG_04194基因对ATP合成的影响
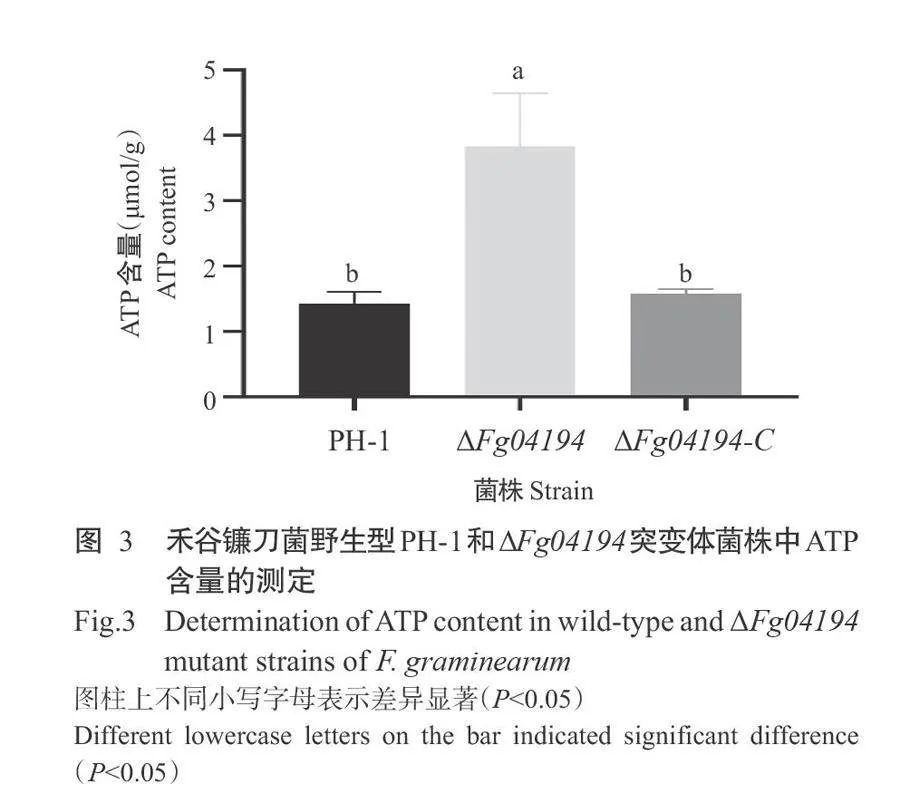
基于GO功能注释和KEGG代谢通路富集分析 结果显示,△Fg04194突变体中能量代谢相关的基因显著上调表达,测定了野生型PH-1、AFg04194和AFg04194-C突变体的ATP含量,结果如图3所示。AFg04194突变体的ATP含量为3.835umol/g,是野生型PH-1的2.7倍,显著高于野生型PH-1和AFg04194-C突变体的ATP含量,与GO功能注释和KEGG代谢通 路富集分析得出的大量与能量代谢相关基因表达上 调结论一致,表明FGSG_04194基因在ATP生成中 发挥负调控作用。
2.8FGSG_04194基因调控菌丝生长和DON生成 模型构建
基于转录组测序结果,本研究构建FGSG_04194基因调控生长和DON生成的模型,如图4所示。FGSG_04194基因一方面通过调控脂质代谢影 响脂肪酸的合成进而使细胞膜的合成受阻,菌丝生 长减慢,另一方面通过调控几丁质酶的表达影响细 胞壁的完整性使禾谷镰刀菌在胁迫时参与菌丝的生长。FGSG_04194基因对DON生成的影响可能是通 过调控ABC转运蛋白和转录因子的表达使DON的转 运和合成受阻。而FGSG_04194基因在能量代谢中 表现出的负调控作用可能是因为FGSG_04194的缺 失激活了其他ALDH活性使ATP产生增多,对于其在 能量代谢方面的作用及其调控机制尚需进一步研究。
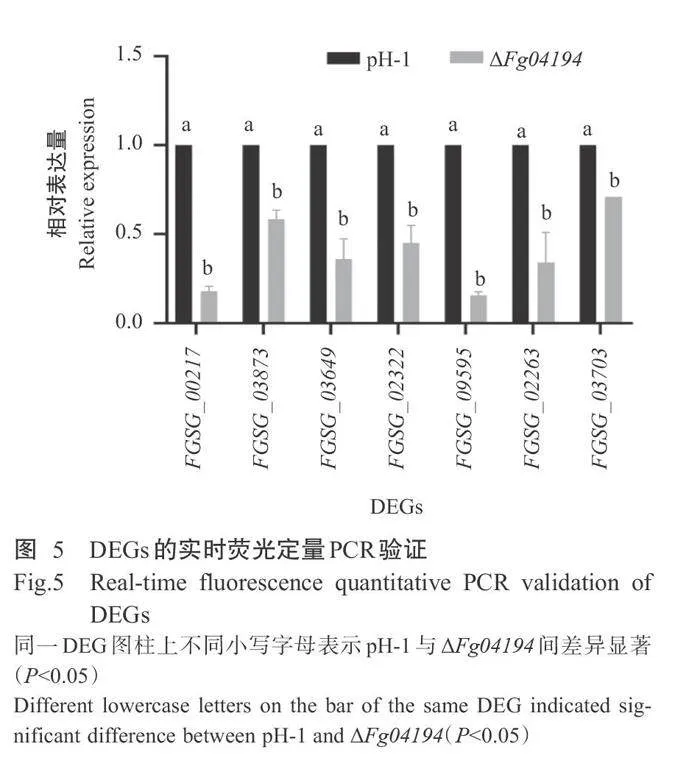
2.9DEGs的实时荧光定量PCR验证结果
为了验证转录组测序结果的可靠性,采用实时 定量PCR检测了DEGs中7个基因的相对表达,其中包括3个转录因子基因(FGSG_00217、FGSG_03873和FGSG_03649)、1个编码黄色镰刀菌素特异性外排泵AurT基因FGSG_02322、1个编码MFS跨膜转运蛋白基因FGSG09595、1个ABC跨膜转运蛋白基因FGSG02263和1个a-葡萄糖苷酶基因FGSG03703。如图5所示,与野生型PH-1相比,这些基因在△Fg04194突变体显著下调表达,与转录组测序结 果一致,证实了转录组测序结果的可靠性。
3讨论
ALDH是生物体中较为常见的氧化还原酶类, 在细菌、植物、人体和真菌中的功能机制已被相继揭示(Wang et al.,2015;Norvienyeku et al.,2017;Guan et al.,2022;Zanoni et al.,2022),但ALDH对禾谷镰 刀菌生长、产毒及次级代谢过程的调控机制尚不清 楚。为明确ALDH编码基因(FGSG_04194)在禾谷镰刀菌生长和DON合成等生物过程中的调控机制, 本研究采用高通量转录组测序技术从△Fg04194突 变体转录组数据中鉴定出329个DEGs,上调基因数目(263个)远多于下调基因(66个),推测FGSG_04194基因在某些生物过程中发挥负调控作用。通过对 DEGs进行GO功能注释分类,结果表明FGSG_04194 基因参与调控跨膜转运、碳水化合物代谢、脂质代 谢、能量代谢及细胞生长等多个生物学过程。
研究发现,稻瘟病菌(M.oryzae))中钾激活ALDH(MoKDCDH)和8-1-吡咯啉-5-羧酸脱氢酶(MoP5CDH)的失活导致分生孢子形成和营养生长的显著减少(Abdul et al.,2018)。本研究也发现,FGSG_04194基因缺失会导致菌丝生长的显著减慢,与Abdul等(2018)的研究结果一致,暗示ALDH在丝状真菌的菌丝生长中发挥重要作用。本研究还发现,AFg04194 突变体菌株中编码几丁质合成酶基因FGSG_03418 和FGSG_08673显著上调表达,有利于几丁质的合 成。几丁质是形成真菌细胞壁的主要成分,在维持 细胞壁完整性和响应各种胁迫中发挥重要调控作用(Lee et al.,2005;Zhang et al.,2016),推测FGSG_04194通过调控几丁质的大量合成来促进生长和增 强对外界胁迫的耐受性。Guo等(2016)研究发现, 转录因子FGSG_00713在禾谷镰刀菌中参与胁迫响 应过程。结合本研究得出的FGSG_00713基因在AFgO4194突变体中显著上调的结果,推测FGSG_04194作为转录因子调控禾谷镰刀菌的胁迫反应。
本研究结果显示,△Fg04194突变体菌株生成的DON含量比野生型菌株PH-1显著下降。编码ABC (ATP-binding cassette transporter)转运蛋白的FGSG 02263和编码MFS(Major facilitator superfamily)蛋 白的FGSG09595、FGSG03571和FGSG10923基因在AFg04194突变体的转录组中显著下调。ABC和MFS转运蛋白是参与物质转运的主要蛋白(Sorbo et al.,2000),参与真菌毒素的外排(Coleman and Mylona-kis,2009)。Qi等(2018)研究表明,禾谷镰刀菌ABC转运蛋白FgABCC9的缺失导致菌丝生长减慢、对杀真菌剂的敏感性降低和DON生成量减少。Chen等(2021)研究也显示,编码MFS蛋白的基因FgMFSI缺失引起禾谷镰刀菌对水杨酸(SA)的敏感性增强和DON生成显著减少。本研究也发现,编码ABC和 MFS转运蛋白的基因在AFg04194突变体中的表达 显著下调,与AFg04194突变体在小麦基质中的DON 含量显著下降呈正相关,推测转运蛋白低表达,导致 DON的转运受阻,说明DON含量可能与转运蛋白 的表达密切相关。还有研究报道,转录因子的缺失 也会导致DON生成显著减少(Zhao et al.,2022)。AFg04194突变体中转录因子基因FGSG_00217、FGSG_03873和FGSG_03649表达显著下调,推测FGSG_04194基因通过调控这些转录因子基因影响 DON的生成。上述研究进一步表明,DON的生成受 多种因素影响。
本研究结果显示,一些与脂质代谢相关的基因 在△Fg04194突变体中显著上调或下调。脂肪酸合成酶和脂肪酸羟化酶等在调节脂质代谢、能量产生及次级代谢物质合成中发挥着重要的作用(Brownet al.,1996;Qiu et al.,2020)。本研究中脂肪酸合成酶在△Fg04194突变体中的基因表达下调,从而影响 脂肪酸的合成,进一步影响细胞膜组成和菌丝生长; 脂肪酸羟化酶的下调会导致脂肪酸合成和能量代谢的异常,暗示FGSG_04194基因参与调控禾谷镰刀菌的脂质代谢过程。同时,本研究发现,AFg04194突变体中的ATP生成量显著增多,表明FGSG_04194 基因在禾谷镰刀菌的能量代谢中发挥负调控作用。 这可能是因为该基因的缺失影响了细胞内代谢调控 网络的平衡,引起了能量代谢途径的调整或补偿机 制的激活,从而导致了DON和ATP生成出现异常变化。本研究后续将对筛选出的关键DEGs的基因功能 进行分析验证,其具体的调控机制有待进一步研究。
4结论
禾谷镰刀菌ALDH基因FGSG_04194影响禾谷 镰刀菌的菌丝生长和DON生成,并在ATP生成中起 负调控作用,其调控机制可能与调控转录因子的表达、调控脂类代谢、氨基酸代谢和能量代谢等通路有关。推测禾谷镰刀菌机体在缺失ALDH后发生了复 杂的基因表达和代谢通路变化,影响细胞内代谢调节网络的平衡,导致菌丝生长、DON和ATP生成出 现异常变化。
参考文献(References):
孟瑶,翟焕趁,张帅兵,吕扬勇,朱丽红,王亚君,蔡静平.
2019.小麦赤霉病菌FgVPS26与FgRab7的相互作用及对DON毒素合成的影响[J].河南工业大学学报(自然科
学版),40(2):21-27.[Meng Y,Zhai HC,ZhangSB,Lü Y Y, Zhu L H, Wang Y J, Cai J P. 2019. Interaction between FgVPS26 and FgRab7 and their effect on the syn- thesis of DON toxin in Fusarium graminearum[J]. Journal of Henan University of Technology (Natural Science Edi- tion),40(2): 21-27.] doi:10.16433/j.cnki.issn1673-2383.2019.02.004.
薛晓雯,翟焕趁,屈建航,张帅兵,吕扬勇,李娜,魏闪,马平 安,蔡静平,胡元森.2020.禾谷镰刀菌FgNST1对FgMGV1及DON毒素合成的影响[J].河南农业大学学
报,54(6):985-994.[Xue XW,Zhai H C,QuJH,Zhang S B,Lü Y Y,Li N,Wei S,Ma P A, Cai J P,Hu Y S. 2020. Effects of Fusarium graminearum FgNST1 on FgMGV1 and the synthesis of DON toxin[J]. Journal of Henan Agri- cultural University,54(6): 985-994.] doi: 10.16445/j.cnki.1000-2340.2020.06.010.
薛晓雯.2021.禾谷镰刀菌NST1对DON的调控及对拮抗菌的响应作用[D].郑州:河南工业大学.[XueXW.2021.
The mechanism of Fusarium graminearum NST1 regulation on DON biosynthesis and its response to antagonistic bacteria[D]. Zhengzhou: Henan University of Technology.]doi:10.27791/d.cnki.ghegy.2021.000023.
张乐,陈宣钦,李昆志.2013.植物醛脱氢酶基因家族[J].生命的化学,33(3),299-306.[Zhang L,ChenXQ,Li KZ.
2013. Aldehyde dehydrogenase gene family in plants [J].Chemistry of Life, 33 (3) : 299-306.] doi: 10.13488/j.smhx.2013.03.019.
Abdelhakim I A, Motoyama T, Nogawa T, Mahmud F B, Futamura Y, Takahashi S, Osada H. 2022. Isolation of new lucilactaene derivatives from P450 monooxygenase and aldehyde dehydrogenase knockout Fusarium sp. RK97-94 strains and their biological activities[J]. The Journal of Antibiotics , 75 ( 7) : 361-374. doi : 10.1038/s41429-022-00529-3.
Abdul W, Aliyu S R, Lin L, Sekete M, Chen X, Otieno F J, Yang T, Lin Y,Norvienyeku J,Wang Z. 2018. Family-four aldehyde dehydrogenases play an indispensable role in the pathogenesis of Magnaporthe oryzae[J]. Frontiers in Plant Science,9:980. doi: 10.3389/fpls.2018.00980.
Ahmed L A, Younus H. 2019. Aldehyde toxicity and metabo-lism: The role of aldehyde dehydrogenases in detoxification, drug resistance and carcinogenesis[J]. Drug Metabolism Reviews, 51(1):42-64. doi:10.1080/03602532.2018.
1555587. Alam M F, Laskar A A, Maryam L, Younus H. 2016. Activation of human salivary aldehyde dehydrogenase by sulforaphane:Mechanism and significance[J]. PLoS One,11(12): e0168463. doi: 10.1371/journal.pone.0168463.
Aranda A, del Olmo M M. 2003. Response to acetaldehyde stress in the yeast Saccharomyces cerevisiae involves a strain-dependent regulation of several ALD genes and is mediated by the general stress response pathway[J]. Yeast (Chichester, England),20(8):747-759. doi : 10.1002/yea.991.
Ashburner M, Ball C A, Blake J A, Botstein D, Butler H, Cherry J M, Davis A P, Dolinski K, Dwight S S, Eppig J T, Harris M A, Hill D P, Issel-Tarver L, Kasarskis A,
Lewis S, Matese J C, Richardson J E, Ringwald M, Rubin G M, Sherlock G. 2000. Gene ontology: Tool for the unification of biology. The Gene Ontology Consortium[J]. Nature Genetics, 25(1): 25-29. doi: 10.1038/75556.
Brown D W,Adams T H,Keller N P. 1996. Aspergillus has distinct fatty acid synthases for primary and secondary metabolism [J]. Proceedings of the National Academy of Sciences of the United States of America, 93 (25) : 1487314877. doi: 10.1073/pnas.93.25.14873.
Cardona-Cardona Y V, Regla I, Juárez-Díaz J A, Carrillo- Campos J, López-Ortiz M, Aguilera-Cruz A, Mújica- Jiménez C, Muñoz-Clares R A. 2021. The critical role of the aldehyde dehydrogenase PauC in spermine, spermi- dine, and diaminopropane toxicity in Pseudomonas aerugi- nosa: Its possible use as a drug target[J]. The FEBS Jour- nal, 289(9): 2685-2705. doi: 10.1111/febs.16277.
Chen Q,Lei L,Liu C,Zhang Y,Xu Q,Zhu J,Guo Z,Wang Y, Li Q, Li Y, Kong L, Jiang Y, Lan X, Wang J,Jiang Q, Chen G, Ma J, Wei Y,Zheng Y , Qi P. 2021. Major facilitator superfamily transporter gene FgMFS1 is essential for Fusarium graminearum to deal with salicylic acid stress and for its pathogenicity towards wheat[J]. International Journal of Molecular Sciences,22(16):8497. doi: 10.3390/ijms22168497.
Coleman J J, Mylonakis E. 2009. Efflux in fungi: la pièce de résistance [J]. PLoS Pathogens, 5 (6) : e1000486. doi: 10.1371/journal.ppat.1000486.
Díaz-Sánchez V, Carmen Limón M, Schaub P, Al-Babili S, Avalos J. 2016. A RALDH-like enzyme involved in Fusarium verticillioides development[J]. Fungal Genetics and Biology,86:20-32. doi:10.1016/j.fgb.2015.12.005.
Gao C,Han B. 2009. Evolutionary and expression study of the aldehyde dehydrogenase (ALDH) gene superfamily in rice (Oryza sativa) [J]. Gene,431(1-2) : 86-94. doi: 10.1016/j.gene.2008.11.010.
Guan Y F, Tanwar U K, Sobieszczuk-Nowicka E, FloryszakWieczorek J, Arasimowicz-Jelonek M. 2022. Comparative genomic analysis of the aldehyde dehydrogenase gene superfamily in Arabidopsis thaliana–searching for the functional key to hypoxia tolerance[J]. Frontiers in Plant Science,13: 1000024. doi: 10.3389/fpls.2022.1000024.Guo L,Zhao G Y, Xu J R,Kistler Corby H, Gao L X,Ma L J.
2016. Compartmentalized gene regulatory network of the pathogenic fungus Fusarium graminearum[J]. The New Phytologist,211(2):527-541. doi: 10.1111/nph.13912.
Hu C H,Chen P,Zhou X H,Li Y C,Ma K S,Li S M,Liu H P, Li L L. 2022. Arms race between the host and pathogen associated with Fusarium head blight of wheat[J]. Cells,11
(15):2275. doi:10.3390/cells11152275.Islam M S, Mohtasim M, Islam T, Ghosh A. 2022. Aldehyde
dehydrogenase superfamily in sorghum: Genome-wide identification, evolution, and transcript profiling during development stages and stress conditions [J]. BMC Plant Biology,22(1):316. doi:10.1186/s12870-022-03708-4.
Kanehisa M, Goto S, Kawashima S, Okuno Y, Hattori M. 2004. The KEGG resource for deciphering the genome [J]. Nucleic Acids Research, 32 (Database issue) : D277-D280.doi:10.1093/nar/gkh063.
Kotchoni S O, Kuhns C, Ditzer A, Kirch H H, Bartels D. 2006. Over-expression of different aldehyde dehydrogenase genes in Arabidopsis thaliana confers tolerance to abiotic stress and protects plants against lipid peroxidation and "oxidative stress[J]. Plant, Cell amp; Environment, 29 (6):
1033-1048. doi:10.1111/j.1365-3040.2005.01458.x.
Lee J I, Yu Y M, Rho Y M, Park B C, Choi J H, Park H M, Maeng P J. 2005. Differential expression of the chsE gene encoding a chitin synthase of Aspergillus nidulans in response to developmental status and growth conditions [J]. FEMS Microbiology Letters, 249 (1) : 121-129. doi: 10.1016/j.femsle.2005.06.006.
Lo H F,Su J Y, Chen H L, Chen J C, Lin L L. 2011. Biophysical studies of an NAD (P) (+)-dependent aldehyde dehydrogenase from Bacillus licheniformis [J]. European Biophysics Journal, 40(10): 1131-1142. doi: 10.1007/s00249-011-0744-x.
Norvienyeku J,Zhong Z H,Lin L L,Dang X,Chen M L,Lin X L,Zhang H H, Anjago W M, Lin L Y,Abdul W, Wang Z
H. 2017. Methylmalonate-semialdehyde dehydrogenase mediated metabolite homeostasis essentially regulate conidiation, polarized germination and pathogenesis in Magnaporthe oryzae[J]. Environmental Microbiology,19(10):4256-4277. doi: 10.1111/1462-2920.13888.
Qi P F,Zhang Y Z,Liu C H,Zhu J,Chen Q,Guo Z R,Wang Y, Xu B J,Zheng T,Jiang Y F,Wang J P,Zhou C Y,Feng X, Kong L, Lan X J,Jiang Q T, Wei Y M, Zheng Y L. 2018. Fusarium graminearum ATP-binding cassette transporter gene FgABCC9 is required for its transportation of salicylic acid,fungicide resistance,mycelial growth and pathogenicity towards wheat[J]. International Journal of Molecular Sciences, 19(8): 2351. doi: 10.3390/jjms19082351.
Qiu X, Xie X, Meesapyodsuk D. 2020. Molecular mechanisms for biosynthesis and assembly of nutritionally important very long chain polyunsaturated fatty acids in microorganisms [J]. Progress in Lipid Research, 79: 101047. doi: 10.1016/j.plipres.2020.101047.
Sorbo G D, Schoonbeek H, de Waard M A . 2000. Fungal transporters involved in efflux of natural toxic compounds and fungicides [J]. Fungal Genetics and Biology,30(1) : 1-15.doi: 10.1006/fgbi.2000.1206.
Wang G Q, Gao X F,Gao H X,Bao H S, Liu Y,Li Y S. 2015. Heterologous expression and purification of aldehyde dehydrogenase gene from Bacillus halodurans XJU-1 [J].
Technology and Health Care, 23(S) : S49-53. doi: 10.3233/ thc-150928.
Zanoni M, Bravaccini S, Fabbri F, Arienti C. 2022. Emerging roles of aldehyde dehydrogenase isoforms in anti-cancer therapy resistance[J]. Frontiers in Medicine,9:795762. doi:10.3389/fmed.2022.795762.
Zhang J,Guo Y Y,Zhao X K,Pang J,Pan C,Wang J L,Wei S J, Yu X, Zhang C, Chen Y G, Yin H Y, Xu F. 2023. The role of aldehyde dehydrogenase 2 in cardiovascular disease [J]. Nature Reviews Cardiology, 20 (7) :495-509. doi: 10.1038/s41569-023-00839-5.
Zhang Y Z,Chen Q,Liu C H,Liu Y B,Yi P,Niu K X,Wang Y Q,Wang A Q, Yu H Y,Pu Z E,Jiang Q T,Wei Y M,Qi P
F,Zheng Y L. 2016. Chitin synthase gene FgCHS8 affects virulence and fungal cell wall sensitivity to environmental stress in Fusarium graminearum[J]. Fungal Biology, 120(5):764-774. doi:10.1016/j.funbio.2016.02.002.
Zhao Y X, Sun H L, Li J W,Ju C, Huang J G. 2022. The transcription factor FgAtrR regulates asexual and sexual development, virulence, and DON production and contributes to intrinsic resistance to azole fungicides in Fusarium graminearum[J]. Biology (Basel), 11 (2) :326. doi: 10.3390/biology11020326.
(责任编辑陈燕)
