模拟增强UV-B辐射下台农一号芒果抗氧化响应机理
2024-01-01税贤陈甜甜彭俊杰杜婧加周开兵

摘要:【目的】研究增强UV-B辐射下台农一号芒果果肉抗氧化还原性成分的响应机理,为全球气候变化下芒果生产提供理论参考。【方法】以自然光照射为对照,设人工模拟增强UV-B辐射,强度为96kJ/(m2·d)处理。2021年花后 30d(12月18日)至花后90d(2022年2月17日)、2022年花后40d(12月1日)至花后90d(2023年1月21日),每隔10d取 芒果果肉样本1次,分别取样共7和6次。在果肉中测定各采样时期的总黄酮、总酚、超氧阴离子、过氧化氢(H,02)和丙二醛(MDA)含量,以及苯丙氨酸解氨酶(PAL)和多酚氧化酶(PPO)酶活性、相对电导率(REC)的动态变化。【结果】经增强UV-B辐射处理后,第1和2年活性氧(ROS)中超氧阴离子含量随时间的增加均呈逐渐升高趋势,超氧阴离子在第1年花后90d、翌年花后70~90d,辐射处理显著高于对照(Plt;0.05,下同);辐射处理的H,0,变化趋势则为第1年先下 降后上升,仅花后90d辐射处理显著高于对照,翌年总体上下降,花后70~90d辐射处理均显著高于对照。芒果果肉 中总酚和总黄酮含量2年动态变化均整体呈下降趋势,总酚在第1年花后50d、翌年花后50和60d,辐射处理显著高于 对照;总黄酮在第1年花后40和50d、翌年花后50和60d,辐射处理显著高于对照。MDA含量和REC的2年变化趋势均为下降后上升,其中MDA含量在第1年花后40d、翌年花后50d,对照显著高于辐射处理,而2年在花后90dMDA含量和REC均表现为辐射处理显著高于对照。芒果果肉辐射处理的PAL活性在第1年呈下降一上升一下降的变化趋势, 花后40d辐射处理显著高于对照,花后90d时无显著差异;翌年呈上升—下降一上升的变化趋势,辐射处理50~70d 均表现为显著差异。PPO活性2年测定中的动态变化均呈先降后升的变化趋势,第1年在辐射处理40、60、70和80dPPO活性显著高于对照,翌年花后60和90d辐射处理显著高于对照。【结论】增强UV-B辐射处理下的芒果主要通过调节PAL活性来控制合成以黄酮为主的酚类化合物,并作为应对UV-B辐射的高效抗氧化剂。
关键词:芒果;UV-B;抗氧化;酚类;活性氧
中图分类号:S667.7
文献标志码:A
文章编号:2095-1191(2024)03-0846-09
Antioxidant response mechanism of Tainong No.1 mango under simulation enhanced UV–B radiation
SHUI Xian1-2, CHEN Tian-tian1.2, PENG Jun-jie1.2, DU Jing-jia1.2, ZHOU Kai-bing1.2*(1Sanya Nanfan Research Institute, Hainan University, Sanya, Hainan 572025, China; 2Key Laboratory for Quality Regulation of Tropical Horticultural Plants of Hainan Province, College of Tropical Agriculture and Forestry,Hainan University, Haikou, Hainan 570228, China)
Abstract: 【Objective】The purpose of the study was to investigate the response mechanism of antioxidant reduction components of Tainong No. 1 mango pulp under strong UV-B radiation, so as to provide a theoretical reference for mango production under global climate change. 【Method 】Natural light irradiation was used as the control, and the artificial simu- lation enhanced UV-B radiation with an intensity of 96 kJ/(m2-d) was set up. In 2021, mango pulp samples were taken every 10 d from 30 d after anthesis (December 18) to 90 d after anthesis (February 17, 2022) and from 40 d after anthe- sis (December 1) in 2022 to 90 d after anthesis (January 21, 2023), for a total of 7 and 6 samples, respectively. The con-tents of total flavonoids, total phenols, superoxide anion hydrogen peroxide (H2O2) and malondialdehyde (MDA) , as well as the dynamic changes of phenylalanine ammonia-lyase (PAL) and polyphenol oxidase (PPO) enzyme activities and relative electrical conductivity (REC) were measured in the pulp at each sampling period. 【Result]After enhanced UV-B radiation treatment, the content of superoxide anion in reactive oxygen species (ROS) of the first year and the se- cond year increased gradually with the increase of time, and superoxide anion at 90 d after the first year and 70 to 90 d after the next year was significantly higher than that of control (Plt;0.05, the same below). The variation trend of H2O2 under radiation treatment was firstly decreased and then increased in the first year, and only the radiation treatment at 90 d after anthesis was significantly higher than the control, H202 in the next year decreased, and the radiation treatment at 70 to 90 d after anthesis was significantly higher than the control. The contents of total phenol and total flavone in mango pulp showed a decreasing trend at 2 years. The contents of total phenol at 50 d after anthesis in the first year and 50 and 60 d after anthesis in the next year were significantly higher than those of control under radiation treatment. The 2-year change trend of MDA content and REC was decreased and then increased. MDA content in the first year was significantly higher than that in the control group at 40 d after anthesis and 50 d after anthesis in the next year, while MDA content and REC were significantly higher than that in the control group at 90 d after anthesis. The PAL activity of mango pulp treated with radiation showed a trend of decreasing, increasing and decreasing at the first year. The PAL activity of mango pulp treated with radiation was significantly higher than that of control at 40 d after anthesis, and there was no significant dif- ference at 90 d after anthesis. In the next year, there was an upward-downward-upward trend, and there were significant differences between 50-70 d after radiation treatment. The dynamic changes of PPO activity at 2 years showed a trend of first decreasing and then increasing. In the first year, the activity of PPO at 40, 60, 70 and 80 d was significantly higher than that of the control, and in the next year, the activity of PPO at 60 and 90 d after anthesis was significantly higher than that of the control. 【Conclusion】Mango treated with enhanced UV-B radiation mainly control the synthesis of pheno- lic compounds dominated dominated by flavonoids through regulating PAL activity and act as efficient antioxidants against UV-B radiation.
Key words: mango; UV-B; antioxidant; phenols; reactive oxygen
Foundation items: National Natural Science Foundation of China (32160677)
0 引言
【研究意义】在自然环境变迁及人类活动影响下,太阳辐射中UV-B(波长280~320nm)辐射到达地表的强度将持续提高(Zlatev et al.,2012),其辐射强度将持续增高到现在的120%(Archibald et al.,2020),低纬度及高海拔地区更为明显,即表现为增强UV-B辐射,其持续增强的UV-B辐射可能会成为植物生命活动中越来越重要的胁迫因素(董娟娥等,2009;董轩名,2023)。芒果是海南地区重要农业经济支柱之一,海南省纬度低、紫外辐射强烈,非常适宜芒果生长,而面临逐步增强的UV-B辐射反应也迅速,影响热带果树正常生长发育,导致减产及风味品质降低。因此,研究芒果在增强UV-B辐射处理下的抗氧化响应机理,对确保海南芒果品质有重要意义。【前人研究进展】低UV-B辐射是一种信号刺激,可调节各种生理生化反应,通过诱导特定UV-B受体中的UV-B反应位点8(UVR8)调节形态反应,进而完成正常生长发育过程(Fernández et al.,2016),有利于植物存活。但增强UV-B对植物损伤主要体现在破环细胞内部大分子物质(DNA等),并诱导活性氧(ROS)产生,对细胞膜造成破坏,同时激活植物修复与保护机制(Jenkins,2009),诱导产生以酚类为主的抗氧化物质(Frohnmeyer and Staiger,2003;Britt,2004;Stracke et al.,2010;Tilbrook et al.,2013)。 研究发现,增强UV-B辐射使香蕉叶片光合作用效率降低,产量下降(孙谷畴等,2000);增强UV-B辐射在植物中也可能导致类囊体膜完整性丧失、光系统Ⅱ(PSII)受损及减少碳同化和氧释放等(Hollósy,2002;Rojas-Lillo et al.,2014);增强UV-B辐射可减小葡萄形态及减少色素形成(吴芳芳等,2008)。尽管芒果能较好地适应自然强紫外辐射环境,但人工模拟增强UV-B辐射会使台农一号芒果叶片产生ROS损伤。团队前期研究发现人工模拟增强UV-B辐射强度达42kJ/(m²·d)便开始引起芒果果实产量下降及果实风味品质变劣(袁孟玲等,2018;周开兵等,2018),同时增强的UV-B辐射对植物产生的损伤逐步积累。【本研究切入点】目前对于草本植物增强UV-B辐射研究广泛,但针对多年生木本植物的抗氧化响应特点尚不明确,尤其缺少对已经产业化并具有重要经济效益的果树品种研究,无相关栽培技术指导理论参考。【拟解决的关键问题】人工模拟UV-B辐射并增强至96kJ/(m²·d)照射芒果台农一号,测定果肉中ROS含量、多酚氧化酶(PPO)活性、丙二醛(MDA)含量及相对电导率(REC)的变化以确定果肉受损伤程度,测定果肉总酚、总黄酮及苯丙氨酸解氨酶(PAL)活性以分析确定芒果果肉中主要抗氧化物质变化特点,为热带水果应对未来逐步增强的UV-B辐射环境及优化改善栽培方法提供理论依据。
1材料与方法
1.1试验材料
试验地点位于海南省三亚市海棠区升昌村丰产芒果园(18°24'47.99\"N、109°46'43.65\"E,平均海拔78m),属热带季风海洋气候,年均日照时长超2000h,年均降水量约1800mm,年均温约26℃,园土为砖红沙壤土。在芒果园选择10株生长发育一致且丰产成年的台农一号芒果树,均为昌江土芒作砧木的嫁接树。2021一2023年连续2年测定芒果果实生理指标。当地台农一号芒果2021一2022年生长季物候期中,8-9月花芽分化期、10月上旬花蕾抽生期、10月中下旬开花期、11月上中旬第一次生理落果期、12月一翌年1月果实膨大期、2月上中旬果实采收期;为配合春节上市需求调节2022-2023年芒果物候期,各生长发育时间节点比上一年相应提前1个月。
1.2试验设计
在自然光下,使用铝合金管搭建紫外灯架,灯管离树顶保持30cm,挂4盏40W紫外灯(北京电光源研究所提供),波长峰值为313nm,光照强度共计约96kJ/(m2·d),进行人工模拟高剂量增强UV-B辐射处理,单株小区,5次重复。每日均按日出和日落的时间分别开灯和关灯,如白天遇阴雨天则关灯停止处理。以自然光照射芒果树体为对照(CK),人工模拟增强UV-B辐射为处理(T)。自2021年12月18日开始处理时第1次取样,在树冠中部外围东南西北4个方向各选大小一致的健壮果5个挂牌标记,作为此后动态定期取样的标准果(此后采摘与其大小一致的果作为样品)。取样时间:花后30~90d(2021年12月18日、2021年12月28日、2022年1月8日、2022年1月18日、2022年1月28日、2022年2月7日、2022年2月17日);翌年较第1年晚10d开始取样,即花后40~90d(2022年12月1日、2022年12月11日、2022年12月21日、2023年1月1日、2023年1月11日、2023年1月21日),每次采样间隔10d,分别共取样共7和6次。每次在果园取好果样后,就地去皮,将果肉切小块,液氮速冻后装入50mL离心管,放进液氮罐带回实验室储存于-80℃冰箱备用。
1.3测定项目与方法
1.3.1MDA含量与REC测定
采用TBA比色法 测定芒果果肉MDA含量(Sen and Alikamanoglu, 2013)。首先取芒果果肉1g,加入预冷后的10%三 氯乙酸,在研钵中加入少量石英砂研磨匀浆,再加入 8mL浓度10%的三氯乙酸(TCA)进一步研磨后在4℃条件下4000r/min离心10min,取上清液2mL,加入2mL0.6%硫代巴比妥酸混匀,于沸水浴15min, 冷却后离心放入紫外分光光度计在400、532和600nm 波长下测定吸光度(X),代入公式计算含量:Y=6.45×(X532mm-X6o0mm)-0.56X450mm。采用电导率仪浸泡法测定芒果果肉REC(Wang et al.,2021a),测取果肉1 g,切至若干适定长条,置于10mL去离子水的刻度试管 中,盖上玻璃塞置于室温下浸泡处理12h,而后提取 上清液并用电导仪测定其电导值(R1),然后沸水浴 加热30min,冷却至室温后摇匀,再次测定浸提液电 导值(R2),根据以下公式计算REC(%)=R1/R2×100。
1.3.2主要ROS成分的测定
利用超氧阴离子试剂盒(ADS-W-YH008)测定超氧阴离子含量。样品准备:称取约0.1g果肉,在研钵中加入少量石英砂 研磨匀浆,12000r/min、4℃离心20min,其后在酶标 仪中测得含量。利用H2O2试剂盒(ADS-W-YH001)测定H,O2含量,样品准备:称取约0.1g果肉,加入1mL丙酮溶液进行冰浴匀浆,8000r/min、4℃离心 10min,取上清,其后在酶标仪中测得含量。以上试 剂盒均购自江苏艾迪生生物科技有限公司。
1.3.3总酚和总黄酮含量测定
提取芒果果肉中总黄酮与总酚含量。首先将1g芒果果肉样品放置研钵,冰浴条件下加入少量石英砂和8 mL无水甲醇,充分研磨后倒入试管在4°℃下避光提取2h,期间进行1次超声辅助提取,然后放入12000 r/min的离心机中离心20 min,取上清液放入紫外分光光度计在325 nm波长下测定吸光度,以无水甲醇做对照,并取芦丁标准品做标准曲线方程,代入标准曲线方程得出总黄酮含量。取上述上清液 0.1 mL,加入0.2 mL 福林酚试剂和 2.7 mL 的 10%碳酸钠溶液,在50 C恒温水浴30 min,取3 mL混合液放入紫外分光光度计在700 nm 处测定吸光度,以蒸馏水为对照,并取没食子酸标准品做标准曲线方程,代入方程得出总酚含量(Singleton et al.,1999)。
1.3.4PAL和PPO活性测定
PAL活性测定使用PAL活性测定试剂盒(D799600),样品准备:称取约0.1g果肉,加入1mL提取液进行冰浴匀浆,10000r/min、4℃条件下离心10min,取上清液,其后在酶标仪中测得含量。PPO活性测定使用提供的PPO活性测定试剂盒(D799595),样品准备:称取约0.1g果肉,加入1mL提取液进行冰浴匀浆,8000r/min、4℃条件下离心10min,取上清液,其后在酶标仪中测定含量。以上试剂盒均购自生工生物工程(上海)股份有限公司。
1.4统计分析
采用SAS9.4进行数据处理,使用其中单因素方差分析(One-way ANOVA法进行方差分析,运用 Duncan's法进行多重比较;采用t检验进行差异显 著性分析。
2结果与分析
2.1增强UV-B辐射处理对芒果果肉中MDA含量和 REC的影响
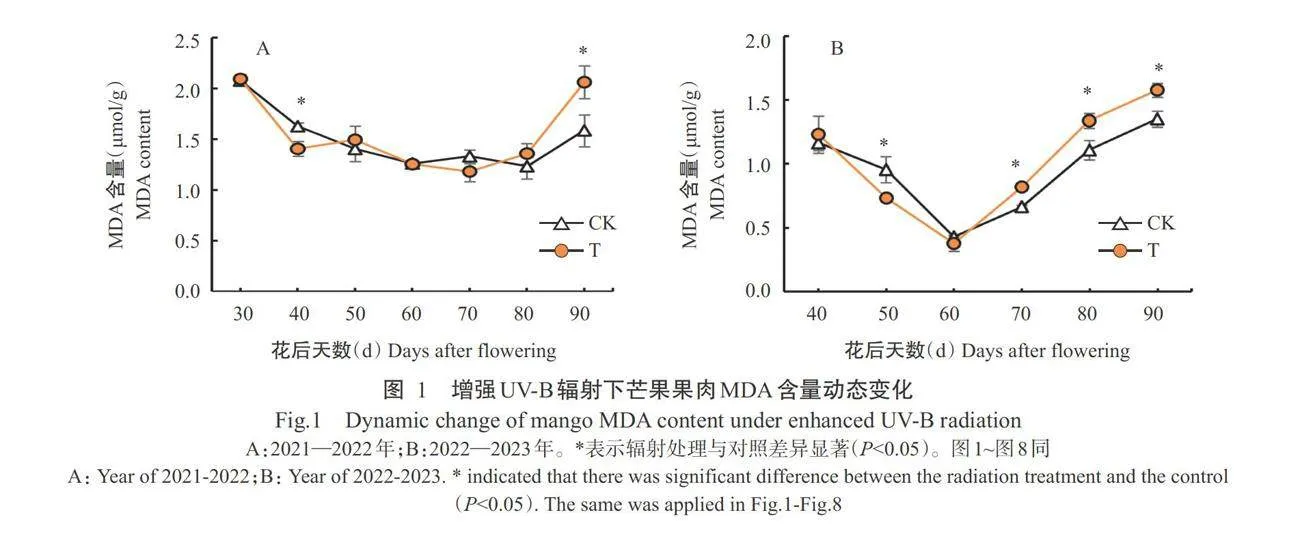
2.1.1芒果果肉MDA含量变化
由图1-A可知,2021-2022年增强UV-B辐射处理和对照的芒果果 肉中MDA含量在花后40~90d均呈先下降后上升的 变化趋势。其中,花后40d辐射处理芒果果肉的 MDA含量显著低于对照(Plt;0.05,下同);花后90d, 辐射处理芒果果肉的MDA含量显著高于对照;其余 时间点的2组处理间无显著差异(Pgt;0.05,下同)。由图1-B可知,翌年辐射处理和对照的芒果果肉中 MDA含量在花后40~90d均呈先下降后上升的趋势; 在花后70、80和90d,处理芒果果肉中MDA含量显著高于对照,花后50d,对照的MDA含量显著高于 辐射处理。
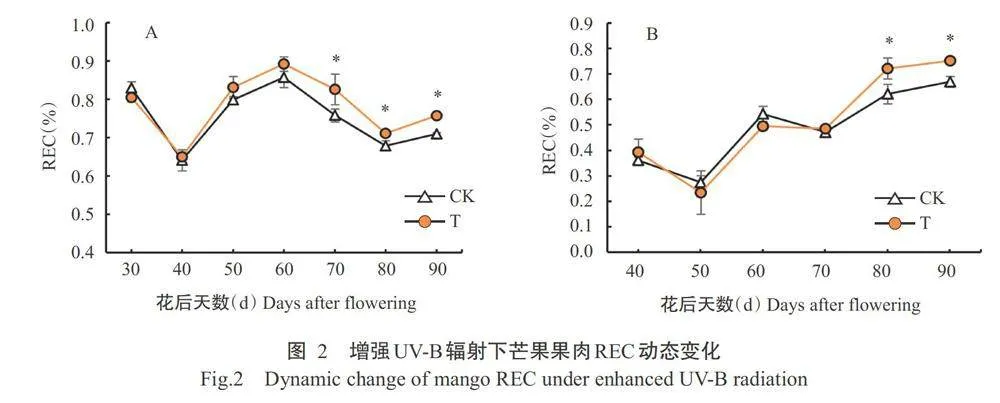
2.1.2芒果果肉REC变化
由图2-A可知,随着开
花后时间的延长,辐射处理和对照芒果果肉的REC 均呈明显波动,在花后70、80和90d,辐射处理芒果 果肉的REC显著高于对照,其余时间二者间无显著差异。由图2-B可知,翌年辐射处理和对照芒果果肉的REC变化趋势也很相似,花后40~50d先下降, 然后总体呈上升趋势;花后80和90d,辐射处理芒果 果肉的REC显著高于对照,其余时间二者间无显著差异。综合2年MDA含量和REC的变化可知,在增强UV-B辐射处理前期,果肉组织细胞未出现损伤, 而随着处理的累积效应出现,在后期果肉组织细胞 出现明显的膜脂损伤。
2.2增强UV-B辐射处理对芒果果肉中ROS含量的影响
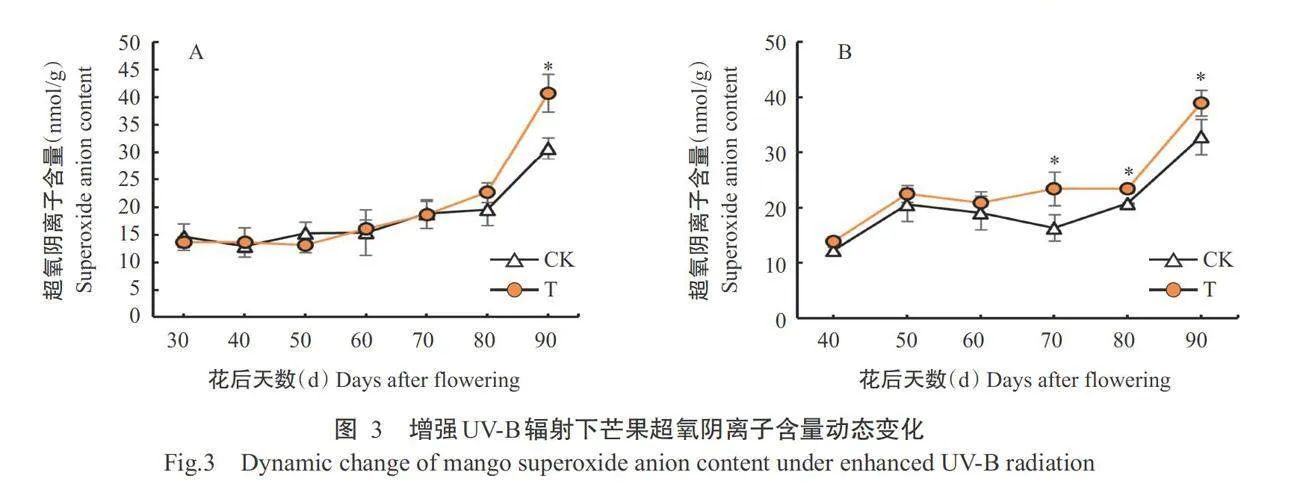
2.2.1芒果果肉超氧阴离子含量变化
由图3-A 可知,第1年辐射处理和对照芒果果肉的超氧阴离 子含量均呈相似的上升趋势,仅花后90d辐射处理 显著高于对照,其余时间二者间无显著差异。由图 3-B可知,翌年辐射处理和对照芒果果肉的超氧阴离 子含量呈相似的变化趋势,与第1年不同的是,花后 70、80和90d,辐射处理均显著高于对照。
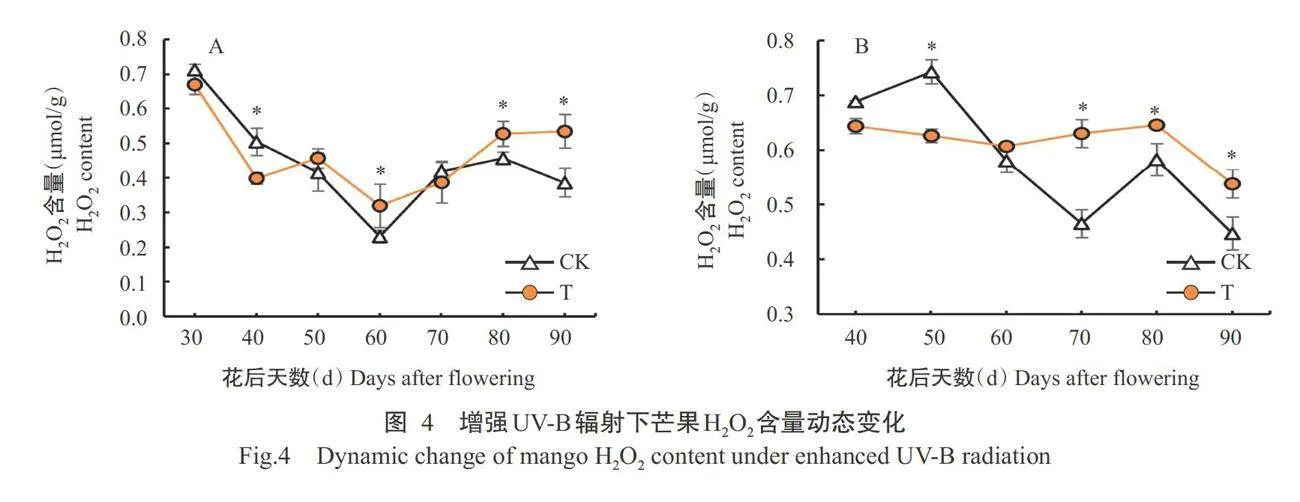
2.2.2芒果果肉H202含量变化
由图4-A可知,第1年的辐射处理和对照的芒果果肉H2O2含量均呈先 下降后上升的变化趋势。其中,花后40d,辐射处理 芒果果肉的H2O2含量显著低于对照;花后60、80和90d,辐射处理芒果果肉的H2O2含量均显著高于对照;其余时间二者间无显著差异。由图4-B可知,翌年辐射处理芒果果肉的H2O2,含量80d之前变化不明显,之后明显下降,对照的H2O2含量则呈上升一 下降波动变化趋势。其中,花后50d,辐射处理芒果 果肉的H2O2含量显著低于对照;花后70、80和90d,辐射处理芒果果肉的H2O2含量显著高于对照;其余 时间二者间无显著差异。在2年测定的结果中发 现,增强UV-B辐射处理前期,辐射处理芒果果肉的2种ROS含量均表现为低于对照的趋势;而中后期,辐射处理芒果果肉的2种ROS含量均高于对照,说明前期增强UV-B辐射诱导了ROS清除防御能力增强而减少ROS的积累,而中后期芒果果肉ROS的产生超出ROS清除防御能力而出现了ROS积累。
2.3增强UV-B辐射处理对芒果果肉中总酚含量的影响
由图5-A可知,第1年辐射处理和对照芒果果肉的总酚含量整体均呈下降趋势。由图5-B可知,翌年辐射处理在花后60d前先上升,此后至花后90d下降;对照则在花后60d明显下降,至花后70d又上升,而后下降。第1年花后50d、翌年花后50和60d,辐射处理显著高于对照;第1年花后80和90d、翌年花后70和80d,对照显著高于辐射处理;其余时间,二者间无显著差异。连续2年对芒果果肉总酚含量的测定发现,果肉总酚含量的变化趋势存在年际间差异,但辐射处理和对照在均在后期发生差异,均呈辐射处理前期明显高于对照、后期明显低于对照的趋势,说明增强UV-B辐射先通过果肉增加多酚等化合物积累而清除ROS自由基,进而抵御ROS损伤,后因果肉减少酚类等化合物积累而出现ROS损伤。
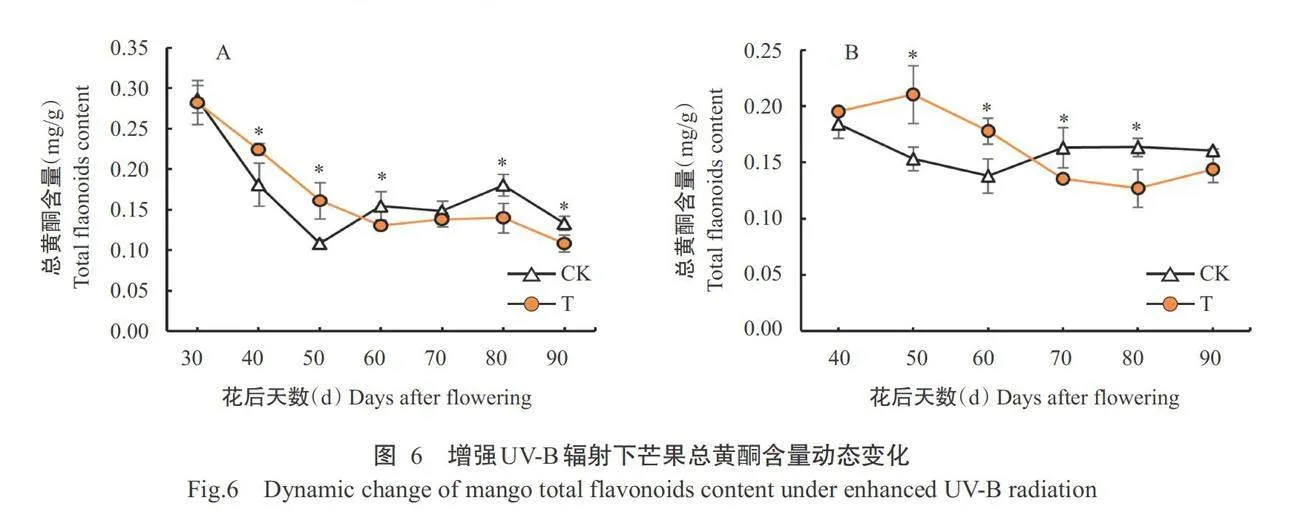
2.4增强UV-B辐射处理对芒果果肉中总黄酮含量的影响
由图6-A可知,辐射处理的总黄酮含量总体呈下降趋势,对照则呈下降一上升一下降的变化趋势。由图6-B可知,总黄酮含量翌年辐射处理呈上升一下降一上升变化趋势,对照则呈下降一上升一下降的变化趋势,但二者总体上均呈下降趋势。第1年花后40和50d、翌年花后50和60d,辐射处理显著高于对照;第1年花后60、80和90d、翌年花后70和80d,辐射处理显著低于对照;在其余时间,二者均无显著差异。由此可见,果肉黄酮类化合物含量的变化趋势存在年际间差异,但辐射处理和对照在同一时间的相对差异则相似,均呈辐射处理前期显著高于对照和后期显著低于对照的趋势,这与前文中ROS损伤和ROS自由基积累上的相对差异趋势基本一致,说明增强UV-B辐射先通过果肉增加黄酮类化合物积累而清除ROS自由基,进而抵御 ROS损伤,后因果肉减少黄酮类化合物积累而出现ROS损伤。
2.5增强UV-B辐射处理对芒果果肉中 PAL和PPO活性变化的影响
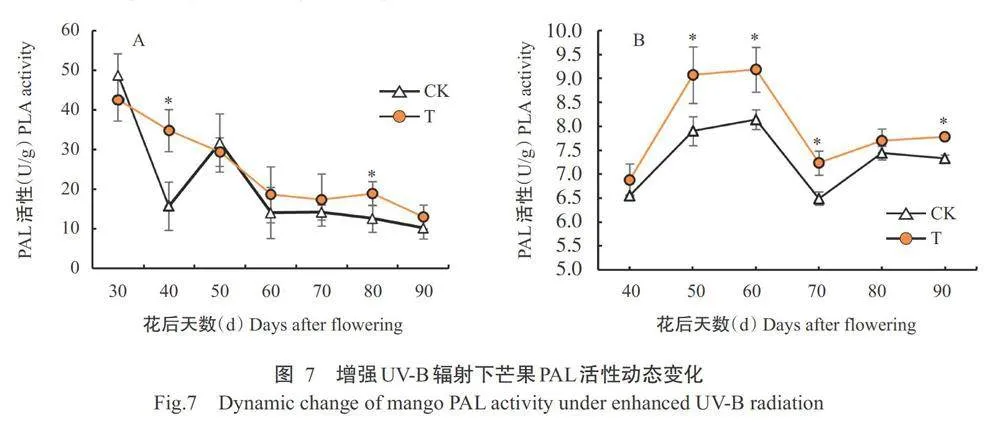
2.5.1芒果果肉PAL活性变化
由图7-A可知,第1年辐射处理和对照芒果果肉的PAL 活性均呈下降一上升一下降的变化趋势,且总体趋势均为下降。其中,花后40和80d,对照显著低于辐射处理,其余时间二者间无显著差异。由图7-B可知,翌年辐射处理和对照芒果果肉的PAL活性均呈上升一下降一上升的变化趋势,其中,花后50、60、70和90d,辐射处理芒果果肉的PAL活性显著高于对照。说明增强UV-B辐射处理有诱导果肉PAL活性增强的趋势。
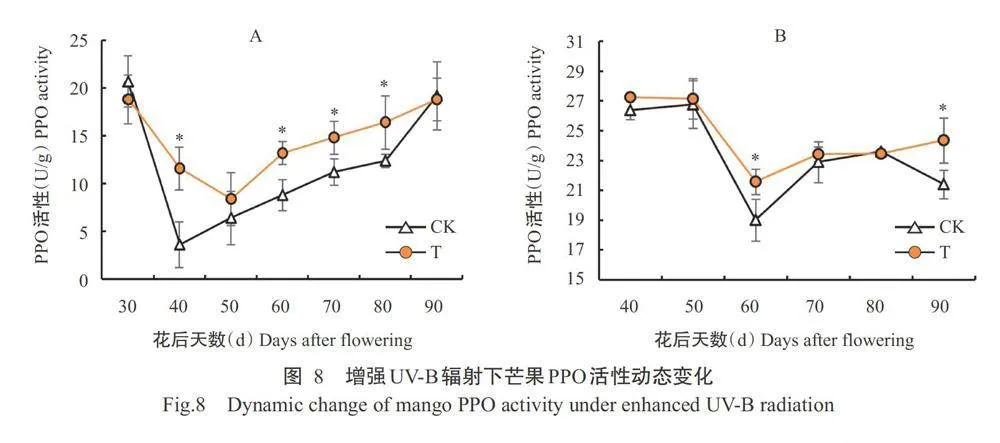
2.5.2芒果果肉PPO活性变化
由图8-A可知,辐射处理和对照芒果果肉的PPO活性均呈先降后升的变化趋势。其中,花后40、60、70和80d,辐射处理芒果果肉的PPO活性显著高于对照。由图8-B可知,辐射处理和对照芒果果肉的PPO活性在40~80 d均呈先降后升的变化趋势,花后90 d则辐射处理继续上升而对照下降。其中,花后60和90 d,辐射处理芒果果肉的 PPO活性显著高于对照,说明增强UV-B辐射处理诱导果肉 PPO活性增强。综上所述,相比自然光对照,辐射处理下芒果果肉PPO活性始终处于较高水平,说明增强UV-B辐射增大了芒果果肉中氧化还原反应的程度,当照射开始时果肉损伤也逐步开始积累;同时 PAL 活性在辐射期间同样始终处于较高水平,诱导苯丙氨酸向肉桂酸转化,从而合成大量酚类抗氧化物质。
3讨论
UV-B 辐射增强是一个全球性问题,未来 UV-B辐射增强,对低纬度和高海拔地区的影响更大,对热带多年生果树的影响尤为突出。我国海南省正处于低纬度地区,且芒果作为本地区中重要的经济支柱也已经形成产业化,在海南自贸港建设的背景下将逐步走向世界(冯飞,2023)。因此,在面临增强UV-B辐射对种业发展产生逆境条件下,有必要开展前瞻性研究,为热带果树栽培技术指导提供理论基础。
ROS在植物中伴随着呼吸作用也会产生,正常可作为一种体内信号分子来调节生长发育,但在环境胁迫下尤其是光胁迫下则会过量产生,导致细胞结构被破坏,另一方面会刺激大量次生代谢产物生成,用于清除ROS,其中包括超氧阴离子和HO,等。其次生代谢物主要为酚类物质,其是一种可防止UV-B辐射下对生物造成的主要抗氧化活性物质(Bilger et al.,2007),在 UV-B 辐射下也会产生更多的酚类物质(Meyer et al.,2021),也是一种天然的抗氧化物质,较早被发现这一点并从植物中提取酚类物质用于抵御紫外辐射的伤害(Rozema et al.,1997)。黄酮也被人们称为继碳水化合物、蛋白质和水等人体所需的六大营养素后的第七类营养素(史斌斌等,2023),具有很强的抗氧化作用。由于抗氧化类的还原物质具有有效预防人体癌症、心血管疾病等多种慢性疾病的作用,在医疗保健方面应用也极为广泛(Veiga et al.,2020)。因此,探讨芒果果肉还原性物质代谢问题,不仅仅是探究其抗氧化响应机制问题,也是在探讨其潜在的医疗和保健品改良问题。
本研究连续2年对芒果果实进行指标测定,存在采样时间差异,是贴合实际生产上做出的产期调节。ROS含量差异是由于年际间差异客观存在及产期调节后相同生长发育阶段所处环境不一样,2个生长季试验主要是动态变化趋势差异的重演性考察。在总酚和总黄酮含量动态变化中发现,增强UV-B处理和对照的总酚与总黄酮变化趋势一致,第1年在花后60d前对照低于辐射处理,60d开始高于辐射处理;翌年由于切实贴合生产并对产期进行调节,临界点在花后70d,说明花后60d是芒果在增强UV-B环境累积下的自身抵御的临界点,此后开始受到ROS的损伤。而REC和MDA高低代表ROS受到脂质过氧化和组织中的电解质泄漏程度(Prásil andZámecnik,1998;Tsikas,2017),其变化趋势与总酚和总黄酮相反,花后60或70d前增强UV-B处理低于或与对照相差不多,而花后60或70d后明显高于对照,说明大量合成的酚类作为芒果应对UV-B辐射的主要抗氧化物,并增强了前期抗氧化能力,该结论与Wang等(2021b)结果一致,UV-B处理增强了大麦幼苗酚酸积累和抗氧化能力,而到后期UV-B辐射持续累积最终造成ROS损伤,其后会直接影响果实风味品质、营养品质及经济效益等。
PAL是控制酚类化合物合成的关键前体物质,可催化苯丙氨酸解氨生成反式肉桂酸(Medda et al.,2020),PAL活性的提高可直接导致酚类的积累,这些物质决定了果实的抗氧化能力(Rubio-Melgarejoet al.,2021)。相比于自然光,UV-B辐射处理样品中PAL活性的增加使得酚类化合物前体物质(反式肉桂酸)大量积累,表明通过PAL途径大量合成的反式肉桂酸可进一步大量合成参与抗氧化反应的酚类物质,增强果实的抗氧化能力,与前人研究结果(Zhanget al.,2023)一致。PAL活性变化与总酚和总黄酮的含量动态变化趋势相符,即增强UV-B辐射处理下表现为在花后60d通过受到光胁迫感应从而使得PAL活性显著上调,从而产生以黄酮类化合物为主的酚类物质作为抗氧化的主要物质。花后60d,虽然PAL活性仍高于对照,但增强UV-B辐射造成的损伤积累,同时果实逐步成熟,机体内整体代谢水平下降,总酚和总黄酮含量也相对下降,在果实中无法清除ROS到维持正常含量水平,因此超氧阴离子和H2O2含量开始显著上调,并对细胞膜完整性和大分子物质造成损害,导致果实中细胞的脂质过氧化和组织中的电解质泄漏,最终造成果实品质的下降。
PPO则是导致果实氧化的主要酶(Zambrano-Zaragoza et al.,2014),其主要作用为催化邻苯二酚氧化为邻苯二醌,在逆境环境条件下,PPO可催化酚类物质氧化,并形成棕色色素样物质和黑色素(Singh et al.,2018)。增强UV-B辐射处理诱导芒果果肉PPO活性显著提高,意味着增强UV-B辐射逆境导致果肉中形成ROS,果肉通过产生大量酚类物质被ROS自由基氧化而清除后者。PPO活性在整个辐射期间均高于自然光对照,且在果实发育中期尤为显著,说明存在大量积累的酚类物质被转化为醌类物质,也与芒果果肉总酚和总黄酮含量变化特点相符。花后60d以后,PPO活性仍处于较高水平,同样也表示出果实内酚类黄酮类物质被大量消耗,导致果实品质的下降。
结论4
增强的UV-B辐射处理下的芒果主要通过调节PAL活性来控制合成以黄酮为主的酚类化合物,并作为应对UV-B辐射的高效抗氧化剂。
参考文献(References):
董娟娥,张康健,梁宗锁.2009.植物次生代谢与调控[M].杨凌:西北农林科技大学出版社:290.[DongJE,Zhang KJ, Liang Z S. 2009. Plant secondary metabolism and itsregulation M」. Yangling: Northwest Aamp;F University Press:290.]
董轩名.2023.独脚金内酯缓解拟南芥UV-B胁迫损伤机制研究[D].哈尔滨:东北林业大学.[Dong X M.2023.Studyon the mechanism of strigolactones toalleviate UV-B stressdamage in Arabidopsis thaliana [D]. Harbin:Northeast Fo-restry University.] doi:10.27009/d.cnki.gdblu.2023.000136.
冯飞.2023.坚持以党的创新理论为指引加快建设具有世界影响力的中国特色自由贸易港[J].党建,(8):7-10.[FengF. 2023. Adhere to the guidance of the construction of afree trade port with Chinese characteristics with worldinfluence[J]. Dangjian,(8):7-10.]
史斌斌,陈楠,李菲,袁启凤,颜培玲,王立娟,李仕品.2023.百香果黄酮类物质含量及发育变化[J].中国南方果树,52(1) : 97-100. [Shi B B, Chen N, Li F, Yuan Q F, Yan PL, Wang L J, Li S P. 2023. Content of flavonoids and theirchanges during fruit development in passion fruit[J]. SouthChina Fruits, 52 (1) : 97-100.] doi: 10.13938/j. issn. 1007-1431.20220139.
孙谷畴,赵平,曾小平,彭少麟.2000.补增UV-B辐射对香蕉叶片光合作用和叶氮在光合碳循环组分中分配的影响[J].植物学通报,17(5):450-456.[Sun G C,Zhao P,Zeng X P,Peng S L. 2000. Effect of supplementary UV-Bradiation on photosynthesis and partition of leaf nitrogenin components of photosynthetic carbon cycle in leaves ofMusa paradisiaca[J]. Chinese Bulletin of Botany,17 (5) :450-456.]
吴芳芳,郑有飞,万长健,吴荣军.2008.UV-B辐射增强对苹果采后炭疽病发病情况和抗病相关酶活性的影响[J].生态环境,(3):962-965.[Wu F F,Zheng Y F,Wan CJ,Wu R J. 2008. Effects of enhanced UV-B radiation on anthrac- nose incidence and activities of defense enzymes in apple postharvest fruit[J]. Ecology and Environmental Sciences,(3 ) : 962-965. ] doi : 10.16258/j.cnki.1674-5906.2008.03.075.
袁孟玲,岳堃,王红,郭钰柬,周开兵.2018.增强UV-B辐射对芒果成年树光合作用及其产量与常规品质的影响[J].南方农业学报,49(5):930-937.[Yuan M L,Yue K,Wang H, Guo Y J, Zhou K B. 2018. Effects of enhanced UV-B radiation treatment on photosynthesis, yield and conven- tional quality of adult mango tree [J]. Journal of Southern Agriculture , 49 ( 5 ) : 930-937. ] doi : 10.3969/j.issn.2095-1191.2018.05.15.
周开兵,李世军,袁孟玲.2018.增强UV-B辐射对芒果株产和果实品质及光合作用的影响[J].热带作物学报,39(6):1102-1107. [Zhou K B,Li S J,Yuan M L. 2018. The influences of enhanced UV-B radiation on yield and fruits qua-lity and photosynthesis of mango trees[J]. Chinese Journal of Tropical Crops,39(6):1102-1107.]
Archibald A T,Neu J L, Elshorbany Y F, Cooper O R, Young PJ, Akiyoshi H, Cox R A, Coyle M, Derwent R G, DeushiM, Finco A,Frost G J,Galbally I E, Gerosa G, Granier C,Griffiths P T, Hossaini R, Hu L,Jöckel P, Josse B, Lin MY, Mertens M, Morgenstern O, Naja M, Naik V, OltmansS, Plummer D A, Revell L E, Saiz-Lopez A, Saxena P,Shin Y M,Shahid I,Shallcross D,Tilmes S,Trickl T,Walling-ton T J, Wang T, Worden H M, Zeng G. 2020. Tropo-spheric ozone assessment report: A critical review ofchanges in the tropospheric ozone burden and budget from1850 to 2100[J]. Elementa: Science of the Anthropocene,
8(1):034. doi: 10.1525/elementa.2020.034.
Bilger W, Rolland M, Nybakken L. 2007. UV screening in higher plants induced by low temperature in the absence of UV-B radiation[J]. Photochemical amp; Photobiological Scien-ces, 6(2):190-195. doi: 10.1039/B609820G.
Britt A B. 2004. Repair of DNA damage induced by solar UV
[J]. Photosynthesis Research,81(2):105-112. doi:10.1023/
B:PRES.0000035035.12340.58.
Fernández M B, Tossi V, Lamattina L, Cassia R. 2016. A com- prehensive phylogeny reveals functional conservation of the UV-B photoreceptor UVR8 from green algae to higher plants[J]. Frontiers in Plant Science,7:1698. doi:10.3389/ fpls.2016.01698.
Frohnmeyer H,Staiger D. 2003. Ultraviolet-B radiation-mediated responses in plants. Balancing damage and protection[J].
Plant Physiology, 133(4):1420-1428. doi: 10.1104/pp.103.
030049. Hollósy F. 2002. Effects of ultraviolet radiation on plant cells[J]. Micron, 33 (2) : 179-197. doi: 10.1016/s0968-4328(01)00011-7.
Jenkins G I. 2009. Signal transduction in responses to UV-B radiation [J]. Annual Review Compilations: Plant Photoreceptors, 60: 407-431. doi: 10.1146/annurev.arplant.59.032607.092953.
Medda S, Dessena L, Mulas M. 2020. Monitoring of the PAL enzymatic activity and polyphenolic compounds in leaves and fruits of two myrtle cultivars during maturation[J].
Agriculture,10(9):389. doi:10.3390/agriculture10090389.
Meyer P, Van de Poel B, De Coninck B. 2021. UV-B light and its application potential to reduce disease and pest incidence in crops [J]. Horticulture Research, 8 (1) : 194. doi:10.1038/s41438-021-00629-5.
Prásil I, Zámecník J. 1998. The use of a conductivity measure- ment method for assessing freezing injury:I. Influence of leakage time, segment number, size and shape in a sample on evaluation of the degree of injury [J]. Environmental and Experimental Botany,40(1):1-10. doi:10.1016/S0098-
8472(98)00010-0.
Rojas-Lillo Y, Alberdi M, Acevedo P, Inostroza-Blancheteau C, Rengel Z, Mora M de la L, Reyes-Diaz M. 2014. Manganese toxicity and UV-B radiation differentially influence the physiology and biochemistry of highbush blueberry (Vaccinium corymbosum) cultivars[J]. Functional Plant Biology, 41(2):156-167. doi:10.1071/FP12393.
Rozema J, van de Staaij J, Björn L O, Caldwell M. 1997. UV-B as an environmental factor in plant life: Stress and regula- tion[J]. Trends in Ecology amp; Evolution, 12 (1) : 22-28.doi:10.1016/s0169-5347(96)10062-8.
Rubio-Melgarejo A, Balois-Morales R, Ochoa-Jiménez V A, Casas-Junco P P, Jiménez-Zurita J O, Bautista-Rosales P U, Berumen-Varela G. 2021. Differential responses of antioxi- dative system during the interaction of soursop fruits (Annona muricata L.) and Nectria haematococca at post- harvest storage[J]. Plants,10(7) :1432. doi:10.3390/plan-ts10071432.
Sen A, Alikamanoglu S. 2013. Antioxidant enzyme activities, malondialdehyde, and total phenolic content of PEGinduced hyperhydric leaves in sugar beet tissue culture[J].
In Vitro Cellular amp; Developmental Biology—Plant,49(4) :396-404. doi:10.1007/s11627-013-9511-2.
Singh B, Suri K, Shevkani K, Kaur A, Kaur A, Singh N. 2018. Enzymatic browning of fruit and vegetables: A review[J].
Enzymes in Food Technology: 63-78. doi: 10.1007/978-981-13-1933-4 4. Singleton V L, Orthofer R, Lamuela-Raventós R M. 1999. Analysis of total phenols and other oxidation substrates and antioxidants by means of folin-ciocalteu reagent [J].
Methods in Enzymology, 299: 152-178. doi: 10.1016/
S0076-6879(99)99017-1.
Stracke R, Favory J, Gruber H, Bartelniewoehner L, Bartels
S, Binkert M, Funk M, Weisshaar B, Ulm R. 2010. The Arabidopsis bZIP transcription factor HY5 regulates expression of the PFG1/MYB12 gene in response to light and ultraviolet-B radiation[J]. Plant, Cell amp; Environment,
33(1):88-103. doi:10.1111/j.1365-3040.2009.02061.x.
Tilbrook K, Arongaus A B, Binkert M, Heijde M, Yin R H, Ulm R. 2013. The UVR8 UV-B photoreceptor:Perception, signaling and response [M/OL]//The American Society of Plant Biologists. The Arabidopsis Book, The American Society of Plant Biologists (11) : 1-21. doi : 10.1199/tab.
0164. Tsikas D. 2017. Assessment of lipid peroxidation by measuring malondialdehyde (MDA) and relatives in biological samples: Analytical and biological challenges[J]. Analytical Biochemistry, 524:13-30. doi:10.1016/j.ab.2016.10.021.
Veiga M,Costa E M, Silva S, Pintado M. 2020. Impact of plant
extracts upon human health: A review[J]. Critical Reviews in Food Science and Nutrition, 60 (5) : 873-886. doi: 10.1080/10408398.2018.1540969.
Wang H,Guo Y J,Zhu J J, Yue K, Zhou K B. 2021a. Characteristics of mango leaf photosynthetic inhibition by enhanced UV-B radiation [J]. Horticulturae, 7 (12) : 557. doi: 10.
3390/horticulturae7120557.
Wang M, Leng C Q, Zhu Y H, Wang P, Gu Z X, Yang R Q.
2021b. UV-B treatment enhances phenolic acids accumulation and antioxidant capacity of barley seedlings[J]. LWTFood Science amp; Technology, 153 (Suppl C) :112445. doi:
10.1016/j.lwt.2021.112445.
Zambrano-Zaragoza M L, Gutiérrez-Cortez E, Del Real A, González-Reza R M, Galindo-Pérez M J, Quintanar- Guerrero D. 2014. Fresh-cut Red Delicious apples coating using tocopherol/mucilage nanoemulsion: Effect of coating on polyphenol oxidase and pectin methylesterase activities [J]. Food Research International, 62: 974-983. doi: 10.
1016/j.foodres.2014.05.011.
Zhang W L,Pan Y G, Jiang Y M, Zhang Z K. 2023. Advances in control technologies and mechanisms to treat peel browning in postharvest fruit[J]. Scientia Horticulturae, 311: 111798. doi: 10.1016/j.scienta.2022.111798.
Zlatev Z S, Lidon F J C, Kaimakanova M. 2012. Plant physiological responses to UV-B radiation [J]. Emirates Journal of Food and Agriculture, 24(6) :481-501. doi:10.9755/ejfa.v24i6.14669.
(责任编辑邓慧灵)
